一种荧光RPA方法鉴定伊蚊的研究*
2020-03-26张晓龙刘莹莹曹晓梅
李 颖 张晓龙 慈 颖 刘莹莹 杨 燕 曹晓梅
(中国检验检疫科学研究院,北京 100176)
蚊虫是一类重要的医学媒介,不同种属蚊虫传播的病原有差别,伊蚊可传播登革热、基孔肯雅热以及黄热病等多种疾病(边长玲等,2009;马孟哲等,2019),而库蚊则可传播流行性乙型脑炎,因此蚊种鉴定对蚊媒疾病的防控有重要意义。目前,用于蚊虫的分类鉴定的方法主要有形态学鉴定和分子鉴定。形态学鉴定目前多限于成蚊和4龄幼虫的形态鉴别(孙立新等,2010),并且受采集过程、采集方法及标本运送过程的影响,当专业人员鉴定时,许多蚊虫标本已残缺不全,难以进行准确的形态学鉴定分类,或者受蚊种鉴定人员的水平所限,鉴定结果产生偏差。分子生物学鉴别技术从分子水平上阐明物种间的差别,不受样本形态完整程度、龄期等的限制,所需样本量少,是解决蚊虫分类难题的有效手段。
重组酶聚合酶扩增(Recombinase polymerase amplification,RPA)是一种由重组酶、单链DNA结合蛋白和链置换聚合酶参与的恒温扩增新技术,可实现较低温度(23℃~45℃)核酸快速(5~20 min)扩增(杜亚楠等,2018)。自2006年RPA技术问世以来,已取得长足发展,与不同的检测方法结合建立了实时荧光RPA、RPA-LFD(侧流层析试纸条检测)、RPA-ELISA等技术,在病毒与细菌检测、动植物检验检疫、食品安全检测与基因突变等方面得到广泛应用。
本研究根据白纹伊蚊Aedesalbopictus、埃及伊蚊Ae.aegypti的rDNA-ITS2序列,建立了伊蚊实时荧光RPA鉴定方法,实现了对白纹伊蚊、埃及伊蚊的特异性鉴别,可用于常见伊蚊的现场鉴定,并为其他蚊种的分类鉴定研究提供新的思路和依据。
1 材料与方法
1.1 蚊虫样本
白纹伊蚊Aedesalbopictus、埃及伊蚊Ae.aegypti、 刺扰伊蚊Ae.vexans、背点伊蚊Ae.dorsalis样本由大连国际旅行卫生保健中心馈赠,三带喙库蚊Culextritaeniorhynchus、中华按蚊An.ophelessinensis、常型曼蚊Mansoniauniformis为本实验室保存样本。样本依据《中国重要医学昆虫分类与鉴别》、《中国国境口岸医学媒介生物鉴定图谱》进行形态学鉴定。
1.2 主要试剂与仪器
荧光RPA反应试剂盒(Twist AmpTMExo Kits)、基础RPA反应试剂盒(Twist AmpTMBasic Kits)为TwistDx公司产品;PCR扩增试剂(TaqTMVersion 2.0 plus dye)、DNAMarker为TaKaRa公司产品;核酸提取试剂盒(血液/细胞/组织基因组DNA提取试剂盒)为天根生化科技(北京)有限公司产品。PCR仪为ABI 7500 Fast荧光PCR仪和ABI 2700 PCR仪。
1.3 核酸提取
白纹伊蚊、埃及伊蚊样本各5只,刺扰伊蚊、背点伊蚊、三带喙库蚊、中华按蚊、常型曼蚊样本各3只,单只蚊虫样本整只研磨提取核酸。使用血液/细胞/组织基因组DNA提取试剂盒(天根)提取单蚊基因组DNA。
1.4 引物和探针设计筛选
参考文献(耿艺介等,2008;师永霞等,2008;刘飞等,2015;尹小平等,2016)选择白纹伊蚊和埃及伊蚊的第二内转录间隔区ITS2序列为目的基因,在GenBank中查找相关序列,按Twistamp-assay-design技术要求应用Oligo7软件设计引物和探针,通过Blast比对确定其特异性,然后用基础RPA对引物进行初筛,确定使用表1中所列的引物和探针进行后续实验。引物和探针均由英潍捷基(上海)贸易有限公司合成。

表1 本实验所用候选引物和探针
将基础RPA扩增产物送英潍捷基(上海)贸易有限公司测序,测序结果登录NCBI进行Blast比对分析。同时,依据参考文献(Folmeretal.,1994;廉国胜等,2015)以相同样本的DNA为模板进行COI序列扩增,然后进行测序、Blast比对分析,比较两种方法的结果,以验证RPA鉴定结果的准确性。
1.5 反应体系和条件
荧光RPA反应体系(50 μL):Primer Free Rehydration buffer 29.5 μL,无核酸酶水 11.2 μL,正向引物(10 μmol/L)2.1 μL,反向引物(10 μmol/L)2.1 μL,探针(10 μmol/L)0.6 μL,模板2 μL,将上述溶液加至荧光RPA冻干酶粉反应管中,再加入280 mmol/L MgOAc 2.5 μL。混合均匀后,分装20 μL至0.1 mL PCR反应管中,立即置于荧光PCR中开始反应。反应条件为39℃,30 s(收集荧光),40个循环(反应时间共20 min)。
基础RPA反应体系(50 μL):Primer Free Rehydration buffer 29.5 μL,无核酸酶水 11.2 μL,正向引物(10 μmol/L)2.4 μL,反向引物(μmol/L)2.4 μL,模板2 μL,将上述溶液加至基础RPA冻干酶粉反应管中,再加入280 mmol/L MgOAc 2.5 μL,混匀后立即放入39℃恒温金属浴中开始反应,反应时间20 min。
COI扩增反应体系:白纹伊蚊COI序列扩增所用引物参考廉国胜等(2015)文献,埃及伊蚊COI序列扩增所用引物参考Folmer等(1994)文献(表1)。PCR反应体系25 μL,包括2×Master Mix 12.5 μL,无核酸酶水 9 μL,上下游引物各0.5 μL,模板2.5 μL。
1.6 特异性试验
采用筛选的引物和探针,分别以白纹伊蚊、埃及伊蚊、刺扰伊蚊、背点伊蚊、三带喙库蚊、中华按蚊、常型曼蚊DNA为模板,用RPA Exo试剂盒进行荧光RPA检测,验证其特异性。
1.7 灵敏度试验
测定DNA样本浓度,经过适当稀释,稀释至1、10-1、10-2、10-3、10-4ng/μL,进行荧光RPA检测,测试该方法的灵敏度。
1.8 重复性试验
将上述稀释的DNA样本进行重复性实验,每个浓度进行3次重复检测,分析该方法的稳定性。
2 结果
2.1 rDNA-ITS2序列基础RPA扩增结果和COI序列扩增结果比较

图1 筛选引物基础RPA扩增结果
用大连国际旅行卫生保健中心提供的白纹伊蚊和埃及伊蚊样本提取DNA,以此为模板,以筛选出的引物进行基础RPA扩增,同时进行COI序列扩增。白纹伊蚊用5个样本进行了重复实验,结果如图1、2。筛选出的白纹伊蚊引物扩增目标片段大小为219 bp,筛选出的埃及伊蚊引物扩增目标片段大小为132 bp。从图1看出,5个白纹伊蚊和埃及伊蚊均有目标大小条带。基础RPA扩增产物经测序,测序结果登录NCBI进行Blast比对,白纹伊蚊扩增序列与NCBI数据库中白纹伊蚊rDNA-ITS2序列相似性均>98%,可判断为白纹伊蚊;埃及伊蚊RPA扩增序列与NCBI数据库中埃及伊蚊rDNA-ITS2序列相似性均>98%(王刚,2011;Cywinskaetal., 2006),可判断为埃及伊蚊。COI序列PCR扩增结果如图2,5个白纹伊蚊和埃及伊蚊样本均有目标条带,PCR产物测序后登录NCBI进行Blast比对,结果分别与白纹伊蚊COI序列相似性>99%、与埃及伊蚊COI序列相似性>99%,可判断分别为白纹伊蚊和埃及伊蚊。RPA方法蚊种鉴定结果与COI序列分析结果一致。
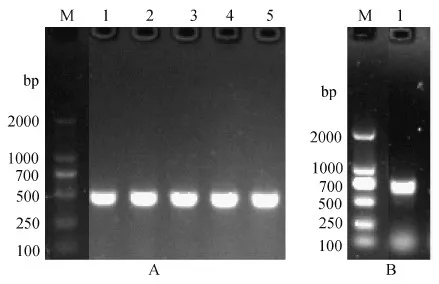
图2 COI序列PCR结果
2.2 特异性试验结果
伊蚊荧光RPA鉴定方法特异性实验结果见图3、4。白纹伊蚊荧光RPA特异性实验结果如图3所示,仅有白纹伊蚊样本有扩增曲线,其他蚊种和空白对照均没有扩增曲线,表明筛选出的白纹伊蚊引物和探针与埃及伊蚊、刺扰伊蚊、背点伊蚊、三带喙库蚊、中华按蚊、常型曼蚊DNA均无交叉反应。埃及伊蚊荧光RPA特异性实验结果如图4所示,仅有埃及伊蚊产生了扩增曲线,其他蚊种和空白对照均未产生扩增曲线,表明筛选出的埃及伊蚊引物和探针与白纹伊蚊、刺扰伊蚊、背点伊蚊、三带喙库蚊、中华按蚊、常型曼蚊DNA均无交叉反应。
2.3 灵敏度实验结果
检测样本DNA的浓度,进行适当稀释,稀释至1、10-1、10-2、10-3、10-4ng/μL,进行荧光RPA检测,结果如图5、6。白纹伊蚊和埃及伊蚊样本浓度在10-3~1 ng/μL范围内均可产生扩增曲线,10-4ng/μL和空白对照均无扩增曲线。但当浓度稀释至10-3ng/μL时虽有扩增曲线,但结果不稳定(见2.4部分),因此,将0.01 ng/μL作为本方法的检出限。
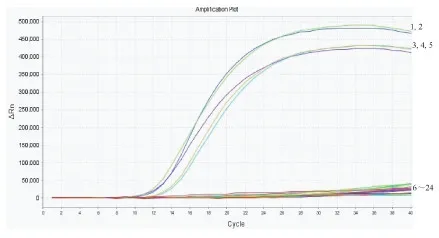
图3 白纹伊蚊荧光RPA特异性检测
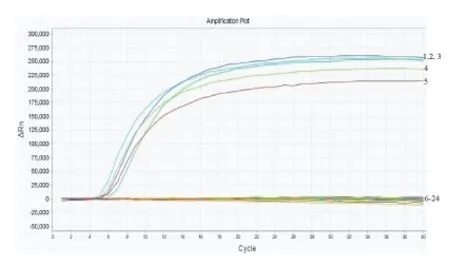
图4 埃及伊蚊RPA特异性实验结果

图5 白纹伊蚊荧光RPA灵敏度实验结果
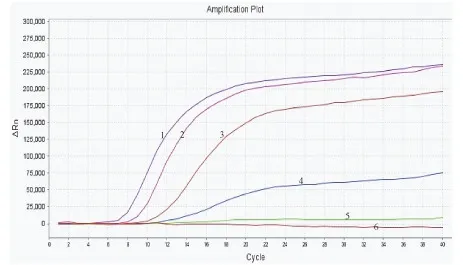
图6 埃及伊蚊荧光RPA灵敏度试验结果
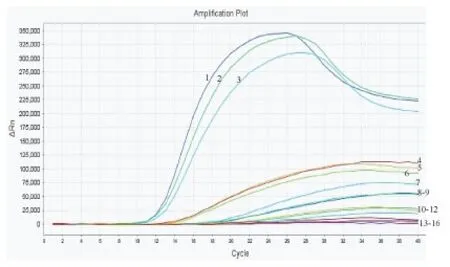
图7 白纹伊蚊荧光RPA重复性实验结果
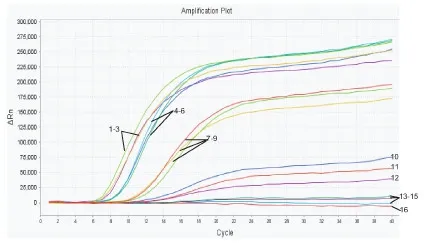
图8 埃及伊蚊荧光RPA重复性实验结果
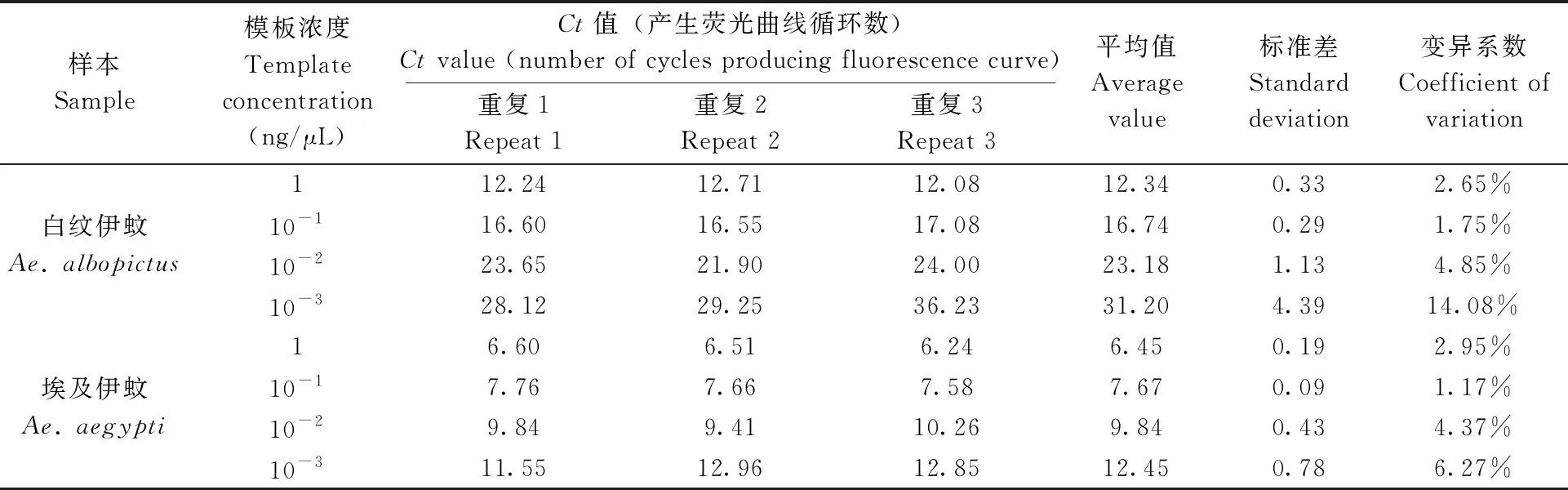
表2 重复性实验结果
2.4 重复性实验结果
选取上述稀释浓度的DNA样本,进行重复性实验,每个浓度3个平行,结果如图7、8和表2。浓度在10-2~1 ng/μL时,相同浓度的检测结果一致,变异系数均小于5%。当稀释至10-3ng/μL时,虽有扩增曲线,但荧光信号与空白接近,而且变异系数较大,尤其白纹伊蚊在10-3ng/μL时变异系数达到14.08%。实验结果表明,当模板浓度在方法检出限0.01 ng/μL以上时检测结果稳定,重复性良好。
3 讨论
蚊虫是重要的医学昆虫,对其进行分类鉴定研究对防控蚊媒传染病具有重要的意义。长期以来,蚊种的分类鉴定以传统的形态学鉴定为主,但对于形态相似的近缘种、形体不完整的样本以及幼虫,利用形态学很难进行准确的种类鉴定。分子生物学方法是从DNA水平进行蚊种鉴定,是解决上述问题的有效手段,现有的分子鉴别技术有DNA探针技术、PCR和测序技术、RAPD技术、RFLP技术等(孙立新等,2010;彭淑琼等,2010),但由于上述技术中有些需要特定设备,有的操作繁杂,有的还需要进行生物信息学分析,因此在现场快速检测中的应用受到一定限制。荧光RPA技术是一种新型的等温快速检测技术,该方法可在恒温条件下进行核酸扩增,操作简单,无需热循环过程,缩短了检测时间,同时减少了能量和成本,特异性好,灵敏度高(杜亚楠等,2018),已在病毒检测(马磊等,2019;林彦星等,2019)、细菌检测(李轲等,2019;刘婧文等,2020)、食品安全(林霖等,2018;谢实龙等,2019)等方面得到很好应用。
内转录间隔区(ITS)不参与核糖体形成,受到的选择压力小,进化速度快,适合于属间、种间的系统发育和种群分化方面的研究,尤其是ITS2种内相对保守,而种间存在一定的差异,可应用于近缘种的鉴定和种群间分化程度研究(江世宏等,2008)。师永霞等(2008)等利用rDNA-ITS2对致倦库蚊、三带喙库蚊、白纹伊蚊、骚扰阿蚊和中华按蚊进行了分子鉴定,其结果与形态学鉴定一致,说明rDNA-ITS2的分子鉴定可成功应用于成蚊和幼蚊的亚科、属和种的区分。郭秀霞(2020)等利用rDNA-ITS2对淡色库蚊、三带喙库蚊、二带喙库蚊、白纹伊蚊、刺扰伊蚊、中华按蚊、骚扰阿蚊、常型曼蚊和黄色柯蚊成蚊进行了分子鉴定,分子鉴定结果与形态学鉴定吻合率100%,说明rDNA-ITS2基因可用于蚊虫属和种的鉴定。
本研究对荧光RPA伊蚊鉴定方法进行了初探,初步建立白纹伊蚊和埃及伊蚊的荧光RPA鉴定方法,特异性良好,与伊蚊属部分蚊种以及三带喙库蚊、中华按蚊、常型曼蚊DNA均无交叉反应。在39℃,20 min即可完成检测。对目的DNA的检测限为0.01 ng/μL,3个平行的变异系数值均<5%,显示了良好的重复性。本研究还用相同的引物,采用基础RPA方法进行了扩增、测序、BLAST比对分析,其鉴定结果显示与COI序列分析鉴定结果一致,进一步验证了建立的荧光RPA方法的准确性。而且,荧光RPA方法和基础RPA的方法相比,省去了DNA纯化和凝胶电泳的繁琐步骤而更加简便,可实时观察检测结果,为病媒生物鉴定提供了新的技术方法,非常适合于蚊虫的现场快速检测,对蚊媒病的防控具有重要意义。
本研究仅以白纹伊蚊和埃及伊蚊为例进行了荧光RPA伊蚊鉴定方法的初探,其他伊蚊的荧光RPA鉴定方法的建立及优化需要进行后续研究,并且在后续研究中会考虑以所鉴定蚊种的近缘种作为对照,进一步验证方法的特异性。
