消肿止痛合剂对大鼠膝骨性关节炎软骨中AMPK/mTOR信号通路影响的实验研究
2020-03-26李金鹏刘涛何志军李岩陈文宋渊
李金鹏 刘涛 何志军 李岩 陈文 宋渊
甘肃省中医院,甘肃兰州730050
膝骨性关节炎(knee osteoarthritis,KOA)是最常见的关节疾病,主要表现为关节疼痛或功能障碍,晚期甚至导致关节变形。KOA的发病机制尚未完全阐明,但一般认为KOA主要由生物力学和遗传因素以及外源性因素引起,包括创伤、细菌感染或基因突变,这些因素引起滑膜代谢的改变[1]。关节软骨的损伤常常是不可逆的。药物治疗和外科治疗都不能阻止KOA的进展,因此,KOA的治疗主要集中于缓解、减少炎症、改善或恢复关节功能、延缓疾病进展和提高生活质量[2]。在西医中,药物治疗和外科治疗是KOA的两大主要干预措施。药物治疗起效很快,但总是伴随着一定的副作用和胃肠道不良反应。手术治疗费用昂贵,还伴有禁忌证和并发症,限制了它的临床广泛应用。而中药制剂在临床治疗KOA具有明显疗效,副作用低,价格低廉,并发现其具有促进软骨细胞增殖、抑制亚硝普钠诱导的软骨细胞凋亡的作用[3]。本实验通过观察消肿止痛合剂对改良Hulth法KOA模型p-AMPK/mTOR信号转导通路的变化,为消肿止痛合剂在治疗KOA方面的临床应用提供实验依据。
1 材料与方法
1.1 动物及药物
10月龄SPF级健康Wistar大鼠80只,雌雄各半,体质量(300±20)g,生产许可证号为SCXK(甘)2015-0036,由甘肃中医药大学实验动物中心所提供。消肿止痛合剂(由甘肃省中医院制剂科生产,生产批号20051122),硫酸氨基葡萄糖片(0.314 g/片)(新兴同仁药业有限公司,国药准字:H20041317批号:16030)。
1.2 试剂及仪器
EDTA缓冲液(上海西唐生物科技有限公司),PrimeScript TM RT reagent Kit逆转录试剂盒(宝日医生物技术有限公司,生产批号:DRR037),SYBR Premix Ex Taq TM实时定量PCR试剂盒(宝日医生物技术有限公司,生产批号:RR820 A),E.Z.N.A.Total RNA KitⅠ(美国omega公司,生产批号:R6834-01),TRIZOL 试剂(Invitrogen life technologies),琼脂糖(上海川翔生物科技有限公司);IL-6、MMP-3、COX-2试剂盒购于南京建成生物工程研究所;p-AMPK、mTOR抗体(生工有限公司);p-AMPK、mTOR引物(大连宝生物有限公司)。-80℃超低温冰箱88400V60(美国 thermo公司);OLYMPUSCH光学显微镜(JAPAN);台式高速冷冻离心机 CT14RD(德国Eppendorf公司);PCR热循环仪 S1000(美国伯乐 Bio-rad公司);荧光定量PCR仪(美国Bio-rad iCycler iQ伯乐公司)。
1.3 模型分组及制备
按随机数字表法分为4组,每组各20只。分为观察组(消肿止痛合剂组)、对照组(硫酸氨基葡萄糖片组)、模型组、假手术组。适应性喂养1周。1周后,采用10%水合氯醛按照0.35 mL/100 g进行腹腔内注射麻醉,选取左膝关节;假手术组仅切开皮肤后直接将其缝合,其余大鼠均采用改良 Hulth法[4]造模:打开关节腔,用镊子将髌骨向外侧推至脱位,并屈曲膝关节,切断前交叉以及内侧副韧带,再切除内侧半月板。术后给予大鼠40万U青霉素臀大肌注射1周。造模后大鼠全部存活,手术伤口未见红肿及渗出,术后8~10 d基本愈合,伤口愈合后每日驱赶大鼠活动半小时,驱赶8周后KOA造模成功。
1.4 干预方法
参考《中药药理研究方法学》[5]根据人和大鼠的计量折算系数确定给药量。观察组给予消肿止痛合剂1.8 mL/(kg·d)灌胃。对照组给予硫酸氨基葡萄糖片按170 mg/(kg·d)研粉蒸馏水稀释后灌胃;模型组造模后给予0.9%生理盐水灌胃;假手术组自由饮水。灌胃8周后处死每组大鼠并取样。
1.5 检测指标及方法
1.5.1 血清生化指标检测:心脏取血后,1 500 r/min离心15 min,分离血清,采用ELISA试剂盒测定IL-6、MMP-3、COX-2,使用酶标仪测定 OD 值,通过标准曲线计算每孔中的量。1.5.2 RT-PCR法检测关节软骨组织中 LC3、Beclin1、caspase-9 mRNA的表达[6]:用Trizol试剂(Invitrogen life technologies)提取总RNA,用Prime Script RT试剂盒(TaKaRa,大连,中国)将每个样本的 2μg总 RNA反转录为cDNA。反转录条件:37℃ 15 min,85℃ 5 s,4℃ 30 min。所用的引物序列见表1。

表1 目的因子PCR扩增的引物核苷酸序列Table 1 Primer nucleotide sequences of amplified target factors for PCR
1.5.3 Western blotting法检测关节软骨组织中p-AMPK、mTOR 蛋白表达[7]:加入缓冲液提取蛋白,湿式电泳仪转膜300 mA、60 min;5%脱脂牛奶室温下封闭1 h;Ⅰ抗和内参照抗体4℃孵育16 h;加入稀释好的二抗(抗兔Ig G),在室温下孵育1 h,使用ECL(Amersham Pharmacia Biotech)显影,并使用ChemiDoc XRS(BioRad)显色。
1.6 数据统计方法
采用SPSS 17.0统计学软件进行统计分析,计量资料采用均数±标准差(珋x±s)表示,符合正态分布的计量资料采用单因素方差分析法,多重比较用LSD-t检验,组内比较采用配对t检验,组间比较采用独立样本t检验,不符合正态分布的计量资料采用秩合检验,以(设定检验水准)P<0.05认为差异具有统计学意义,P<0.01认为差异具有显著统计学意义。
2 结果
2.1 ELISA 检测血清中 IL-6、MMP-3、COX-2水平
与假手术组相比,模型组血清中IL-6、MMP-3、COX-2水平高于正常组(P<0.05);与模型组相比,观察组、对照组血清中 IL-6、MMP-3、COX-2 水平明显下降(P<0.05);与对照组相比,观察组IL-6、MMP-3、COX-2水平表达差异有统计学意义(P<0.05),见表 2。

表2大鼠血清中IL-6、MMP-3、COX-2含量比较(珋x±s)Table 2 Comparison of serum IL- 6,MMP-3,and COX-2 in rats(珋x±s)
2.2 关节软骨中 LC3、Beclin1、caspase-9mRNA 的表达
与假手术组相比,模型组关节软骨组织中LC3、Beclin1mRNA表达减少,caspase-9 mRNA表达增加(P<0.05);与模型组相比,观察组、对照组关节软骨组织中 LC3、Beclin1mRNA表达增高,caspase-9 mRNA表达降低(P<0.05);与对照组相比,观察组LC3、Beclin1、caspase-9 mRNA 表达差异有统计学意义(P<0.05),见表 3。

表3 大鼠关节软骨组织 LC3、Beclin1、caspase-9 mRNA含量比较(珋x±s)Table 3 Comparison of the contents of LC3,Beclin1,and caspase-9mRNA in articular cartilage of rats(珋x±s)
2.3 关节软骨中p-AMPK、mTOR蛋白表达的影响
与假手术组相比,模型组p-AMPK表达明显减弱(P<0.05),且 mTOR表达增强(P<0.05)。与模型组相比,观察组、对照组可同时上调关节软骨组织中p-AMPK水平,并下调mTOR蛋白表达;与对照组相比,观察组p-AMPK、mTOR蛋白表达差异有统计学意义(P<0.05),见图 1、表 4。
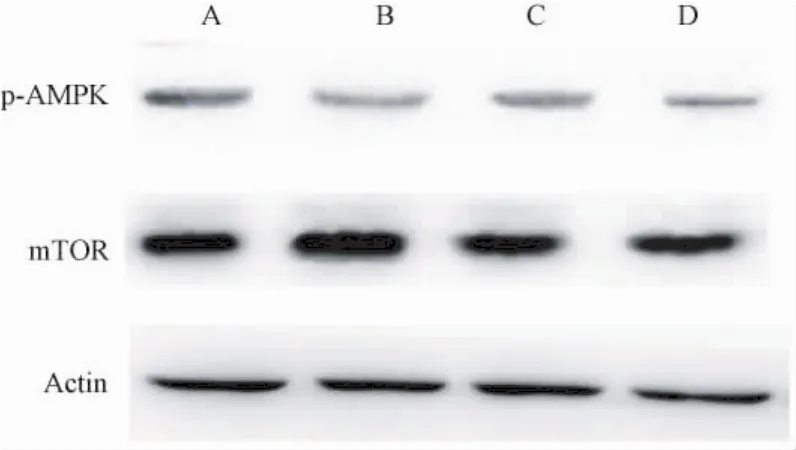
图1 各组 p-AMPK、mTOR蛋白表达比较(Western blot)A:假手术组;B:模型组;C:观察组;D:对照组。Fig.1 Comparison of p - AMPK and mTOR protein expression between each group(Western blotting)A:Sham operation group;B:Model group;C:Observation group;D:Control group.
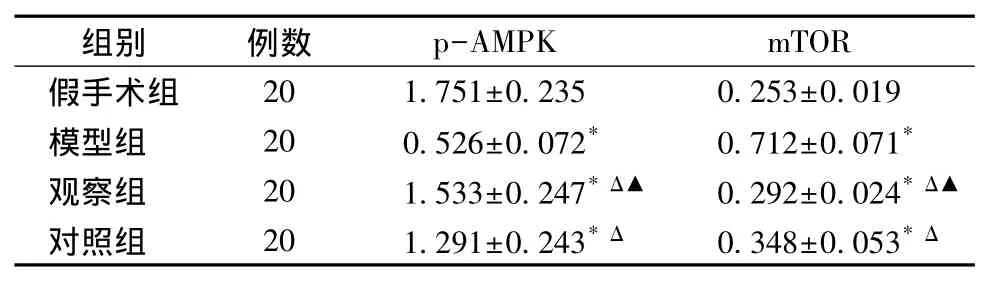
表4 消肿止痛合剂对关节软骨p-AMPK、mTOR蛋白表达的影响(珋x±s)Table 4 Effect of anti-swelling and analgesic mixture on the protein expressions of p-AMPK and mTOR in the articular cartilage(珋x±s)
3 讨论
KOA是多种因素共同作用而导致的复杂疾病,除关节置换术外,缺乏有效的治疗方法,但仍不能有效解决关节活动的问题,也不能改善软骨的破坏或相关炎症。滑膜炎症是骨关节炎关节中经常观察到的现象,通过形成各种分解代谢和促炎介质,从而改变软骨基质降解和修复之间的平衡,从而有助于OA的发病机制[8]。分泌的炎性分子如促炎细胞因子,是OA病理生理学干扰过程的关键介质。最近的证据表明包括IL-1、IL-6和TNF-α在内的细胞因子促进关节软骨细胞外基质蛋白降解,它们也与其他细胞因子协同作用以放大和加速软骨破坏[9]。IL-1β是能够诱导软骨细胞和滑膜细胞合成基质金属蛋白酶(matrix metallo proteinase,MMP)的强效促炎细胞因子,是OA关节软骨退变的关键介质。肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)通常被认为参与软骨增生性疾病。IL-6在KOA关节炎症过程中释放,在软骨细胞和软骨外植体中,随着MMP-3和MMP-13产量的增加,IL-6可刺激软骨细胞钙化,降低蛋白聚糖含量。IL-6基因敲除的雄性小鼠可导致晚期KOA的发生,提示其在KOA软骨破坏和骨重建的生物力学控制中作为关键介质[10]。而COX-2则广泛参与前列腺素合成,能够有效调节血小板聚集,促进前列腺素合成进而加重机体炎症反应水平及红肿热痛症状。
自噬是一种高度保守的细胞行为,主要参与受损细胞器的清除,以重新循环或重复利用细胞内的大生物分子,以维持它们的稳态和促进细胞存活[11]。近年来的研究证实了自噬在各种组织中的存在,并在各种疾病的进展中起着重要的保护作用[12]。软骨是一种特殊的间充质组织,研究表明在神经退行性疾病过程中并发软骨自噬水平受到抑制。同时,细胞凋亡在软骨退变过程中起着至关重要的作用,自噬水平升高可抑制细胞凋亡[13]。软骨细胞的凋亡是椎间盘突出或OA等各种疾病的起始和驱动因素。因此,抑制细胞凋亡可能有助于软骨修复和缓解症状。自噬水平的升高是抑制细胞凋亡的重要机制。目前的研究表明细胞自噬水平与KOA状态之间存在高度的相关性[14]。因此,考虑如何减少软骨细胞过度凋亡以预防和治疗骨关节炎时,保持软骨细胞增殖和凋亡的平衡是关键。软骨细胞凋亡的机制是复杂的,尚未完全阐明。然而,它可能与多种信号转导通路有关,其中AMPK/mTOR信号转导通路被认为是软骨细胞凋亡的重要途径[15]。AMPK是一种异源三聚体蛋白,由α催化亚基和β、γ调节亚基组成,它能调控细胞的能量代谢并通过p53和m TOR调控细胞的凋亡。研究证实,在关节软骨细胞中,AMPK都能被异常激活,AMPK磷酸化的激活可对mTOR、P13 K等一些在细胞能量代谢过程中的关键蛋白激酶进行调控,从而影响细胞凋亡[16]。Caspases-9 作为凋亡的执行者,它可以活化DNA断裂因子,最终导致细胞死亡。通过AMPK/mTOR途径降低Caspases-9活性,从而减轻KOA损伤所致的细胞凋亡。在自噬过程中,LC3是将细胞内LC3Ⅰ转化成LC3Ⅱ,并且整合到自噬体膜上,当自噬体融合成溶酶体时LC3Ⅱ将会被降解,当发生KOA时可以检测到LC3Ⅱ的浓度显著增高,因为此时自噬体的融合障碍,LC3Ⅱ降解减少。Beclin-1蛋白也是重要的自噬分子标志,参与自噬前体的形成。Zhang等[17]研究发现在骨关节炎患者的软骨细胞中可见到ULK1、Beclin1和LC3等自噬相关的分子减少,细胞自噬能力降低可能是其发病的一个新机制。
中医学认为KOA属于“骨痹”的范畴。骨痹首出于《素问·痹论》,指气血不足或亏虚,风寒湿之邪伤于髓骨,表现出的病症。而“本虚标实”是该病的主要特点。消肿止痛合剂主要作用是“益气活血、消肿止痛”,由当归、黄芪、生地、青皮、川芎、红花、三七、木香、白芍、桃仁、泽兰等药物组成,君药当归、黄芪、川芎活血补气祛瘀,消肿止痛,配桃仁、红花加强其破瘀血、生新血之力,共为臣药,合三七以行瘀、消肿、止痛功效,再配合青皮、木香行气止痛,辅以生地、白芍凉血消瘀,泽兰消散肿胀。
本研究发现,经消肿止痛合剂治疗后,KOA大鼠血清 IL- 6、MMP-3、COX-2水平降低,LC3、Beclin1、p-AMPK 的表达量增高,caspase-9、mTOR的表达量降低,说明消肿止痛合剂可能与p-AMPK/m TOR信号通路密切相关,通过上调软骨细胞的自噬水平来防止KOA诱导的软骨损伤,进而促进KOA关节软骨损伤的修复,延缓关节软骨退变,对软骨起到一定的保护作用。
