施氮对黄化谷子生理特性及品质的影响
2020-03-26郝兴宇胡桃花贺晓红
袁 蕊,郝兴宇,胡桃花,贺晓红,李 萍
(1.江苏徐淮地区徐州农业科学研究所,江苏徐州221131;2.山西农业大学农学院,山西太谷030801;3.朔州市气象局,山西朔州036000;4.太谷县农业局植保站,山西太谷030800)
谷子(Setaria italica),去壳后俗称小米,为我国北方旱作农业地区的小杂粮作物[1-2]。谷子具有抗病性强、耐旱、耐贫瘠和耐储存等特性,且食味品质佳,营养丰富,市场前景好[3]。其中,晋谷21 号一直被公认为顶级米质品种,由晋谷21 号熬成的小米粥,味道香浓且适口性好,但晋谷21 号的主茎高达1.5 m,谷子成熟时的穗大且质量高导致茎秆大面积倾斜或倒伏,会使籽粒灌浆不充分造成减产,给谷子生产带来较大的损失[4]。
育种始终是农业领域研究的重要内容之一,目前在农作物的诱变育种工作中广泛应用的有效化学诱变剂是甲基磺酸乙酯(EMS)[5]。利用EMS 化学诱变剂诱发作物后,能够丰富谷子种质资源,但存在一定的叶色突变率,诱变后的作物其叶片颜色发生变化,叶色表型出现黄化、白化或条纹等症状[6]。叶色黄化的谷子直接表现为叶片颜色为黄色,其叶片中叶绿素含量较少,光合作用能力降低,造成谷子早衰和减产[7]。诱变育种在作物新品种的培育中发挥着重要作用,是当前研究的重要课题,但有益突变率仍然很低[8]。叶片中氮元素含量与光合作用直接相关,适量施氮能增加叶片中叶绿素含量,增强光合作用,提高作物干物质产量的积累[9-10]。植物的氮素需求量以及氮素施用的有效性已成为植物学家的研究重点,但针对谷子诱变育种过程中出现的叶色突变体,施氮能否有效改善谷子叶片的光合能力,国内还鲜有报道。
本研究通过对EMS 诱变育种过程中出现的叶色黄化突变体谷子进行叶面喷施氮肥处理后,在抽穗和灌浆期测定黄化谷子叶片中光合特性、光合色素、糖类化合物含量,待谷子成熟收获后测定谷子的形态结构、干物质量、产量以及谷子脱壳后小米品质等指标,为丰富谷子育种材料和提高叶色黄化突变体谷子的生产潜力提供一定的理论参考依据。
1 材料和方法
1.1 试验材料
在大田种植晋谷21 号经EMS 矮化选育的突变体谷子,观察发现有些突变体谷子从苗期开始表现为叶色发黄,成熟时单独收获叶色黄化谷子,脱粒后的种子作为试验材料。
1.2 试验设计
试验在山西省太谷县山西农业大学试验基地(37.42°N,112.58°E)进行。在大田规划长3 m、宽10 m 的小区,面积为30 m2,每个小区播种22.5 g 种子,共4 个小区。每小区33 行,行距0.3 m,沟深约0.2 m,每3 小行均匀播种2.5 g 种子,覆土踩实。每个小区随机圈出2 个面积为1 m×1 m 的谷子试验小区,一个进行施氮作为高氮(N)处理组,均匀喷施500 mL 的氮肥(植物通用速效氮肥5 g 溶于500 mL蒸馏水配制),另一个喷洒蒸馏水作为对照组(CK)。
谷子进入抽穗期开始喷施处理,每15 d 喷施一次,喷施时间为晴天17:00—18:00。在谷子喷施处理后每隔7 d 选取完全展开的功能叶,进行叶片光合色素和糖类化合物测定,从谷子抽穗期开始至谷子灌浆期后期即谷子收获完成取材。
1.3 测定项目及方法
1.3.1 叶片光合作用测定 在每个小区处理组和对照组中分别选完全展开功能叶的谷子3 株,采用便携式光合气体分析系统(Li-6400)在晴天9:00—11:30 测定净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)。测定时叶室CO2浓度为400 μmol/mol,内置红蓝光源,光量子通量密度为1 400 μmol/(m2·s),叶室温度设定为25 ℃[11]。
1.3.2 叶片光合色素含量测定 于7:00 左右剪完全展开的功能叶片,冷藏保存。用丙酮∶乙醇∶蒸馏水为4.5∶4.5∶1(体积比)的混合液提取,再用分光光度计分别在波长645、663、652 nm 下测定吸光值,由Arnon 公式计算叶绿素含量[12]。
1.3.3 叶片糖类含量测定 取材同1.3.2,用蒽酮-硫酸法和3-5-二硝基水杨酸法测定糖类含量[13]。
1.3.4 农艺性状测定 当谷子完全成熟后,取处理组的全部完整植株,通风晾干后考种。用卷尺和游标卡尺测量谷子的株高、穗长和茎粗,用分析天平称量总生物量、穗质量、粒质量、茎叶质量。数出1 000 粒,称千粒质量。
1.3.5 籽粒营养成分测定 采用色差仪测定米色b*值,小米磨成粉后用水饱和正丁醇提取总类胡萝卜素,整个过程避光操作,提取液用分光光度计在波长450 nm 处测量。
其中,A 表示吸光值,V 表示加入的提取液体积(mL),m 表示样品质量(g),0.250 为转换系数[14]。
1.4 数据分析
数据整理、图表绘制是用Excel 2003 完成,显著性分析用SPSS 21 软件进行。
2 结果与分析
2.1 施氮对黄化谷子叶片光合作用的影响
从图1 可以看出,在灌浆期,与对照相比,施氮后黄化谷子的Pn 和Gs 分别显著增加19.61%和14.27%,Tr 和WUE 没有显著性变化。光合作用是绿色植物对环境变化最敏感的生理生化反应之一。试验结果表明,施氮后黄化谷子叶片对氮素的利用经过了一个适应期,净光合速率才得到显著提升。
2.2 施氮对黄化谷子叶片光合色素的影响
从表1 可以看出,在抽穗期,与对照相比,施氮后黄化谷子的叶绿素a、b 含量和总量分别显著降低15.48%、22.37%和18.21%,类胡萝卜素含量显著增加19.50%;在灌浆期,与对照相比,施氮后黄化谷子的叶绿素a、b 含量和总量分别极显著增加56.99%、30.73%和70.95%。光合色素是光合作用的生理基础[15],在谷子灌浆期,施氮后黄化谷子叶片中较高的叶绿素含量更有利于将太阳能转化为化学能,维持光合作用的高效运转。
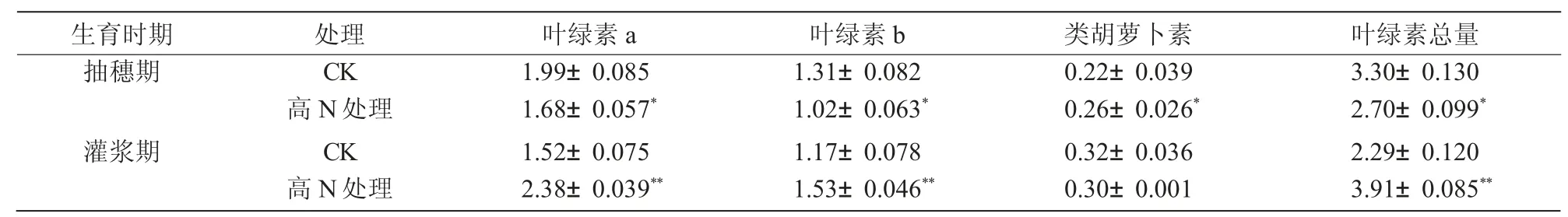
表1 施氮对黄化谷子叶片光合色素的影响 mg/g
2.3 施氮对黄化谷子叶片糖类化合物含量的影响
从表2 可以看出,在抽穗期,与对照相比,施氮后黄化谷子的还原糖和淀粉含量分别显著降低了19.34%和12.98%,纤维素含量极显著增加32.16%;在灌浆期,与对照相比,施氮后黄化谷子的可溶性总糖含量极显著降低了37.39%。糖类化合物含量与作物的植株形态有关,其含量主要取决于作物器官或组织对碳水化合物的储存或消耗能力[16-17]。结合表1 可知,在抽穗期,施氮后黄化谷子的糖类化合物较对照消耗高,说明施氮提高了黄化谷子器官或组织的代谢能力,纤维素的增加有利于提高叶片光合作用;在灌浆期,施氮后黄化谷子的糖类化合物的储存多,说明施氮提高了谷子的光能力。

表2 施氮对黄化谷子叶片糖类化合物含量的影响 %
2.4 施氮对黄化谷子形态结构的影响
与对照比,施氮后黄化谷子的茎粗显著增加12.86%(表3),其他指标均未达到显著差异。随着育种工作的不断发展,谷子每次品种更替都使其形态结构也发生了变化,株高和茎粗作为植物生长发育的动态积累过程,是影响作物倒伏的主要原因[18]。施氮后黄化谷子茎粗的增加提高了谷子的抗倒伏能力,更符合育种矮秆谷子的目的。

表3 施氮对黄化谷子形态指标的影响
2.5 施氮对黄化谷子生物量和产量的影响
由表4 可知,施氮后黄化谷子的千粒质量较对照显著增加13.89%,而其他指标均未达到显著差异。千粒质量是种子大小与饱满程度的一项指标,是检验种子质量的依据。施氮虽然没有增加黄化谷子的产量,但提高了黄化谷子的种子质量。

表4 施氮对黄化谷子生物量和产量的影响 g
2.6 施氮对黄化谷子籽粒品质的影响
施氮后黄化谷子籽粒中的类胡萝卜素含量较对照显著增加12.16%,米色未达到显著性差异(表5)。谷子脱壳后为小米,其小米颜色具有多样性,米色能直观反映小米品质的优劣,米色越黄,米饭的香味、色泽、适口性越好[19]。小米中黄色素主要成分为天然类胡萝卜素,类胡萝卜素除了与小米色泽等感官品质有关外,还具有多种生物活性功能[20]。所以,施氮后黄化谷子的品质得到改善。
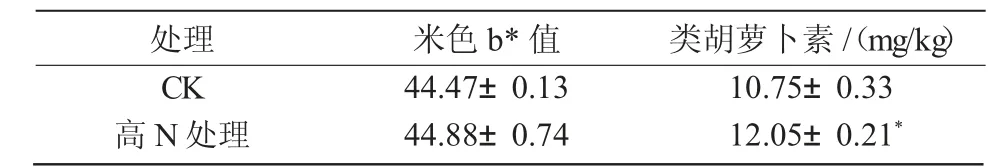
表5 施氮对黄化谷子籽粒品质的影响
3 结论与讨论
大多数研究表明,植株在缺氮条件下,含氮物质合成减少,影响细胞分裂和生长,从而导致植株生长矮小,合成叶绿素速率减小,叶片变淡,缺氮会导致根冠比增大,严重时抑制整株植株生长,干物质降低,所以,氮素是植物生长发育最重要的影响因素之一[21-22]。但也有研究表明,过量施氮则会影响作物对氮素吸收,降低作物千粒质量,进而导致产量下降,不同作物基因型对氮素养分的转运和吸收存在显著差异,也是造成作物产量和品质差异的重要因素[23-24]。
本试验通过对叶色黄化突变体谷子叶面进行合理施氮处理后,与对照相比,黄化谷子的叶绿素和糖类化合物含量增加,提高了谷子的生理代谢和光合能力,促进了黄化谷子的后期籽粒灌浆,优化了黄化谷子的小米品质。因此,本研究可为目前谷子育种工作中出现的叶色黄化谷子的生产潜力提供一定的理论参考依据。
