连翘花器官生长阶段内参基因筛选与评估
2020-03-26曹亚萍王勇飞贾孟君贺嘉欣张鑫瑞乔永刚
曹亚萍,王勇飞,贾孟君,贺嘉欣,张鑫瑞,李 政,乔永刚,宋 芸
(山西农业大学生命科学学院,山西太谷030801)
实时荧光定量PCR(Real-time quantitative PCR,RT-qPCR)具有特异性强、灵敏度高且重复性好的优点,是分析功能基因表达水平的常用方法之一[1]。基因表达分析中,可能会因为样品间RNA 存在差异而造成试验结果不准确,而利用内参基因可校准样品间误差[2],降低研究结果的不科学性。植物表达研究一般以管家基因作为内参基因[3],认为它们在生命活动中起重要作用且表达稳定,常常不经过验证就直接使用。但有研究表明,植物在不同试验环境、生长阶段以及组织部位的不同会导致内参基因存在差异[4]。如核桃不定根发生阶段以ACT2 为内参基因[5],而核桃不同组织间则以18S 基因为内参[6]。因此,植物在特定的环境与生长阶段需要筛选最适内参基因。常用评价内参基因表达稳定性的软件有GeNorm、NormFinder 等[7]。
连翘(Forsythia suspensa(Thunb.)Vahl)为连翘属多年生落叶灌木,主产于山西、河北、河南、陕西等地[8]。连翘果实入药,外可疏散风热、内可清热解毒,药用价值较高[9];植株抗旱性强,早春花开满枝且颜色亮丽,是优良的水土保持和观赏植物[10],经济价值高。目前,对连翘的研究主要集中在对其化学成分分离[11]、遗传多样性[12]及道地性[13]分析等方面。近年来,研究者开始关注异型花柱连翘(长花柱和短花柱)的差异性[14]。但关于异型花柱花器官发育的内参基因筛选尚未见报道。
本试验通过筛选长花柱和短花柱连翘花器官生长阶段稳定表达的内参基因,旨在为研究连翘花器官生长的基因表达提供理论基础。
1 材料和方法
1.1 试验材料
于连翘开花季节,在山西农业大学植物园(37°25′N,112°34′E)选择健壮无病害的长花柱和短花柱植株(均由山西农业大学赵晓明教授鉴定),分别于花现蕾期、露冠期、初花期、盛花期、末花期取材(图1),其中,长花柱植株依次命名为L1、L2、L3、L4、L5;短花柱植株依次命名为S1、S2、S3、S4、S5。
1.2 试验方法
1.2.1 总RNA 提取及cDNA 合成 利用华越洋植物RNA 试剂盒提取10 个样品的总RNA;采用1%琼脂糖凝胶电泳检测RNA 完整性;使用Nanodorp 2000c 测定RNA 浓度和纯度。反转录步骤按照全式金试剂盒方法[15]进行,模板RNA 浓度为100 ng/μL,产物cDNA 于-20 ℃存储,用于后续引物测试和RT-qPCR 分析。
1.2.2 候选基因筛选及引物设计 根据连翘转录组测序获得的核酸序列,选择11 个常用内参基因[16]作为候选:18S 核糖体RNA(18S ribosomal RNA,18S)、60S 核糖体RNA(60S ribosomal RNA,60S)、肌动蛋白7(Actin7,ACT7)、延伸因子1α 家族(Elongation factor 1-α,EF1α)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、组氨酸家族蛋白(Histone superfamily protein H3,HIS)、类脂质运转蛋白(Lipocalin-like,LIPL)、核糖体L27e 蛋白家族(Ribosomal L27e protein familay,RP)、核糖体蛋白L17(Ribosomal protein L17,RPL17)、微管蛋白(Tubulin beta chain,TUB)和泛素蛋白家族(Ubiquitin family,UBQ);另外,选取转录组数据中变化微小的7 个基因作为候选内参基因,分别命名为:FS-1、FS-2、FS-3、FS-4、FS-5、FS-6、FS-7;EF1αH 为已验证的连翘内参基因[17]。根据RT-qPCR 引物的设计原则,利用IDT PrimerQuest Tool 分别设计19 个候选内参基因的引物,具体信息列于表1。

表1 候选内参基因引物信息

续表1
1.2.3 候选内参基因引物特异性检验和RT-qPCR分析 利用普通PCR 检测候选基因引物特异性,以短花柱现蕾期cDNA 为模板。PCR 反应体系和反应程序列于表2。

表2 PCR 反应体系(10 μL)和反应程序
RT-qPCR 采用全式金定量试剂盒方法于美国Bio-Rad 公司CFX-96 荧光定量PCR 仪上进行,每个样品重复3 次。反应体系和反应程序列于表3。
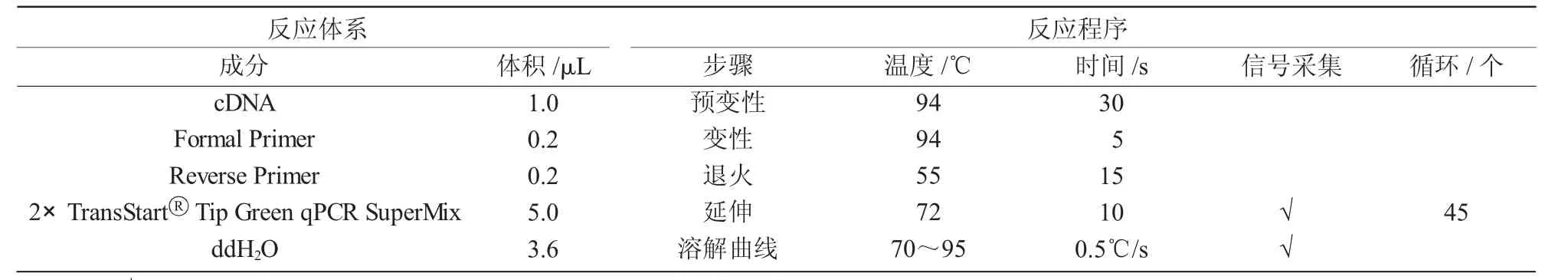
表3 RT-qPCR 反应体系(10 μL)和反应程序
1.3 数据分析
RT-qPCR 扩增结束后,得到连翘花器官生长阶段的Ct 值,计算相应的Q 值(2-ΔCt);使用GeNorm、NormFinder 软件分析19 个候选内参基因的稳定性[18],并利用Microsoft Excel 2016 计算已分析出的19 个候选内参基因稳定性排名的几何平均数[19];使用Origin 8.0 软件进行作图。
2 结果与分析
2.1 RNA 质量检测与内参引物特异性分析
琼脂糖凝胶电泳结果显示(图2-A),异型花柱连翘花器官生长阶段10 个样品的总RNA 均有28S 和18S 这2 条完整清晰的带,条带单一无拖尾,说明试验提取的RNA 完整性良好,无降解或仅有少量降解。每个内参基因的产物均为单一条带,特异性良好,产物片段在75~132 bp,与预测结果一致,说明设计的引物可用于进一步试验(图2-B)。
超微量核酸蛋白测量仪检测结果显示(表4),10 个供试样品的A260/A280值在2.0 左右,A260/A230值均大于2.0,说明提取的RNA 纯度较高,无蛋白质和无机盐污染,可用于后续的试验。
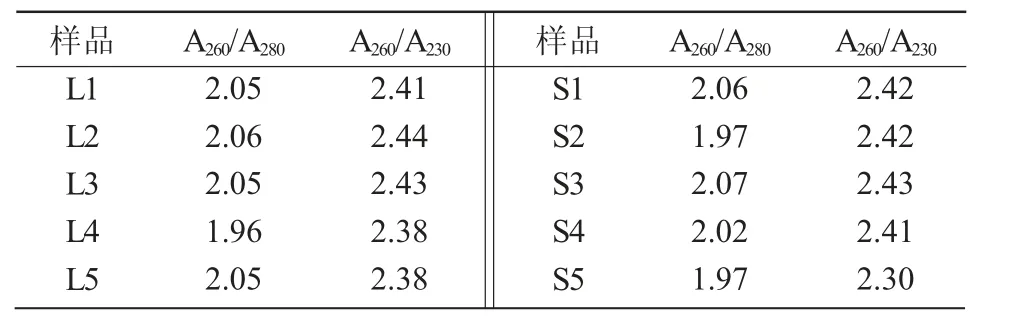
表4 总RNA 质量检测结果
2.2 连翘花器官生长阶段候选内参基因RTqPCR 分析
以长花柱和短花柱各5 个花器官生长阶段样品cDNA 为模板进行RT-qPCR 分析,结果显示,19 个候选内参基因溶解曲线均为单一信号峰,在达到退火温度之前均未出现杂峰,不存在引物二聚体。Ct 值是反映基因表达丰度的重要参数,Ct 值大小与基因表达量成反比。统计并分析19 个候选内参基因10 个样品中的Ct 值分布情况,结果显示(图3),19 个候选内参基因Ct 值在23~38,说明各候选内参基因表达量波动范围较大,其中,RP、RPL17、TUB、FS-1、FS-3、FS-6 变化相对较大;从Ct 值推测,60S 变化范围小,且表达量较高,适合作为内参基因,说明不同条件下内参基因Ct 值存在差异,因此,筛选内参基因尤为重要。
2.3 候选内参基因在连翘花器官生长阶段的表达稳定性分析
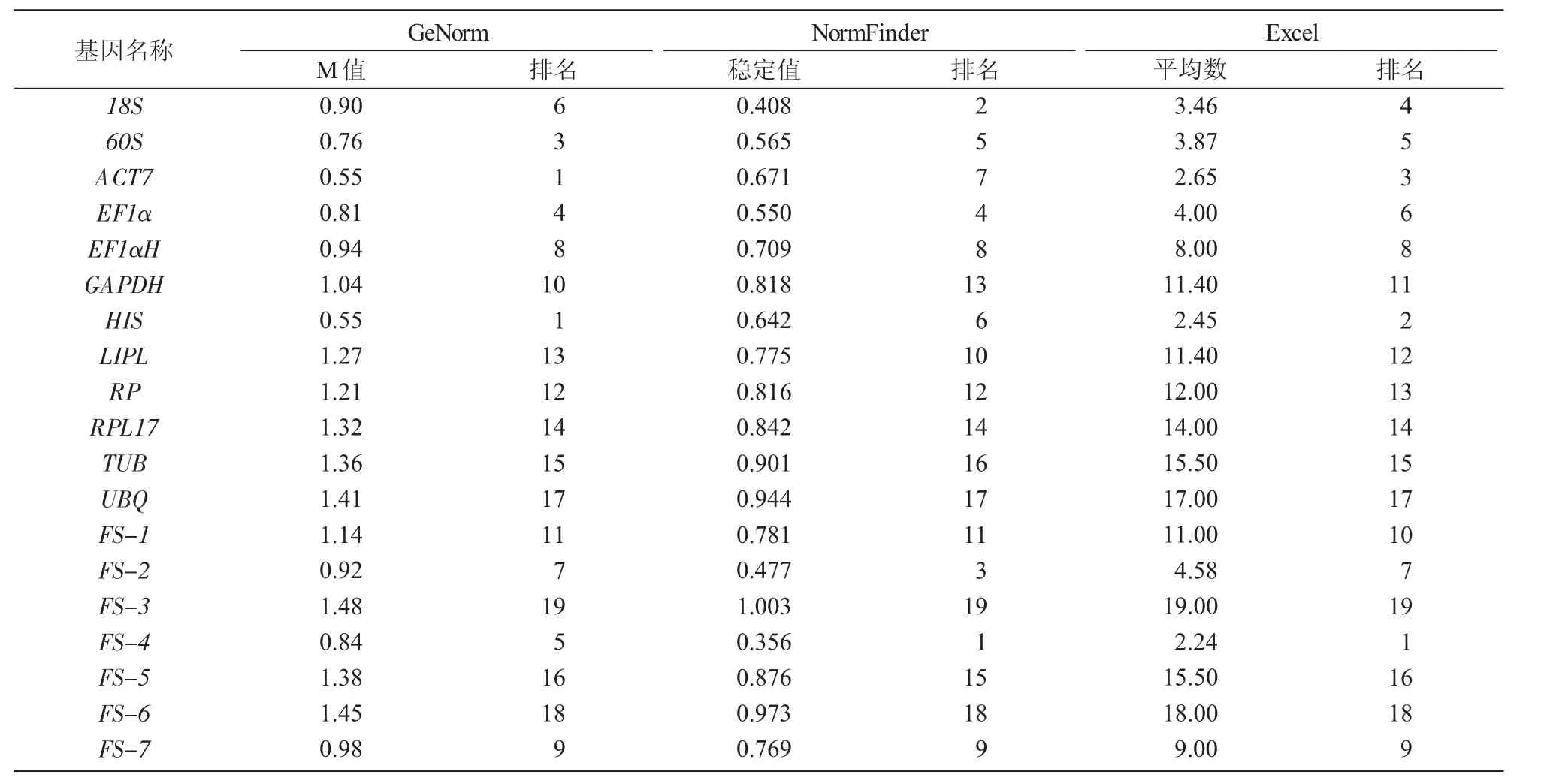
表5 19 个候选内参基因稳定性分析
GeNorm 软件通过计算基因的M 值(表达稳定值)评价基因表达的稳定性,基因的M 值越小基因表达越稳定。由表5 可知,19 个候选内参基因M值均小于阈值1.5,其从小到大依次为:ACT7=HIS<60S<EF1α<FS-4<18S<FS-2<EF1αH<FS-7<GAPDH<FS-1<RP<LIPL<RPL17<TUB<FS-5<UBQ<FS-6<FS-3,说明ACT7 和HIS 稳定性最好。配对变异值(Pairwise variation)可以确定标准化内参基因的使用个数,若Vn/n+1<0.15,则没必要引入第n+1 个基因。图4 结果显示,V2/3 小于0.15,说明不需要引入第3 个内参基因,可以选用ACT7 和HIS 组合作为连翘花发育期的内参基因。
NormFinder 软件利用稳定值(Stability value)衡量候选基因的表达稳定性,稳定值愈小说明表达愈稳定。由表5 可知,稳定值从小到大依次为FS-4<18S<FS-2<EF1α<60S<HIS<ACT7<EF1αH<FS-7<LIPL<FS-1<RP<GAPDH<RPL17<FS-5<TUB<UBQ<FS-6<FS-3,说明FS-4 为连翘花发育期表达最稳定的内参基因,18S 次之,FS-3 的稳定性最差。
GeNorm 和NormFinder 软件的分析结果存在差异,为筛选更可靠的内参基因,使用Excel 计算二者排名的几何平均数,结果表明(表5),几何平均数从小到大依次为FS-4<HIS<ACT7<18S<60S<EF1α<FS-2 <EF1αH <FS-7 <FS-1 <GAPDH <LIPL <RP <RPL17<TUB<FS-5<UBQ<FS-6<FS-3,即FS-4 稳定性最好,HIS 次之,二者可共同作为连翘花发育期的内参基因。
3 结论与讨论
内参基因筛选是差异基因表达分析的基础环节,理想的内参基因在不同条件下表达量基本不变。但有研究表明,内参基因在不同条件下表达并非绝对稳定[20]。本试验中,UBQ、GAPDH 基因的稳定性较差,但菠萝蜜[21]花序的内参基因筛选UBQ、GAPDH 基因稳定性高,因此,选择合适的内参基因至关重要。GAPDH 和ACT 是植物最常用的内参基因[22],其已在许多物种中被证实;但内参基因也可能是其他基因,如灰毡毛忍冬花蕾期以18S 作为内参基因[23];羽衣甘蓝柱头发育期筛选出TUB+ACT为内参基因[24];OfRAN1+OfIDH 是桂花在不同光周期和温度处理下最佳内参基因组合[25];柑橘低温胁迫下选取UBQ10、ACT 和18S 为内参基因[26]。本研究筛选出的内参基因为FS-4 和HIS,其中,FS-4 为连翘花器官生长阶段特有的内参基因,与其他物种不同。
筛选内参基因常常以GeNorm、NormFinder 和BestKeeper 软件分析基因表达稳定性,这3 个软件的核心计算方法不同,结果存在差异[2]。本研究采用GeNorm 和NormFinder 软件分析的内参基因稳定性不同,结合Excel 综合评价内参基因的稳定性,与马璐琳等[19]对西南鸢尾花内参基因评价方法一致,具有一定的可靠性。内参基因筛选需根据要求选择不同软件进行分析,如甜瓜生长发育[27]以GeNorm、NormFinder 和BestKeeper 软件共同评测内参基因。本研究未利用BestKeeper 软件进行分析,是由于BestKeeper 软件只能对10 个以内基因进行评测,而本试验选取了连翘花器官生长阶段19 个候选内参,不适用于此软件。崔菲菲等[4]在大白菜营养生殖阶段对21 个内参基因进行筛选,分析软件与本研究一致。
本研究以异型花柱连翘不同生长阶段的花器官为材料,选取19 个候选内参基因,并利用RT-qPCR 技术结合GeNorm、NormFinder、Excel 软件,最终将FS-4 和HIS 作为连翘花器官生长阶段的内参基因,为研究连翘花器官生长阶段的基因表达提供了理论基础。
