生菜种子低温处理后耐冻性和脂肪酸合成代谢的关系研究
2020-03-25周婧雯丁玉娇曾晓蓉GaneshJaganathan刘宝林韩颖颖
周婧雯,丁玉娇,曾晓蓉,Ganesh K. Jaganathan,刘宝林,韩颖颖
(上海理工大学医疗器械与食品学院/生物系统热科学研究所,上海 200093)
贮存种子的质量受其所含水分的影响。当种子含水量增加时,其寿命会按一定比例缩短[1]。对于正常性种子来说,可通过降低种子含水量,降低贮藏温度,以降低种子劣化程度,保持种子活力,延长种子寿命[2]。但顽拗性种子通常在高含水量的情况下成熟并脱落,因其不耐脱水的特性而不易储存,寿命较短[3]。
生菜(Lactuca sativa)种子属于正常性种子,在成熟后可将其干燥至较低含水量,进行低温保存。含水生菜种子是种子含水量和低温贮存问题研究的模式种子[4]。研究表明,生菜种子有两种耐冷机制,这取决于冷却速率。在快速冷却条件下,种子外部组织处于冷冻状态,胚处于过冷状态[5]。在慢速冷冻条件下,外部先结冰,胚逐渐脱水,降低了冰晶形成对胚造成的机械损伤[6]。这两种机制都依赖于种子结构的完整性[7]。
研究发现,在低温冷冻条件下,细胞受到刺激产生信号因子,从而调控抗性基因转录表达,进而影响有关蛋白质合成,提高细胞中包括SOD[8]、脯氨酸、不饱和脂肪酸等物质的合成,从而提高种子抗冻性[9—10]。在植物的抗逆反应中,不饱和脂肪酸及其反应产物具有重要的调节作用。脂肪酸与植物膜的流动性相关[11],低温胁迫时,抗寒植物合成大量不饱和脂肪酸,降低膜相变温度,从而提高抗寒性[12]。含水生菜种子在快速降温和慢速降温条件下脂肪酸代谢通路功能发生变化。其中,参与将十六碳脂肪酸从酰基载体蛋白水解的蛋白质棕榈酰基硫酯酶基因(PPT)和长链脂肪酸延伸酶(ELOVL)的表达在程序降温和低温冷冻条件下表达量发生变化[13]。程序降温冷冻条件下含水生菜种子不饱和脂肪酸的合成及其含量是否发生变化未见报道,含水量差异是否影响低温处理后种子的脂肪酸合成尚不清楚。
本研究主要通过分析不同吸水时间后种子的含水量,不同含水量种子程序降温后的发芽率,脂肪酸合成基因包括与不饱和脂肪酸合成相关的基因(FAD2、FAD3)、蛋白质棕榈酰基硫酯酶基因(PPT)和长链脂肪酸延伸酶基因(ELOVL)的mRNA 水平差异,以及相关抗冻基因(ICE1)的mRNA 水平差异,初步推断种子含水量和种子耐冻性的关系以及两者对上述生物分子水平的影响。
1 材料与方法
1.1 材料
材料为‘罗莎绿’生菜(L. sativa‘Rosa Green’)种子,购自北京凤鸣雅世公司。
试剂:琼脂粉、正己烷、三氯甲烷、琼脂糖、异丙醇、EB 染料、乙醇、RNAisoplus、DEPC 水均来自国药集团化学试剂有限公司。
仪器:GZX-250B 光照培养箱(中国通利信达);QuantStudio3 实时荧光定量PCR 系统(美国);ABI 9700 PCR 仪(美国)。
1.2 方法
1.2.1 不同吸水时间种子含水量测定
在21 ℃、光照度为30 μmol·m-2·s-1的光照培养箱中,种子置于1%琼脂培养基培养2 h、4 h、6 h、8 h、10 h、11 h。取材后,立即在105 ℃烘箱中干燥17 h。
1.2.2 不同含水量种子程序降温后发芽率测定
放入程序降温盒中降温,降至不同温度(-5 ℃、-15 ℃、-20 ℃、-22 ℃、-25 ℃、-30 ℃、-35 ℃)时播种三个平行,一个平行25 粒种子;在1.2.1 光照培养箱中培养,连续3 d 观察计算发芽率[14]。

1.2.3 RNA 提取及逆转录
根据Trizol 法提取处理后生菜种子总RNA。选用PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒(TaRaKa,大连)运用2 步法进行cDNA 合成,完成反转录。
1.2.4 实时荧光定量PCR 反应
在NCBI 基因库中查找ICE1、FAD2、FAD3、PPT、ELOVL基因序列,利用Beacondesigner 软件进行引物设计,引物序列见表1,引物合成委托生工生物工程(上海)有限公司完成。建立PCR 反应体系后,以生菜的管家基因ACTIN为内参进行Real-time PCR。用Excel 2003 及SPSS19.0 软件进行数据分析。

表1 引物序列Table 1 Primer sequence
2 结果与分析
2.1 不同吸水时间的种子含水量变化
生菜种子随着吸水时间的延长,含水量的变化趋势大致表现为“快-慢-快”三阶段特点(图1)。种子刚开始吸水时,由于种子含水量极低,故吸水速率较大。在培养6 h 至8 h,种子含水程度趋于饱和,含水量变化不显著(P>0.05)。第三阶段种子又进入了吸水较快的阶段。在上一阶段的吸水过程中,种子内各种成分开始活跃。细胞中某些供能营养物质也开始分解以提高细胞呼吸等生命活动所需要的养料。因此在经历吸水缓慢期后,细胞的吸水在此阶段又加强。

图1 不同吸水时间种子含水量变化趋势Fig. 1 Change trend of seed water content with different treatment time
2.2 不同含水量种子程序降温后发芽率变化
吸水后的生菜种子,降温速率大致是1 ℃·min-1,拟合公式为y= -0.9694x-0.4455 (图2: A)。将种子吸水11 h 后进行程序降温(含水量约为47%),随着温度的降低,其发芽率呈递减趋势(图2: B)。
为了验证相同条件下其他含水量种子发芽率情况,取吸水6 h 的种子(含水量约为43%)测定程序降温后发芽率。由图2: C 可见,随着温度的降低,种子的发芽率大体表现为下降趋势,与吸水11 h 种子的低温敏感性一致,在-20 ℃~-30 ℃的下降幅度更大。结合吸水11 h 的种子发芽率下降趋势,确定了进行不同含水量种子程序降温的半致死温度为-22 ℃。
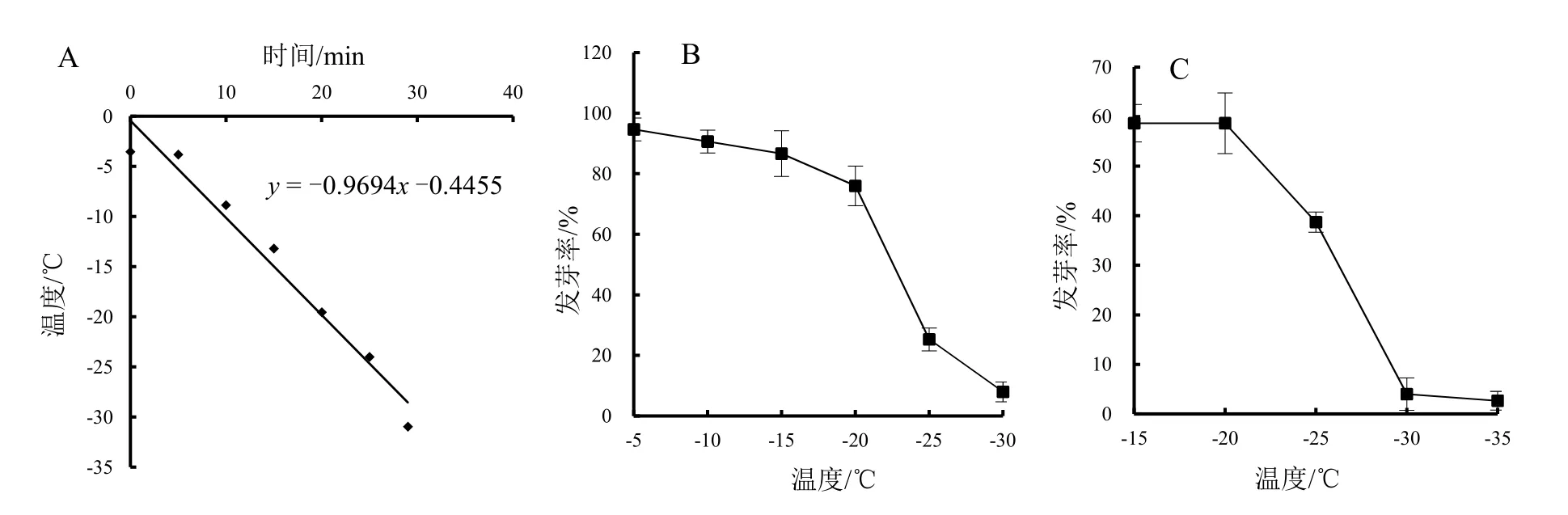
图2 程序降温速率变化(A)和种子吸水11 h(B)、6 h(C)程序降温后发芽率Fig. 2 Program cooling rate change (A) and germination rate of 11 h(B), 6 h(C) imbibed seeds after cooling
对不同吸水时间的种子分别程序降温到-20 ℃和-22 ℃(图3),其发芽率随着吸水时间的增加波动较为明显,但大体的趋势较为一致。说明种子在吸胀过程中,并非随着含水量的增加而耐冻性降低。

图3 程序降温至-20 ℃、-22 ℃的种子发芽率Fig. 3 Germination rate of different water content seed program to cool down to -20 ℃ and -22 ℃
2.3 脂肪酸合成及低温耐冻相关基因表达变化
2.3.1 基因PPT、ELOVL的相对表达量
脂肪酸合成中的一个步骤是由棕榈酰蛋白硫酯酶1 (PPT1)将棕榈酸从载脂蛋白切下来以便进入线粒体进行长链脂肪酸的合成。如图4 所示,在低温冷冻情况下,随着种子内水分含量增加,种子所受低温伤害增加,PPT基因表达增加,调节棕榈酰基酯酶的合成,释放更多的棕榈酸,为长链不饱和脂肪酸的积累做准备。
高度不饱和脂肪酸(HUFA)的合成是通过一系列延长酶及去饱和酶催化反应来完成的,其中ELOVL 为脂肪酸延长酶, 可以将短链脂肪酸转换为长链脂肪酸。由图4 可见,ELOVL基因的表达随着种子吸水时间的增加总体呈上升趋势。种子在低温冷冻环境下,为了提高种子的耐寒性,通过ELOVL基因的表达量增加来调节高度长链脂肪酸的增加,从而提高其抗冷性。
2.3.2 基因FAD2、FAD3的相对表达量
FAD2基因的表达对于亚油酸的合成有重要作用。由图4 可看出,在同样的低温冷冻胁迫下,随着吸水时间的增加,FAD2基因的表达呈上升趋势。说明在低温环境下,种子含水量越高,所受到的冷害威胁越大,种子具有一定的自我抗冷反应,会产生更多不饱和脂肪酸来增加膜的耐冻性。FAD2基因的表达增加,可为油酸向亚油酸转变做准备。种子吸水10 h,FAD2基因表达量较高,可能此时种子将要萌发,其内部代谢较快,在低温条件下诱导细胞合成更多的不饱和脂肪酸等物质。
FAD3是ω-3 脂肪酸脱氢酶的编码基因,该酶影响膜脂不饱和脂肪酸的含量。对低温冷冻条件下(程序降温至-20 ℃) 的FAD3表达进行检测,结果表明,随着种子吸水时间的增加,FAD3表达呈增加趋势,说明当种子处于低温环境时,含水量越高,其受到的冷冻伤害越高,不饱和脂肪酸α-亚麻酸(ALA)合成也增高,进而提高植物的冷冻耐受性(图4)。
2.3.3 低温耐冻基因ICE1的相对表达量
如图4 所示,低温冷冻处理不同吸水时间的种子,其ICE1基因的表达趋势与低温伤害程度一致。低温伤害越严重,ICE1的表达量越高,从而激活CBF基因的转录,保护植物减轻低温损伤。
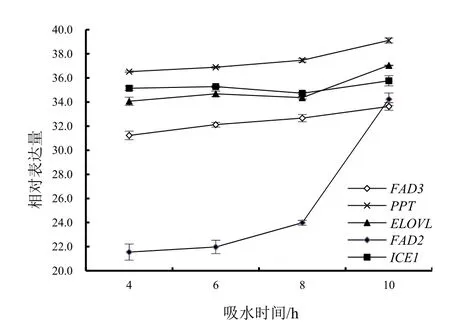
图4 不同吸水时间处理的种子PPT、ELOVL、FAD2、FAD3 和ICE1 基因相对表达量Fig. 4 Relative expression of PPT, ELOVL, FAD2, FAD3,ICE1 in seeds imbibed with different time
3 讨论
通过程序降温对生菜种子耐冻性进行研究,发现种子发芽率的半致死温度在-22 ℃左右,当温度降至-25 ℃时,无论吸水时间长或是短,发芽率都很低,说明在-25 ℃以下大多数种子已被冻死。因此,在进行含水种子低温贮藏时,贮藏温度最好不低于-22 ℃。
植物在低温情况下会表现出一定的抗寒性,这主要是由其中的抗冷基因来调控的,当受到低温胁迫时,此类基因表达量会增加[15]。例如,ICE1基因遇到冷信号时,激活CBF基因的转录,从而起到抗寒、保护膜和保护细胞活性等作用[16]。因此,过量表达ICE1基因对于植物的抗冷性有较大影响。本研究中,含水量高的种子受到冷冻伤害时,ICE1的表达水平显著提高,进一步提供了含水量对种子低温伤害的分子水平证据。
不饱和脂肪酸含量也是影响植物耐冻性的关键因素之一[17]。前期研究表明,低温冷冻处理过程中,种子脂肪酸合成通路功能富集[13]。不饱和脂肪酸是提高植物抗冻性的重要化合物。最简单的不饱和脂肪酸包括亚麻酸和亚油酸。亚油酸由FAD2催化,含有两个双键;α-亚麻酸是一种ω-3 不饱和脂肪酸,含有三个双键,由亚油酸经FAD3催化合成。同时FAD3还参与其他多种植物ω-3 脂肪酸脱氢[18]。本研究测定了与脂肪酸去饱和有关的FAD2和FAD3基因、长链脂肪酸延伸酶相关基因ELOVL、蛋白质棕榈酰基硫脂酶基因PPT、抗冷基因ICE1的表达量。结果显示,随着种子含水量的增加,这些基因的表达都增加,说明种子含水量越高在低温下受到的冷胁迫就越大,从而调节产生更多的抗冷因子和不饱和脂肪酸抵御冷冻胁迫,降低伤害。种子吸水时间为4~8 h 的基因表达增加幅度均不大;而在吸水10 h 的情况下,各基因的表达增加幅度都较大,这可能是由于吸水8 h 后,种子内部处于即将萌发的状态,各组织细胞在临近发芽期时生命力较为脆弱,需要调节产生更多的不饱和脂肪酸降低膜的伤害,增加其抗冷性。
低温冷冻过程中,种子的自由水形成冰晶伤害种子胚。种子含水量越高形成的冰晶越大,种子胚受低温伤害也越大。一些细胞内分子物质能减小冷冻过程中冰晶体积,如蔗糖[19]、脯氨酸[20]以及一些蛋白质[21],从而降低水对种胚的伤害。今后的研究可以针对以上分子物质的合成代谢通路进行探索,检验其分子水平以及对含水种子冰晶形成的影响,为种子含水量和耐冻性之间的关系提供更多思路。
