山荔枝酒精饮料发酵工艺优化及抗氧化活性研究
2020-03-25高丰衣刘启辉李敏波蔡圣宝易俊洁
高丰衣,刘启辉,李敏波,蔡圣宝,易俊洁*
(1.商丘师范学院生物与食品学院,河南商丘 476000;2.昆明理工大学农业与食品学院,云南昆明 650500)
山荔枝(Dendrobenthamia japonica var.chinensis)也叫野荔枝,主要分布于中国的云南、四川、西藏等省份,以及印度、巴基斯坦、尼泊尔等地区[1]。山荔枝具有很高的药用价值,有通经、暖胃、活血等功效[2],研究表明山荔枝营养成分丰富,含有19 种游离氨基酸,20 种水解氨基酸,VC 含量为24.5 mg/100 g,蛋白质占0.49%,总糖占6.25%[3]。另有文献报道,山荔枝中含有三萜、双环烯醚萜苷、环烯醚萜苷、多酚类、有机酸类、甾醇、单萜苷、黄酮类、多糖类等多种功能性成分[4-7]。多酚类物质是荔枝植物含量丰富的活性成分之一[8-9],其总酚含量约为101.51~259.18 mg GAE/100 g[10]。李春阳等[11]研究表明,原花青素等酚类物质,具有显著的抗氧化,清除超氧阴离子自由基、羟基自由基,减少脂质过氧化自由基等作用。自由基是导致细胞和组织损伤、致病的重要原子或基团,也是参与机体氧化的重要物质[12-13]。蒋本庆等[14]研究发现水果经过发酵获得的果酒含有更丰富的抗氧化物质,适量饮用可促进血液循环和机体新陈代谢,对清除体内自由基具有积极的作用。
目前,市场上以山荔枝为主要原料的产品较少,尤其是经过发酵的功能性酒精饮料则更少,因此开发高营养价值、高品质的山荔枝发酵酒精饮料具有重要的意义。但在实际生产过程中,酒精饮料常存在稳定性差、澄清度低、易浑浊等问题,严重影响了饮料的品质和饮料的产业发展。基于此,本试验以山荔枝为主要原料进行发酵,通过正交试验获得最佳发酵工艺,并对比分析了四种澄清剂对山荔枝酒精饮料的澄清效果,最后对澄清工艺优化后的山荔枝酒精饮料的多酚组成和抗氧化活性进行了评价。
1 材料与方法
1.1 材料与试剂
山荔枝购于云南省西双版纳地区,冷冻备用;酿酒酵母2323,购于中国工业微生物菌种保藏管理中心;甲醇(色谱级)、乙腈(色谱级)、福林酚(分析纯),均购于Merck 公司;蔗糖、氢氧化钠、盐酸、3,5-二硝基水杨酸、葡萄糖、酒石酸钾钠、结晶酚、无水亚硫酸钠均为分析纯,购于阿拉丁试剂(上海)有限公司。
1.2 仪器与设备
Spectra Max M5 型多功能酶标仪,美国Molecular Devices;BSA124S-CW 型电子精密天平,赛多利斯科学仪器(北京)有限公司;Dionex U3000 超高效液相色谱,赛默飞世尔科技(美国)有限公司;Q-Exactive 高分辨轨道离子阱质谱,赛默飞世尔科技(德国)有限公司;JN-5200DTS 型超声,宁波市科技园区新江南仪器有限公司;真空泵,德国Vacuubrand;HH-4 数显恒温水浴锅,金坛市科析仪器有限公司;BSA124S-CW 型电子精密天平,赛多利斯科学仪器(北京)有限公司;BSC-250 型恒温恒湿培养箱,上海博讯实业有限公司医疗设备厂;UPHW-I-90T 型优普超纯水制造系统,成都超纯科技有限公司。
1.3 试验方法
1.3.1 山荔枝酒精饮料发酵工艺
冷冻山荔枝→解冻→榨汁→调整成分(糖度)→接种活化酵母→发酵→过滤→澄清→陈酿→贮存
1.3.2 操作要点
(1)榨汁
选择完整、成熟的冷冻山荔枝,解冻后进行榨汁。
(2)活化酵母
准备100 mL、0.05 g/mL 的蔗糖溶液,置于38 ℃水浴中,待温度恒定,加入10 g 酿酒酵母,恒温活化30 min,活化过程中会有气泡产生,每隔10 min 用玻璃棒搅拌一次,至不产生气泡为止。
(3)接种活化酵母
将酵母活化液的温度降至发酵温度,将山荔枝汁加热至发酵温度,按照试验要求的量添加酵母活化液。
1.3.3 酿造工艺条件的确定
(1)发酵温度对山荔枝酒精饮料品质的影响
将发酵液糖度调整到180 g/L,向其中添加0.6%的酵母活化液,分别在18、21、24、27 ℃下进行发酵,以感官评定获得的综合评分为指标,结合酒精度和还原糖浓度,确定最适发酵温度。
(2)蔗糖添加量对山荔枝酒精饮料品质的影响
分别将发酵液的初始糖度调整到150、180、210、240 g/L,向其中添加0.6%的酵母活化液,在24 ℃下进行发酵,以综合评分为指标,结合酒精度和还原糖浓度确定最适蔗糖添加量。
(3)酵母添加量对山荔枝酒精饮料品质的影响
将发酵液的初始糖度调整到180 g/L,分别向发酵液中添加质量分数为0.4%、0.6%、0.8%、1.0%的酵母活化液,在24 ℃条件下进行发酵,以综合评分为指标,结合酒精度和还原糖浓度确定最适酵母添加量。
(4)正交试验设计
在单因素试验的基础上进行L9(34)正交试验。以综合评分为主要指标确定最佳发酵工艺,正交试验设计的因素水平表如表1 所示。
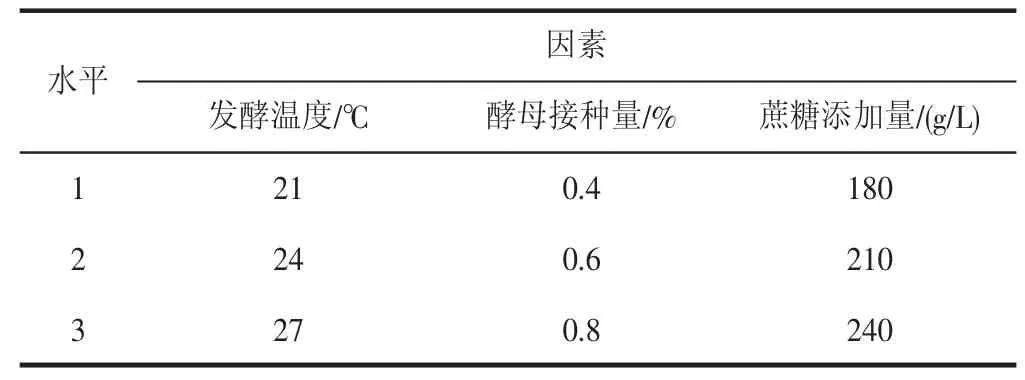
表1 影响发酵工艺的因素水平表Table 1 Impact factors and level of fermentation process
1.3.4 澄清工艺优化
选用4 种澄清剂:果胶酶、硅藻土、壳聚糖、明胶。
澄清方法如下:取10 mL 试管5 只,加入5 mL 自制山荔枝酒精饮料,再加入澄清剂0、0.2%、0.4%、0.6%、0.8%、1.0%,充分混匀并静置24 h,记录现象,取其上清液在960 nm 处测其吸光值,并重复3 次。
1.3.5 理化指标的测定
(1)固形物含量
采用台式阿贝折光仪进行测定。
(2)酒精度
采用GB/T 15038 2006 葡萄酒、饮料分析通用方法中的酒精计法进行测定[15]。
(3)还原糖含量
发酵液体中还原糖的测定参考王鹏等[16]、黄进[17]的方法,略作修改。发酵液过滤,取1 mL 滤液定容至50 mL。然后取1 mL 于25 mL 的比色管中,加入DNS 试剂1.5 mL,沸水浴中加热5 min,冷却后定容至10 mL,摇匀,540 nm 处测吸光度。
1.3.6 感官评价
发酵结束后,由5 名经过训练的感官品评员对酒体的色泽、香气、状态等进行感官评价,总分100 分。感官评分标准见表2。

表2 感官评分表Table 2 Sensory assessment criteria
1.3.7 多酚含量测定
样品前处理:从自制山荔枝酒精饮料样液中取3 mL样品,在离心机中以10 000 r/min 离心10 min,取上清液,经0.22 μL 微孔滤膜过滤备用。
色谱柱:Thermo Fisher C18(100 mm×2.1 mm,3 μm)。色谱条件:流动相A-0.1%甲酸水,B-乙腈。梯度洗脱程序如下:0~5 min,5%B;5~10 min,20%B;10~12 min,22%B;12~15 min,25%B;15~20 min,5%B。进样量:2 μL,流速:0.2 mL/min,柱温:35 ℃。
质谱条件:电离模式采用SEI 负离子检测模式,碰撞气体为高纯度氦气(He),雾化气体为高纯度氮气(N2),鞘气流速:30 L/min;辅助气流速:8 L/min;离子源温度:350 ℃;毛细管温度:320 ℃;喷雾电压:3.2 kV;质量扫描范围m/z:120~1 000。
1.3.8 DPPH·自由基清除能力测定
精确称取DPPH·粉末0.039 4 g,用甲醇溶解,并定容至100 mL,配制成1 mmol/L DPPH·母液。测定时,用甲醇稀释10 倍,配制成0.1 mmol/L DPPH·反应液。取0.5 mL 稀释为一定浓度梯度的样品溶液于离心管中,加入2.0 mL、0.1 mmol/L DPPH·反应液混合均匀。将混合反应液置于暗处并不断振荡30 min,于517 nm 下测定其吸光值。空白对照组用水代替样品溶液,样品的DPPH·自由基清除能力按式(1)进行计算。
式中,A0为对照组吸光值,Ax0为样品对照组吸光值,Ax为样品吸光值。
1.4 数据统计分析
所有试验操作均重复测定3 次,结果表示为“平均值±标准偏差”,所有结果均利用单因素方差分析(oneway ANOVA)进行显著性分析,采用Tukey 检测,统计学分析和作图均在Origin 8.5 软件中完成。
2 结果与分析
2.1 单因素试验
2.1.1 发酵温度对山荔枝酒精饮料品质的影响
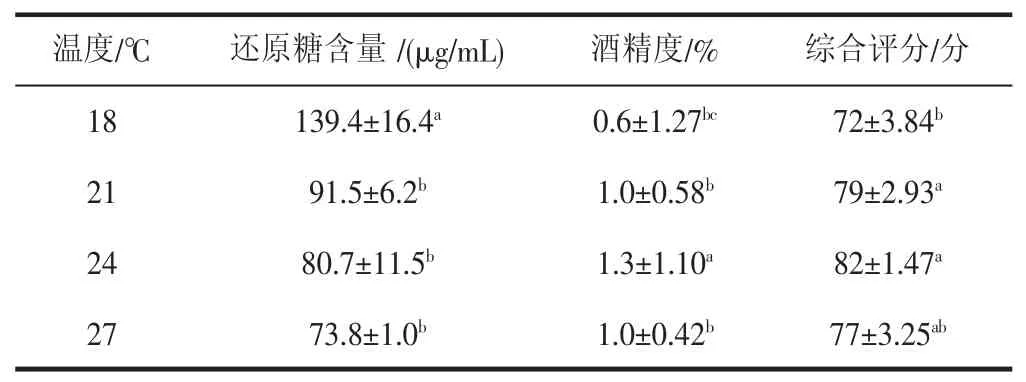
表3 发酵温度对山荔枝酒精饮料品质的影响Table 3 Effect of fermentation temperature on quality of litchi alcohol beverage
发酵温度的控制对于发酵过程尤为重要。温度对于酵母细胞的酒精发酵及苹果酸分解有很大影响。温度过高时会使酵母代谢过于旺盛[18],增殖速度变快,使细胞逐渐出现衰老,造成提前老化,发酵停止较早,最终生产的酒精浓度较低,妨碍荔枝酒精饮料色、香、风味的形成,还易造成杂菌滋生,不利于发酵的顺利进行;温度较低时,发酵速度慢,但不易衰老,发酵持续时间长,发酵彻底,最终生产的酒精浓度高。由表3 可知,随着发酵温度的升高,山荔枝酒精饮料的糖度下降,而酒精度呈上升趋势,当发酵温度为18 ℃时,其还原糖含量较高。这可能是由于温度较低不利于酵母繁殖和代谢,没有足够的微生物来进行发酵,导致其酒精度低,山荔枝酒精饮料缺少酒香气,从而影响其综合评分。当发酵温度为27 ℃时,其还原糖含量最低,但酒精度并非最高,这可能是由于温度较高,发酵速度快,细胞易衰老,发酵不彻底,最终产生的酒精浓度较低。根据综合评分,最适发酵温度选择24 ℃。
2.1.2 蔗糖添加量对山荔枝酒精饮料品质的影响
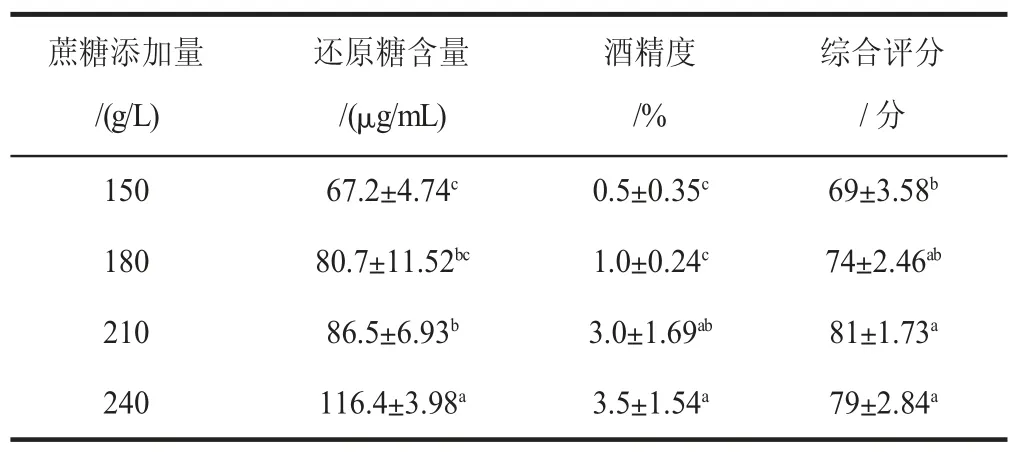
表4 蔗糖添加量对山荔枝酒精饮料品质的影响Table 4 Effect of sucrose content on the quality of litchi alcohol beverage
表4 显示了蔗糖添加量对山荔枝酒精饮料品质的影响。由表可知,随着蔗糖添加量的提高,山荔枝酒精饮料的酒精度以及还原糖含量也随之上升。在初始糖度为150 g/L 时,其酒精度太低,酒香气寡淡[19],综合评分最低。初始糖度为210 g/L 时,发酵比较平稳,还原糖含量在80 μg/mL 附近波动,综合评分最高。初始糖浓度为240 g/L 时,其酒精度最高,但可能由于口感过甜,酒香气太过浓郁,评分并没有达到最高。根据综合评分,最适的蔗糖添加量为210 g/L。
2.1.3 酵母添加量对山荔枝酒精饮料品质的影响
由表5 可知,酵母添加量对发酵有一定影响,酵母添加量的高低直接影响山荔枝酒精饮料的色、香和风味。当酵母添加量为0.4%时,接种量过低,发酵缓慢且不彻底,导致还原糖浓度和酒精含量较低。当酵母添加量为0.6%时,山荔枝酒精饮料发酵适当,酒精度最高。当酵母添加量为1%时,还原糖含量高但酒精度增幅较小,这可能是由于酵母增殖速度过快,细胞过早老化,没有代谢完全。在整个发酵过程中,酿酒酵母增殖与还原糖含量和酒精度增加呈一定的比例关系的[20]。接种量过高时,发酵速度过快,不利于风味形成,且山荔枝原酒的酵母味较重,给后续的澄清及调配工艺造成不良影响;接种量过低时,发酵缓慢,发酵时间延长,易于杂菌的生长,也会影响山荔枝酒精饮料的风味。根据综合评分并结合酒精度和还原糖含量选出酵母最优添加量为0.6%。
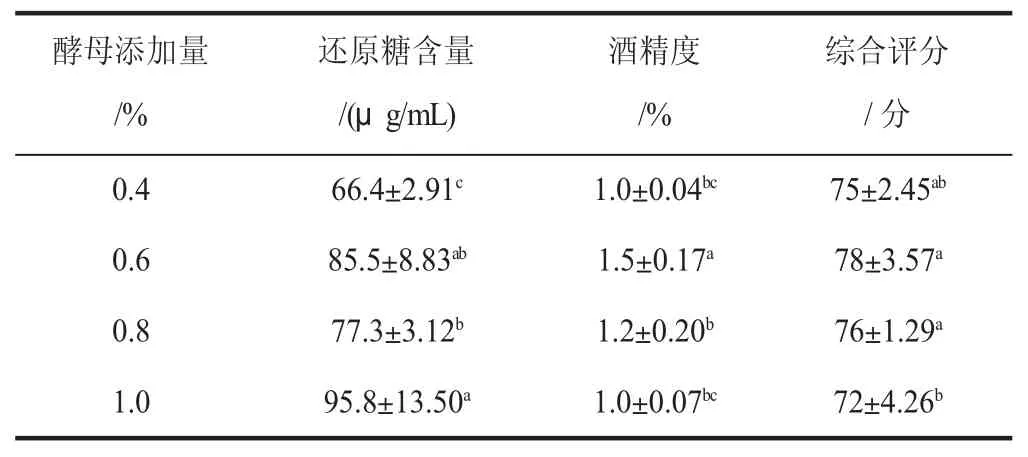
表5 酵母添加量对山荔枝酒精饮料品质的影响Table 5 Effect of yeast addition on quality of litchi alcoholic beverage
2.2 正交试验
在单因素试验的基础上,以发酵温度、初始糖度、酵母接种量为试验因素,以综合评分为主要指标,进行L9(34)正交试验,结果见表6。
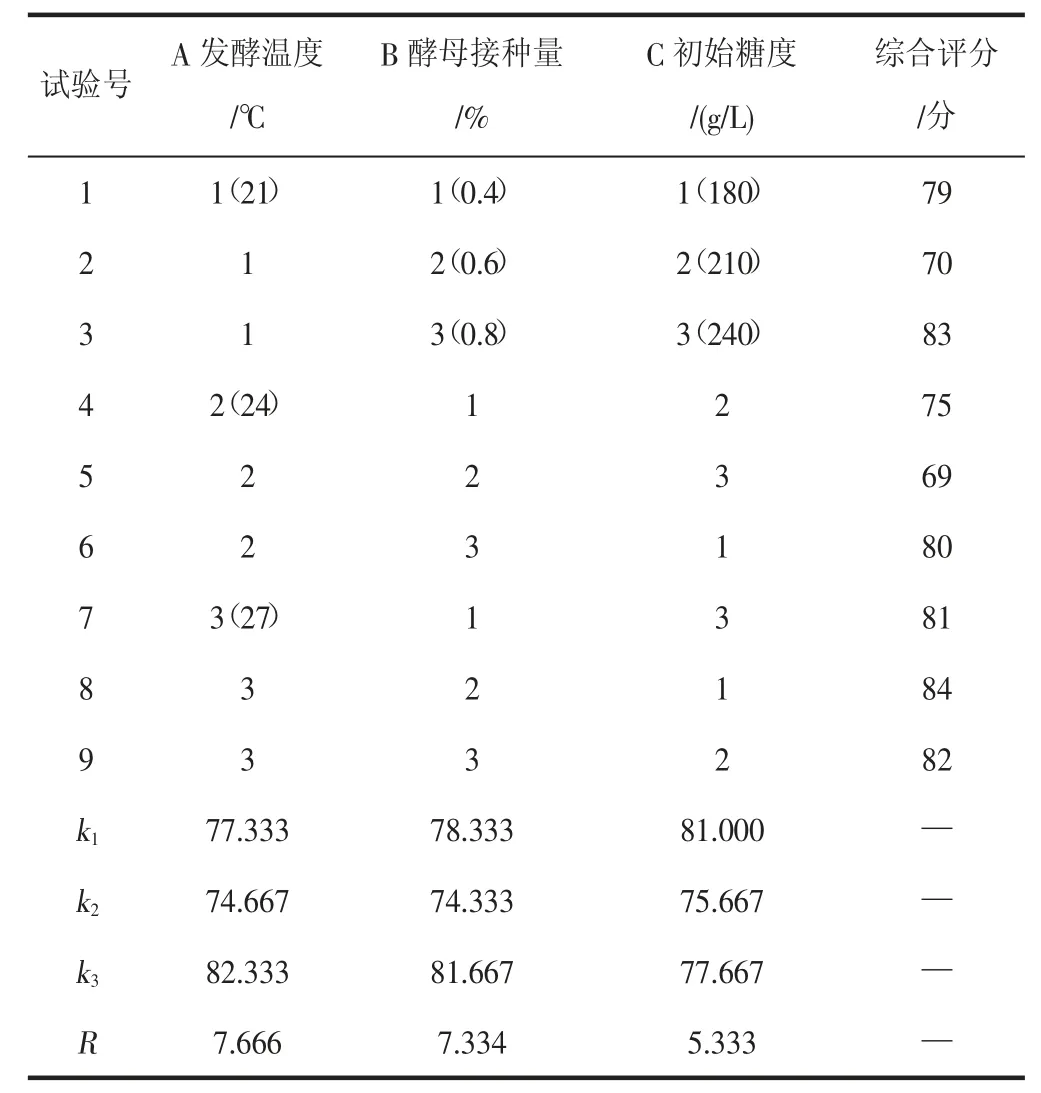
表6 发酵工艺的正交试验结果Table 6 Orthogonal test results of fermentation process
由表6 可知,对山荔枝酒精饮料的品质影响主次顺序为A>B>C,即影响最大的是发酵温度,其次是酵母接种量,初始糖度的影响最小。根据综合评分可以得出发酵最佳组合为A3B3C1,即发酵温度27 ℃,酵母接种量0.8%,初始糖度180 g/L。对正交试验结果进行验证,该工艺加工的山荔枝酒精饮料,所得酒体澄清,色泽均匀一致,典型突出,具有山荔枝独特的清香味,感官评价综合评分为89 分,优于其他组合。
2.3 澄清工艺优化
不同澄清剂对山荔枝酒精饮料的澄清效果如图1 所示。
2.3.1 壳聚糖对山荔枝酒精饮料的澄清效果
由图1 可以看出,壳聚糖对山荔枝酒精饮料具有很好的澄清效果,当用量在10 g/L 时,澄清效果最好,此时透光率达到91.40%±0.95%。壳聚糖对山荔枝酒精饮料有较好的絮凝澄清效果,是因为在酸性介质中,壳聚糖的游离氨基(NH2)与质子H+结合,成为带正电荷的高分子物质,而饮料中含有大量带负电荷的果胶、纤维素、单宁及多聚戊糖等微小颗粒,当两者混合后,依靠静电作用,饮料中的微小颗粒很快缠绕于有线性分子结构的壳聚糖上,使微小颗粒变成大颗粒,进而逐渐沉降,使饮料澄清透明[21]。
2.3.2 果胶酶对山荔枝酒精饮料的澄清效果
图1 显示果胶酶的用量在6 g/L 时,山荔枝酒精饮料透光率较高,达到95.00%±2.23%,这可能是由于果胶酶能水解饮料中果胶等多糖物质,使之失去稳定性,不溶性大分子物质和果肉微粒失去胶体保护作用而发生共聚沉淀,因此增加了饮料的透光率[22]。果胶酶用量在6 g/L与8 g/L 时差异不显著(P>0.05),增加至10 g/L 时呈现下降趋势,这可能是因为果胶降解所得的低分子物质改变了酒中的pH 值,从而影响了果胶酶的澄清效应,造成澄清度的降低[23]。
2.3.3 明胶对山荔枝酒精饮料的澄清效果
当明胶用量达到8 g/L 时透光率达到33.21%±1.17%,此时的澄清效果最好(如图1 所示)。随着明胶添加量的增大,山荔枝酒精饮料的透光率呈现先增大后减小的趋势,这可能是由于山荔枝酒精饮料中含有丰富的单宁类物质,而明胶属于蛋白质类,可与饮料中的单宁形成蛋白质-单宁络合物,随着络合物的增多,吸附在酒中的悬浮物将会聚沉,从而达到澄清效果[24]。当明胶用量超过8 g/L 时,由于单宁物质不足,过量的明胶形成悬浮物,导致透光率下降。
2.3.4 硅藻土对山荔枝酒精饮料的澄清效果
由图1 可知,随着硅藻土添加量的增加,山荔枝酒精饮料的透光率先增加后下降,这是因为硅藻土将酵母沉淀于容器的底部,经过一段时间后,酵母繁殖生长,同时进行发酵过程,释放CO2和酒精,CO2堆积形成气泡并向上运动,将沉淀搅起,导致澄清度降低和不稳定[25],因此硅藻土溶液的用量超过8 g/L 时,样品透光率降低。
综上所述,当澄清剂添加量≤8 g/L 时,不同澄清剂对山荔枝酒精饮料澄清效果的整体影响趋势相似,即随着添加浓度的升高,澄清效果越显著。对比四种澄清剂,发现壳聚糖和果胶酶的澄清效果显著优于明胶和硅藻土(P<0.05),尤其是果胶酶。在低添加浓度时,果胶酶澄清效果最优,但随着添加浓度增大,壳聚糖和果胶酶之间的澄清效果差异逐渐减小。当壳聚糖和果胶酶的添加量达到8 g/L 和10 g/L 时,两种澄清剂处理的山荔枝酒精饮料的透光度之间无显著性差异(P>0.05)。通过综合用量和饮料的透光率,对比分析4 种澄清剂的澄清效果,可以看出其效果呈现出果胶酶>壳聚糖>硅藻土>明胶的趋势。果胶酶在较低用量,即添加6 g/L 时,山荔枝酒精饮料透光率达到最高。因此,选取果胶酶作为山荔枝酒精饮料的澄清剂。
2.4 山荔枝酒精饮料中的酚类物质及抗氧化活性分析
2.4.1 酚类物质
通过优化工艺后(发酵温度27 ℃,酵母接种量0.8%,初始糖度180 g/L,以果胶酶为澄清剂),对生产出的山荔枝酒精饮料的总酚、总黄酮含量进一步测定。根据上述试验方法中测出的没食子酸标准曲线,算出总酚的含量90.74±0.23 μg/mL,以芦丁作为标准曲线,计算饮料中的黄酮含量24.66±0.08 μg/mL。
通过LC-MS 分析,得到山荔枝酒精饮料中酚类物质在负离子模式下的总离子流图(如图2 所示)。结合已有文献对酚类物质的研究结果,并根据总离子流图中对应的保留时间/质荷比以及二级碎片离子对饮料中酚类物质进行鉴定,共推断出7 种主要成分(如表7 所示),包括奎宁酸、水杨酸己糖苷、咖啡酰己糖苷、单咖啡酰奎尼酸、香橙苷、对香豆酸等。
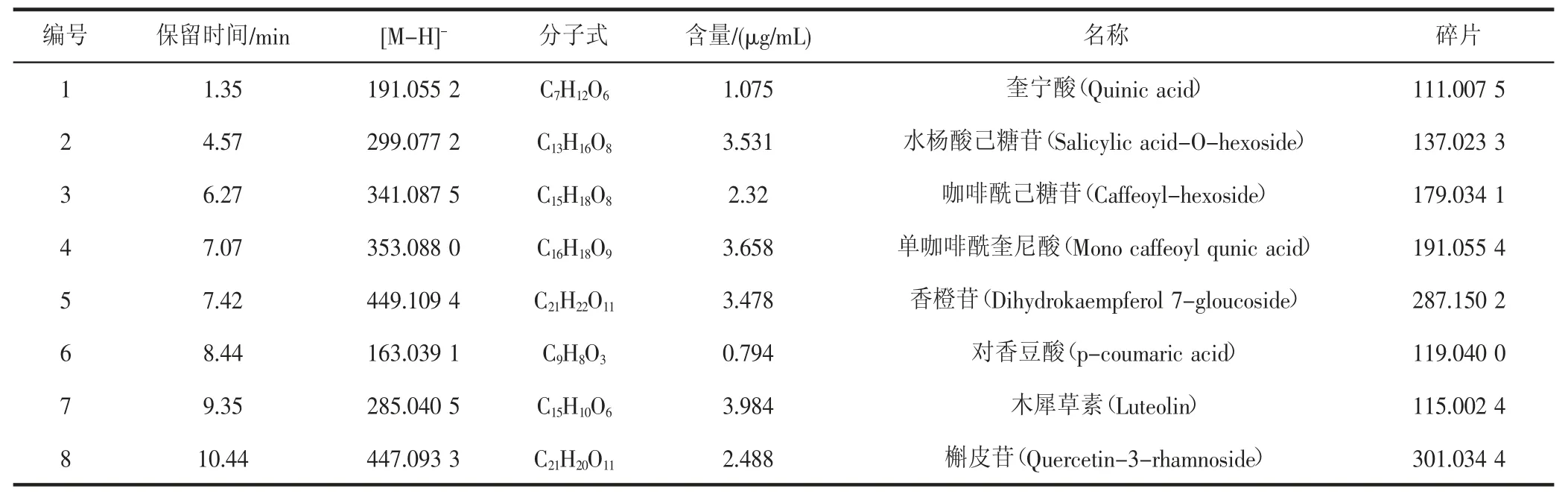
表7 山荔枝酒精饮料中主要成分的LC-MS 鉴定Table 7 Identification of main components of litchi alcoholic beverage by LC-MS
2.4.2 DPPH·自由基清除能力
山荔枝酒精饮料的DPPH·自由基清除活性结果如图3 所示。由图3 可以看出,饮料对DPPH·自由基具有较好的清除能力,并且呈现量效关系。随着样品浓度升高,其DPPH·自由基清除活性能力也随之升高,但升高程度逐渐降低,如样品浓度在20~80 μg/mL 之间,清除率变化幅度已很小,说明此浓度下饮料中的DPPH·自由基基本上已经被清除,在80 μg/mL 时清除率达到最大,为90.3%±0.22%,这与Kaustav 等[26]的试验结果相似,荔枝饮料DPPH·自由基清除率可达到86.7%±0.17%。本研究结果证明山荔枝酒精饮料具有很好的DPPH·自由基清除活性,可以用来清除人体内过多的自由基,从而避免人体组织器官受到自由基的氧化损伤。
3 结论
本文以云南山荔枝为试验原料,研究了山荔枝低酒精度饮料的发酵工艺、澄清工艺,以及饮料中总酚、总黄酮含量、酚类物质的组成及其抗氧化性。结果表明,最佳发酵工艺条件为初始糖度180 g/L,发酵温度27 ℃,酵母接种量0.8%,最优的澄清剂为果胶酶(果胶酶浓度为6 g/L时,其透光率可达到95%)。通过测定总酚、总黄酮含量及分析多酚组分发现,山荔枝酒精饮料中多酚含量为90.74 μg/mL,黄酮含量为24.66 μg/mL,主要多酚组分包括水杨酸己糖苷、咖啡酰己糖苷、单咖啡酰奎尼酸、香橙苷、对香豆酸、木犀草素、槲皮苷等7 种。同时,山荔枝酒精饮料对DPPH·自由基具有较好的清除能力,在较低浓度条件下对DPPH 的清除率可达到80%以上。
综上所述,开发以山荔枝为主要原料的发酵低酒精度的饮料,不仅可以丰富云南特色山荔枝产品的种类,而且还能够开发出具有较高抗氧化功能特性的果酒饮料,对推动地方产业发展、提升消费者健康具有重要的意义。
