促皮质素制备工艺中病毒灭活能力的验证
2020-03-23汪雅雯孙源远黄臻辉
汪雅雯 孙源远 黄臻辉
摘 要 目的:对促皮质素进行病毒灭活工艺验证。方法:选择非脂包膜病毒EMCV、PPV和ReoV-3用于验证加热处理步骤的病毒灭活能力,选择脂包膜病毒PRV、VSV和BVDV用于验证丙酮沉淀处理步骤的病毒灭活能力。结果:加热处理步骤可有效灭活非脂包膜病毒,丙酮沉淀处理步骤可有效灭活脂包膜病毒。结论:本次验证为促皮质素的病毒安全性评价提供了依据。
关键词 促皮质素 制备工艺 病毒灭活
中图分类号:TQ464.51 文献标志码:A 文章编号:1006-1533(2020)03-0069-03
Verification of the ability of virus inactivation in corticotrophin production
WANG Yawen*, SUN Yuanyuan, HUANG Zhenhui
(SPH NO.1 Biochemical & Pharmaceutical Co., Ltd., Shanghai 200240, China)
ABSTRACT Objective: To verify the process for virus inactivation in the production of corticotrophin. Methods: Virus inactivation was verified by heating for non-lipid enveloped viruses such as EMCV, PPV and ReoV-3 and by acetone precipitation for lipid enveloped viruses such as PRV, VSV and BVDV. Results: The non-lipid enveloped virus could be effectively inactivated by heating while the lipid enveloped virus by acetone precipitation. Conclusion: This verification can provide a basis for the evaluation of virus safety in the production of corticotrophin.
KEY WORDS corticotrophin; preparation process; inactivation procedure of viruses
促皮质素,即促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)来源于猪、牛、羊的脑垂体前叶,常见制备步骤包括盐酸丙酮法提取(加热)、丙酮沉淀和丙酮脱水等工序。参照《多组分生化药注射剂基本技术要求》[1]、《药品生产质量管理规范(2010年修订)》生化药品附录[2]、《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则》[3]和《血液制品去除灭活病毒技术方法及验证指导原则》[4]的规定,结合促皮质素工艺情况,选择加热处理和丙酮沉淀处理考察促皮质素制备工艺中灭活病毒的能力。加热处理灭活病毒的原理主要是加热可使衣壳蛋白和病毒外膜蛋白变性,从而导致病毒包膜上糖蛋白棘突结构发生变化,阻止病毒吸附于宿主细胞;同时,加热使得病毒复制所需的酶类失活,阻止病毒复制。加热灭活病毒是非特异性的,对脂包膜病毒和非脂包膜病毒均可灭活[5]。丙酮作为一种脂溶剂,可破坏包膜结构从而杀死病毒。病毒感染性滴度减少≥4 log的处理步骤认可为有效的病毒去除/灭活工艺步骤[3-4]。
1 材料与方法
1.1 样品
3批次垂体前叶粉(促皮质素制备工艺中的起始物料),用于加热处理步骤病毒灭活验证试验。
3批次垂体前叶沉淀前滤清液(以下简称“滤清液”,为促皮质素制备工艺中的中间体),用于丙酮沉淀处理步骤病毒灭活验证试验。
1.2 指示病毒
考虑指示病毒的相关性、基因组、有无包膜和理化抗性等因素,同时结合促皮质素病毒灭活验证工艺,选择了6种具有代表性的指示病毒,其中非脂包膜病毒脑心肌炎病毒(EMCV)、猪细小病毒(PPV)和牛呼肠孤病毒3型(ReoV-3)验证加热处理步骤的病毒灭活能力,脂包膜病毒伪狂犬病毒(PRV)、水疱性口腔炎病毒(VSV)和牛腹泻病毒(BVDV)驗证丙酮沉淀处理步骤的病毒灭活能力(表1)。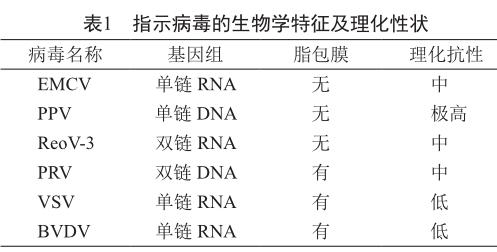
1.3 病毒灭活验证方法
1.3.1 加热处理步骤
准确称取垂体前叶粉,加入7倍量(W/V)丙酮35 ml,3倍量(W/V)1 mol/L HCl溶液15 ml,搅拌溶解15 min后,置于(51±1)℃恒温水浴锅中,待样品升温至50 ℃,按25∶1(样品-病毒,V∶V)比例加入指示病毒2 ml,混匀后开始计时,分别于0、5、15、30和60 min时取样,测定各取样时间点的病毒滴度。
同时设置相同工艺时间内病毒在不含HCl的中性室温条件下的中性对照和不含HCl的(51±1)℃中性保温条件下的加温对照,以及病毒在室温条件下的酸性对照,并考察升温至50℃的过程对指示病毒的影响。
1.3.2 丙酮沉淀处理步骤
用移液器准确吸取9 ml滤清液,共计6份,按9∶1(滤清液-病毒,V∶V)的比例分别加入指示病毒1 ml,混匀。取其中1份,加入7倍量纯水70 ml,其余5份分别按1∶7(样品-冷丙酮,V∶V)的比例加入冷丙酮70 ml,搅拌混匀后置于(1±1)℃恒温液浴循环两用槽中静置沉淀,开始计时,于0、5、15、30和60 min时各取出1份,3 000 r/min离心1 min,分离上清和沉淀,纯水复溶沉淀至原体积,取样测定上清和沉淀复溶液中的病毒滴度。
同时设置相同工艺时间内病毒在中性滤清液中的纯水对照和酸性滤清液中的酸性对照,并考察丙酮对中性滤清液中指示病毒的灭活作用。
参照《动物病毒学》(第二版)(四)病毒感染力的滴定标准[6],应用微量病变法测定工艺处理前后各批次样品中的病毒滴度。按Reed-Muench法计算病毒滴度(以半数细胞感染剂量TCID50表示,TCID50对数值= 高于50%组病变的病毒最高稀释度的对数值+距离比例),并计算处理前后病毒滴度的下降值。
2 结果
2.1 细胞毒性试验
指示病毒BVDV采用MDBK细胞培养,VSV和EMCV采用Vero细胞培养,PRV和PPV采用ST细胞培养,ReoV-3采用LLC-MK2细胞培养。将各样品进行10~100倍稀释,接种于各指示细胞(MDBK细胞、Vero细胞、ST细胞或LLC-MK2细胞)进行细胞毒性试验。
结果表明,垂体前叶粉溶解液和经加热后的溶液50倍稀释度对Vero细胞、ST细胞和LLC-MK2细胞生长均无影响,加热步骤指示病毒EMCV、PPV和ReoV-3的滴度最低检测限均为1.7 logs;滤清液和丙酮沉淀后的上清和沉淀复溶液50倍稀释度对MDBK细胞、Vero细胞和ST细胞生长均无影响,丙酮沉淀步骤指示病毒BVDV、PRV和VSV的滴度最低检测限均为1.7 logs。
2.2 加热处理步骤灭活指示病毒的结果
3批次垂体前叶粉中加入7倍量丙酮和3倍量1 mol/L HCl搅拌溶解15 min后,置于恒温水浴锅中升温至50 ℃,加入指示病毒,混匀后立即取样,3批次样品中EMCV、PPV和ReoV-3滴度均降至检测限1.7 logs以下,滴度平均下降值分别≥4.9 logs、≥4.3 logs和≥4.3 logs。
在中性对照中,3批次垂体前叶粉中加入7倍量丙酮和3倍量纯水搅拌溶解15 min后加入指示病毒,混匀后室温静置60 min,3批次样品中EMCV、PPV和ReoV-3滴度平均下降值分别为0.8 logs、0.4 logs和1.0 logs。表明相同工艺时间内中性垂体前叶粉溶解液对EMCV、PPV和ReoV-3基本无灭活作用。
在酸性对照中,3批次垂体前叶粉中加入7倍量丙酮和3倍量1 mol/L HCl搅拌溶解15 min后加入指示病毒,在加入瞬间,3批次样品中EMCV、PPV和ReoV-3滴度均降至检测限1.7 logs以下,滴度平均下降值分别≥4.9 logs、≥4.3 logs和≥4.3 logs。表明相同工艺时间内样品中的酸性条件对EMCV、PPV和ReoV-3具有快速灭活作用。
在加温对照中,3批次垂体前叶粉中加入7倍量丙酮和3倍量纯水搅拌溶解15 min后,置于恒温水浴锅中升温至50 ℃后,加入指示病毒,经(51±1)℃保温灭活60 min,3批次样品中EMCV和ReoV-3滴度均降至检测限1.7 logs以下,滴度平均下降值分别≥4.9 logs和≥4.3 logs;而PPV滴度平均下降值为1.5 logs。表明相同工艺时间内(51±1)℃保温对EMCV和ReoV-3具有灭活作用,对PPV具有一定的灭活作用。
在升温对照中,3批次垂体前叶粉中加入7倍量丙酮和3倍量1 mol/L HCl搅拌溶解15 min后加入指示病毒,将其置于恒温水浴锅中升温至50 ℃,在该升温过程中,3批次样品中EMCV、PPV和ReoV-3滴度均降至检测限1.7 logs以下,滴度平均下降值分别≥4.9 logs、≥4.3 logs和≥4.3 logs。表明该升温过程对EMCV、PPV和ReoV-3具有灭活作用。
将3批次加热30 min的样品(50倍稀释度)的测定细胞孔分别进行盲传3代,指示细胞均正常生长,盲传3代无病变,表明指示病毒EMCV、PPV和ReoV-3均被完全灭活。
上述结果表明,加热处理步骤能有效灭活非脂包膜指示病毒EMCV、PPV和ReoV-3,该灭活工艺中的酸性条件和(51±1)℃水浴保温均对指示病毒具有灭活作用。
2.3 丙酮沉淀处理步骤灭活指示病毒的结果
3批次滤清液中加入指示病毒和7倍量冷丙酮,搅拌混匀后立即于3 000 r/min离心1 min,纯水复溶沉淀至原体积。从上清中取样,3批次上清中BVDV、PRV和VSV滴度均降至检测限1.7 logs以下,滴度平均下降值分别≥4.4 logs、≥4.5l ogs和≥4.3 logs;从沉淀复溶液中取样,3批次沉淀复溶液中BVDV、PRV和VSV滴度平均下降值同上清中的滴度平均下降值。
在丙酮對照中,3批次染毒中性滤清液中加入7倍量冷丙酮后立即于3 000 r/min离心1 min,纯水复溶沉淀至原体积。从上清中取样,3批次上清中BVDV、PRV和VSV滴度均降至检测限1.7 logs以下,滴度平均下降值分别≥4.4 logs、≥4.5 logs和≥4.3 logs;从沉淀复溶液中取样,3批次沉淀复溶液中BVDV滴度平均下降值为4.1 logs、而PRV和VSV滴度均降至检测限1.7 logs以下,滴度平均下降值分别≥4.5 logs和≥4.3 logs。表明相同工艺时间内丙酮对指示病毒BVDV、PRV和VSV均具有快速灭活作用。
在纯水对照中,3批次滤清液中加入7倍量纯水,调节pH至中性,加入指示病毒,搅拌混匀后随试验组于(1±1)℃水浴静置60 min,3批次样品中BVDV、PRV和VSV滴度平均下降值分别为0.8 logs、0.7 logs和0.7 logs。表明不含丙酮的中性样品对BVDV、PRV和 VSV均无灭活作用。
在酸性对照中,3批次染毒滤清液中加入7倍量纯水,混匀后立即取样,3批次样品中BVDV、PRV和VSV滴度平均下降值分别为1.2 logs、4.0 logs和3.9 logs。取样后的样品随试验组于(1±1)℃水浴静置60 min,3批次样品中BVDV滴度平均下降值为2.2 logs、而PRV和VSV滴度均降至检测限1.7 logs以下,滴度平均下降值分别≥4.5 logs和≥4.3 logs。表明该酸性条件对BVDV具有一定的灭活作用,对PRV和VSV均具有快速灭活作用。
将3批次丙酮沉淀30 min的上清(50倍稀释度)和沉淀复溶液(50倍稀释度)的测定细胞孔分别进行盲传3代,指示细胞均正常生长,盲传3代无病变,表明指示病毒BVDV、PRV和VSV均被完全灭活。
上述结果表明,丙酮沉淀处理步骤对脂包膜指示病毒(BVDV、PRV和VSV)均具有快速灭活作用,滤清液本身的低pH条件对病毒同样具有灭活作用。
3 结语
促皮质素制备工艺中的两个工艺步骤(加热处理和丙酮沉淀处理)重复性高、实验数据和结果稳定,且两个工艺步骤原理不同、能从机制上互补。加热处理步骤可有效灭活非脂包膜指示病毒(EMCV、PPV和ReoV-3),丙酮沉淀处理步骤可有效灭活脂包膜指示病毒(BVDV、PRV和VSV)。本次验证试验为该品种的病毒安全性评价提供了依据。
致谢:感谢王小良、吴娟对本文的贡献。
参考文献
[1] 国家药品监督管理局. 关于发布化学药品注射剂和多组分生化药注射剂基本技术要求的通知(国食药监注〔2008〕7号)[EB/OL]. (2008-01-10)[2019-04-08]. http://www.nmpa.gov. cn/WS04/CL2196/323287.html.
[2] 国家药品监督管理局. 总局关于发布《药品生产质量管理规范(2010年修订)》生化药品附录的公告(2017年第29号)[EB/OL]. (2017-03-16)[2019-04-08]. http://www. nmpa.gov.cn/WS04/CL2138/300305.html.
[3] 国家药品监督管理局药品审评中心. 生物组织提取制品和真核细胞表达制品的病毒安全性评价的技术审评一般原则[EB/OL]. (2007-08-23)[2019-04-08]. http://www.cde.org. cn/zdyz.do?method=largePage&id=2082.
[4] 國家药品监督管理局药品审评中心. 血液制品去除灭活病毒技术方法及验证指导原则[EB/OL]. (2008-09-04)[2019-04-08]. http://www.cde.org.cn/zdyz. do?method=largePage&id=34.
[5] 赵雄, 尹惠琼, 章金刚. 纤维蛋白原制品病毒灭活方法研究进展[J]. 中国输血, 2008, 21(2): 141-144.
[6] 殷震, 刘景华. 动物病毒学[M]. 北京: 科学出版社, 1997: 329-331.
