乳腺癌中Nupr1蛋白及mRNA表达及临床意义
2020-03-23王维娜赵春兰2梁月勉王晔兴张文清
王维娜,赵春兰2,梁月勉,王晔兴,张文清
(1.河北大学附属医院病理科,河北 保定 071000;2.保定市妇幼医院病理科,河北 保定 071000)
Nupr1是最初在急性胰腺炎中发现的一个小分子应激核蛋白[1],后来发现它与多种肿瘤发生及进展有关。关于它在乳腺癌中的作用研究很少,本研究检测了乳腺癌组织(实验组)及乳腺良性病变组织(对照组)Nupr1 mRNA及蛋白表达情况,并分析了其与乳腺癌临床病理特征的关系,探讨Nupr1表达与乳腺癌发生、进展、预后的关系,以期为临床个体化治疗提供理论依据。
1 材料与方法
1.1 标本来源
随机选取2012年1月至2018年12月河北大学附属医院乳腺科术前未接受治疗的手术切除228例乳腺癌(包括非特殊型浸润性癌161例,特殊型浸润性癌67例)及60例良性乳腺病变(对照组),常规石蜡包埋备免疫组化检测。留取上述病例中部分行术中冰冻送检的新鲜组织(包括乳腺癌30例,良性乳腺病变41例,不典型导管增生19例),组织离体后尽快置于-80 ℃液氮冷冻并低温冰箱保存备mRNA检测用。患者均为女性,年龄22~70岁,中位年龄52岁。由2名资深病理医师复阅切片确诊。本研究经河北大学附属医院伦理委员会批准。
1.2 方法
1.2.1 免疫组化检测
免疫组化S-P检测试剂盒购自北京中杉生物技术公司,染色步骤按说明书进行。Nupr1兔抗人多克隆抗体购自上海科敏生物科技有限公司。其余抗体(ER、PR、HER-2、Ki67)购自福州迈新公司,0.01%PBS代替一抗作阴性对照。HER-2的判定参照《乳腺癌HER2检测指南》[2]。Nupr1判定标准:高倍镜下计数100个细胞中着色细胞百分比,取5个视野的平均值。评分标准:阴性为0分、阳性细胞≤10%为1分、11%~50%为2分、51%~75%为3分、>75%为4分。染色强度:无染色为0分、淡黄色为1分、棕黄色为2分、深棕色为3分。两得分相乘,以总分4分为分界点,将<4分者定义为Nupr1阴性,≥4分者为Nupr1阳性[3]。其余免疫组化参照2012版WHO乳腺癌组织学与分子遗传学分类标准。分子分型参照2018年乳腺癌诊疗指南。由2位病理医师盲法观察,记数10个高倍视野染色丰富区200个癌细胞中着色细胞数,计算着色细胞比例,取平均值。
1.2.2 实时定量PCR检测
总RNA提取用Trizol、RT-PCR试剂盒均购自武汉博士德公司。RT-PCR引物由上海生物工程有限公司合成。mRNA检测标本取自术后新鲜组织,根据试剂盒说明书提取总RNA。取2 μg总RNA,加入oligoDT、逆转录酶,25 ℃ 5 min→42 ℃ 10 min→50 ℃ 60 min→70 ℃ 5 min进行逆转录反应。Nupr1(211 bp)引物序列:5′-GCG GGC ACG AGA GGA AAC-3′; 5′-CTC AGT CAG CGG GAA TAA GTC-3′; GAPDH作为内参标,引物(121 bp)序列:5′-GGC GGC ACC ACC ATG TAC CCT -3′; 5′-AGG GGC CGG ACT CGT CAT ACT -3′。取逆转录产物 2 μL,加入引物各0.5 μL、SYBR GREEN MAsterMix10 μL置 iQTM SYBR Green Supermix上 (Bio-Rad, Her-cules, CA) 。PCR循环参数95 ℃ 30 s→60 ℃ 30 s→72 ℃ 30 s,共循环40个周期,72 ℃ 4 min 延伸。样本均设3个平行对照以保证实验结果的准确性。采用2-△△Ct法计算目的基因mRNA相对表达量。
1.3 统计学方法

2 实验结果
2.1 Nupr1 mRNA的表达
实时荧光定量PCR溶解曲线分析证实扩增产物具有特异性。乳腺癌、不典型导管增生、良性乳腺病变3组间mRNA相对表达量分别为3.25±0.46、2.23±0.50、0.08±0.31,差异有统计学意义(F=18.324,P<0.05),其中乳腺癌及不典型导管增生组中 Nupr1 mRNA表达均高于良性乳腺病变组(t=2.613,P<0.05;t=6.339,P<0.05)。
2.2 Nupr1蛋白在不同组中的表达
Nupr1蛋白在乳腺癌中显示胞浆、胞核着棕黄色颗粒(图1),免疫组化结果显示乳腺癌组Nupr1蛋白高表达率53.5%,部分乳腺癌显示阴性表达(图2),乳腺良性病变组Nupr1蛋白高表达率16.7%。乳腺癌组中Nupr1蛋白表达高于乳腺良性病变组,差异有统计学意义(χ2=25.969,P<0.0001)。
2.3 Nupr1蛋白在不同组织学类型乳腺癌中的表达
非特殊型浸润性癌Nupr1蛋白高表达率53.4%,特殊型浸润性癌(包括浸润性小叶癌、浸润性微乳头状癌、腺样囊性癌)Nupr1蛋白高表达率53.7%,非特殊型浸润性癌与特殊型浸润性癌Nupr1蛋白高表达率差异无统计学意义,Nupr1的表达与组织学类型无关(χ2=0.002,P=0.964)。
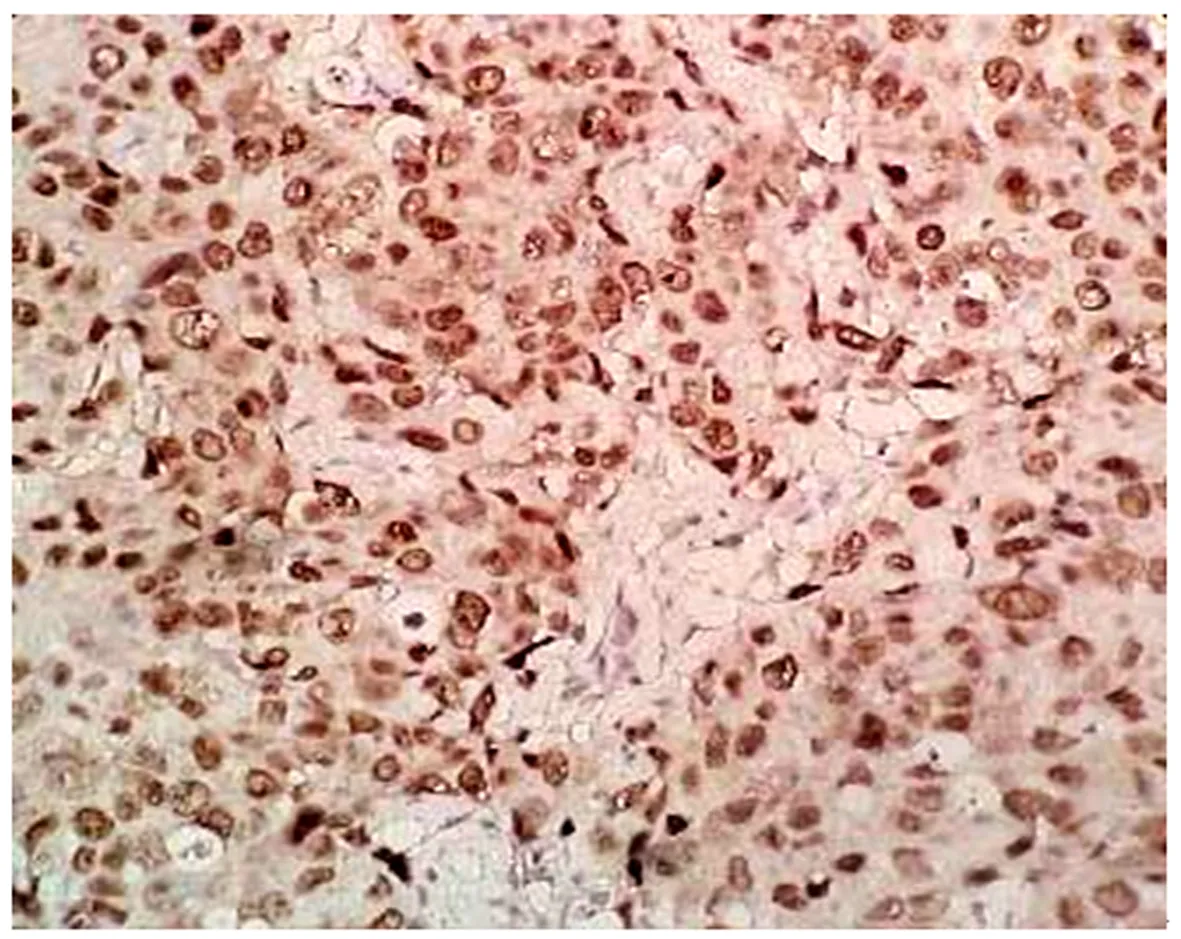
图1 乳腺癌组织中Nupr1呈核/浆强阳性着色(免疫组化S-P法,40×10)

图2 部分乳腺癌组织中Nupr1阴性(免疫组化S-P法,40×10)
2.4 Nupr1蛋白表达与乳腺癌分期的关系
Ⅰ期、Ⅱ期及Ⅲ期乳腺癌Nupr1蛋白高表达率分别为28.6%、52.8%、85.15%。Nupr1蛋白高表达与乳腺癌分期有关(χ2=33.970,P<0.0001),随着肿瘤分期的进展,Nupr1蛋白表达有逐渐增高的趋势,其中Ⅲ期乳腺癌Nupr1蛋白高表达率高于Ⅰ期(χ2=32.900,P<0.0001)及Ⅱ期(χ2=15.790,P<0.0001),差异有统计学意义;Ⅱ期乳腺癌Nupr1蛋白高表达率高于Ⅰ期(χ2=9.160,P=0.002)。
2.5 Nupr1蛋白表达与不同分子分型的关系
Luminal A型、Luminal B型、三阴性型及HER-2型乳腺癌Nupr1蛋白高表达率分别为47.7%、44.4%、51.4%、75.6%。不同的分子分型Nupr1蛋白高表达率不同(χ2=14.367,P<0.001)。其中三阴性型、Luminal A、B型Nupr1蛋白高表达率差异无统计学意义(χ2=0.360,P=0.834),HER-2型Nupr1蛋白表达率高于Luminal A型、Luminal B型、三阴性型,差异具有统计学意义(χ2=10.703,P=0.001;χ2=6.801,P=0.009;χ2=8.851,P=0.003)。
2.6 Nupr1蛋白表达与乳腺癌肿瘤大小、组织学分级、月经状态的关系
Nupr1蛋白表达与乳腺癌患者月经状态无关。肿瘤大小以2.0 cm为界, Nupr1蛋白表达与乳腺癌肿瘤大小无关。参照Nottingham联合组织学分级标准对乳腺癌进行组织学分级, Nupr1蛋白表达与乳腺癌组织学分级无关(表1)。

表1 Nupr1蛋白表达与乳腺癌肿瘤大小、组织学分级、月经状态的关系
3 讨论
Nupr1作为一广泛分布于体内的应激诱导蛋白,首次在大鼠急性胰腺炎腺泡细胞中被发现。人类Nupr1基因编码相对分子量约8×103的小分子核蛋白,故被命名为P8。Nupr1具有转录活性,通过参与不同的胞内信号途径发挥不同的功能。非肿瘤性病变中,可发挥抗炎、自噬等作用。且已证实它在多种肿瘤的发生、发展和转移过程起重要作用[4-8]。包括在胰腺癌发生发展中的促进作用,其机制可能与蛋白激酶A路径保护细胞免受代谢应激诱导的自噬性死亡、抑制细胞凋亡有关。下调胰腺癌细胞中Nupr1的表达会导致细胞线粒体功能异常,引起程序介导的细胞坏死;另外在口腔鳞状细胞癌、非小细胞肺癌、胃癌、肝细胞癌、甲状腺乳头状癌中均显示高表达,且与患者年龄、肿瘤进展、肿瘤大小、淋巴结转移、分化程度有关[9-11]。Zeng等[12]发现抑制多发性骨髓瘤细胞Nupr1的表达可通过改变Caspase蛋白及PTEN的状态诱导细胞凋亡。以上研究均支持Nupr1在肿瘤发生进展中起促进作用。另一种观点认为Nupr1在某些肿瘤中也可能作为肿瘤生长抑制因子发挥作用,这似乎与先前的文献报道矛盾,但可能Nupr1的独特之处就在于其具备复杂的生物学功能,包括前列腺癌、膀胱癌细胞中Nupr1表达均低于正常组织,且它的表达水平与肿瘤的浸润及增殖能力呈负相关[13-14]。有研究者认为Nupr1作为一种内在无序蛋白,与细胞内一些复合物结合后,可以诱导细胞生长停止和衰老, 减少细胞迁移, 减少化学耐药,并成功地阻止了裸鼠体内肿瘤的进展,提示它可能作为肿瘤治疗的潜在靶点[15]。Jia等[16]也发现恶性黑色素瘤细胞中,下调Nupr1的表达,可通过P53基因的途径促进肿瘤细胞的增生,同样推测Nupr1为潜在的肿瘤抑制基因。
在乳腺癌的研究中发现Nupr1的表达情况不尽一致。Ree等[5]研究发现,Nupr1可以在人类乳腺癌发展的早期发挥促进肿瘤生长的作用,且与乳腺癌转移及预后不良相关,这提示Nupr1可能是促进肿瘤细胞向远处转移生长的关键蛋白。Jung等[17]发现早期乳腺癌细胞系中染色体16p11.2及17q12循环区改变与肿瘤预后不良有关,二者共同阳性的肿瘤预后更差,而Nupr1基因定位于16p11.2,HER-2定位于17q12,推测基因拷贝数的异常改变参与了肿瘤的转移。本研究发现,HER-2型乳腺癌Nupr1表达水平明显高于其他分子类型乳腺癌,可能与此变化有关。Jiang等[18]却发现预后差的乳腺癌中Nupr1表达降低,且发生淋巴结转移的肿瘤比无淋巴结转移的Nupr1表达水平低,ER-beta阳性且低水平表达Nupr1的肿瘤生存期短,推测Nupr1在乳腺癌细胞中的作用与在膀胱癌、前列腺癌中的作用类似,可能起肿瘤抑制基因的作用并参与雌激素调节细胞的生长,其中Nupr1可能受雌激素和泛素通路双重调节。而Ito等[11]发现Nupr1的表达与乳腺癌细胞凋亡指数呈负相关。
基因表达的调控体现在转录水平、转录后调控、翻译调控及翻译后调控,本研究发现,Nupr1 mRNA在乳腺癌组织显著高于不典型导管增生及良性乳腺组织,且与蛋白表达一致,提示了此基因在乳腺癌发生发展中起了重要作用。Nupr1蛋白在乳腺导管原位癌及癌前病变中高表达率高于乳腺良性病变,这与某些研究[17]结果一致,推测它在乳腺癌的早期发生阶段发挥了重要作用,其作用机制可能与它在胰腺癌早期阶段有相似之处。同时本研究发现,在乳腺浸润性癌中Nupr1的高表达率与肿瘤分期有关,肿瘤的分期越晚,Nupr1高表达率越高。
不同分子分型的乳腺癌中,一般认为Luminal型乳腺癌患者发病年龄晚、组织学分级低、无病生存期长、预后好,而HER-2型和三阴性型恰好相反[2]。本实验发现预后相对不良的HER-2型,Nupr1的表达显著高于预后较好的Luminal型;而三阴性型Nupr1表达未见显著升高。这些结果均表明,乳腺癌的晚期进展中,Nupr1有可能起了重要的作用,且Nupr1高表达与乳腺癌的预后不良有关。
上述研究结果表明,Nupr1可能在乳腺癌早期阶段即发生了改变,包括基因学表达的改变,通过信号传导机制发挥促肿瘤作用。检测组织中Nupr1的表达,探讨其与细胞内信号机制的关系可以从崭新的角度明确乳腺癌发生的机制,检测Nupr1的表达水平可能作为乳腺癌早期发现、判断预后及采用个体化治疗方案的有用指标。同时提示Nupr1基因沉默可能是治疗乳腺癌的一种很有前途的靶点,需要进一步深入研究。
