慢性乙型肝炎防治指南(2019年版)
2020-03-23中华医学会感染病学分会中华医学会肝病学分会
中华医学会感染病学分会 中华医学会肝病学分会
中华医学会感染病学分会和肝病学分会于2005年组织国内有关专家制定了《慢性乙型肝炎防治指南》(第1版),并分别于2010年和2015年进行了更新。近4年来,国内外有关慢性乙型肝炎病毒(hepatitis B virus,HBV)感染的基础和临床研究都取得了重要进展,为更好地规范慢性乙型肝炎(chronic hepatitis B,CHB)的预防、诊断和治疗,助力实现世界卫生组织(World Health Organization,WHO)提出的“2030年消除病毒性肝炎作为重大公共卫生威胁”的目标,再次更新本指南。
本指南旨在帮助临床医师在CHB预防、诊断和治疗中做出合理决策,但并非强制性标准,也不可能包括或解决CHB诊治中的所有问题。因此,临床医师在面对某一患者时,应在充分了解有关本病的最佳临床证据、认真考虑患者病情及其意愿的基础上,根据自己的专业知识、临床经验和可利用的医疗资源,制定全面合理的诊疗方案。
本指南中的证据等级分为A、B和C三个级别,推荐等级分为1和2两个级别,见表1(根据GRADE分级修订)。
一、术语
1.慢性HBV感染:HBsAg和/或HBV DNA阳性6个月以上。
2.CHB:由HBV持续感染引起的肝脏慢性炎症性疾病。
3.HBV 再激活(HBV reactivation):HBsAg阳性 /抗-HBc阳性,或HBsAg阴性/抗-HBc阳性患者接受免疫抑制治疗或化学治疗时,HBV DNA较基线升高≥2 lgIU/ml,或基线HBV DNA阴性者转为阳性,或HBsAg由阴性转为阳性。
4.HBeAg阴转(HBeAg clearance):既往HBeAg阳性的患者HBeAg消失。
5.HBeAg 血清学转换(HBeAg seroconversion):既往HBeAg阳性的患者HBeAg消失,抗-HBe出现。
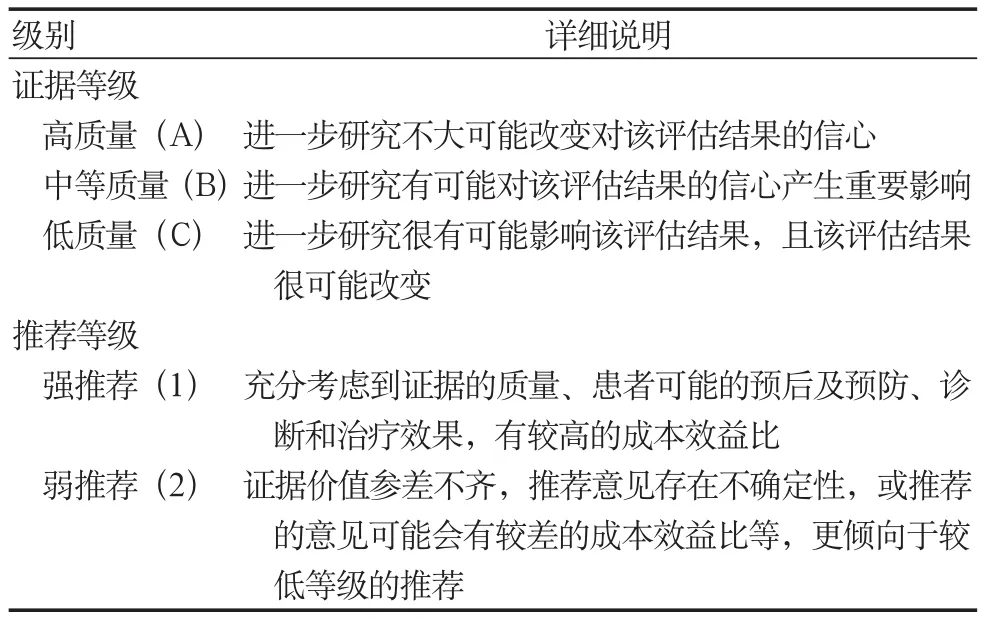
表1 推荐意见的证据等级和推荐等级
6.乙型肝炎康复(resolved hepatitis B):曾有急性或CHB病史,现为HBsAg持续阴性、抗-HBs阳性或阴性、抗-HBc阳性、HBV DNA低于最低检测下限、丙氨酸转氨酶(alanine aminotransferase,ALT)在正常范围。
7.病毒学突破(virologic breakthrough):核苷(酸)类似物(nucleoside/nucleotide analogues,NAs)治疗依从性良好的患者,在未更改治疗的情况下,HBV DNA水平比治疗中最低值升高> 1 lgIU/ml,或转阴性后又转为阳性,并在1个月后以相同试剂重复检测确证,可有或无ALT升高。
8.病毒学复发(virologic relapse):获得病毒学应答的患者停药后,间隔1个月2次检测HBV DNA均> 2×103IU/ml。
9.耐药(drug resistance):在抗病毒治疗过程中,检测到与HBV耐药相关的基因突变,称为基因型耐药(genotypic resistance)。体外实验显示,抗病毒药物敏感性降低,并与基因耐药相关,称为表型耐药(phenotypic resistance)。针对1种抗病毒药物出现的耐药突变对另外1种或几种抗病毒药物也出现耐药,称为交叉耐药(cross resistance)。至少对2种不同类别的NAs耐药,称为多重耐药(multidrug resistance)。
二、流行病学和预防
(一)流行病学
HBV感染呈世界性流行,但不同地区HBV感染的流行强度差异很大。据WHO报道,全球约有2.57亿慢性HBV感染者,非洲地区和西太平洋地区占68%[1]。全球每年约有88.7万人死于HBV感染相关疾病,其中肝硬化和原发性肝细胞癌(hepatocellular carcinoma)死亡分别占52%和38%。东南亚和西太平洋地区一般人群的HBsAg流行率分别为2%(3 900万例)和6.2%(1.15亿例)。亚洲HBV地方性流行程度各不相同,多数亚洲地区为中至高流行区,少数为低流行区。
2014年,中国疾病预防控制中心(Chinese Center for Disease Control and Prevention,CDC)对全国 1 ~ 29 岁人群乙型肝炎血清流行病学调查结果显示,1~4岁、5~14岁和15~29岁人群HBsAg流行率分别为0.32%、0.94%和 4.38%[2],与 1992 年比较,分别下降了 96.7%、91.2%和55.1%。据估计,目前我国一般人群HBsAg流行率为5%~6%,慢性HBV感染者约7 000万例,其中CHB患者约 2 000 万~ 3 000 万例[3]。
HBV经母婴、血液(包括皮肤和黏膜微小创伤)和性接触传播。在我国以母婴传播为主,占30%~50%[4],多发生在围生期,通过HBV阳性母亲的血液和体液传播。母亲的HBV DNA水平与新生儿感染HBV风险密切相关:HBeAg阳性、HBV DNA高水平母亲的新生儿更易发生母婴传播[5]。成人主要经血液和性接触传播。有注射毒品史、应用免疫抑制剂治疗的患者,既往有输血史、接受血液透析的患者,丙型肝炎病毒(hepatitis C virus,HCV)感染者、人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者、HBsAg阳性者的家庭成员、有接触血液或体液职业危险的卫生保健人员和公共安全工作人员、囚犯,以及未接种乙型肝炎疫苗的糖尿病患者等均有较高的HBV感染风险[6]。由于对献血员实施严格的HBsAg和HBV DNA筛查,采取安全注射措施,经输血或血液制品传播已较少发生。HBV也可经破损的皮肤或黏膜传播,如修足、文身、扎耳环孔、医务人员工作中的意外暴露、共用剃须刀和牙具等[6]。与HBV感染者发生无防护的性接触,特别是有多个性伴侣者、男男同性恋者,其感染HBV的危险性高[7]。
HBV不经呼吸道和消化道传播。因此,日常学习、工作或生活接触,如在同一办公室工作(包括共用计算机等)、握手、拥抱、同住一宿舍、同一餐厅用餐和共用厕所等无血液暴露的接触,不会传染HBV。流行病学和实验研究未发现HBV能经吸血昆虫(蚊和臭虫等)传播[8]。
(二)预防
1.保护易感人群:接种乙型肝炎疫苗是预防HBV感染最有效的方法。乙型肝炎疫苗的接种对象主要是新生儿,其次为婴幼儿[9],15岁以下未免疫人群和高危人群[7,10]。
乙型肝炎疫苗全程需接种3针,按照0、1和6个月的程序,即接种第1针疫苗后,在1个月和6个月时注射第2针和第3针。接种乙型肝炎疫苗越早越好。新生儿接种部位为上臂外侧三角肌或大腿前外侧中部肌内注射;儿童和成人为上臂三角肌中部肌内注射。患重症疾病的新生儿,如极低出生体质量儿、严重出生缺陷、重度窒息、呼吸窘迫综合征等,应在生命体征平稳后,尽早接种第1针乙型肝炎疫苗。
新生儿乙型肝炎疫苗的接种剂量:(1)重组酵母乙型肝炎疫苗每针次10 μg,不论母亲HBsAg阳性与否;(2)重组中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞乙型肝炎疫苗,每针次10 μg或20 μg,HBsAg阴性母亲的新生儿接种10 μg;HBsAg阳性母亲的新生儿接种20 μg。
对成人建议接种3针20 μg重组酵母乙型肝炎疫苗或20 μg重组CHO细胞乙型肝炎疫苗。对免疫功能低下或无应答者,应增加疫苗的接种剂量(如60 μg)和针次;对0、1和6个月程序无应答者可再接种1针60 μg或3针20 μg乙型肝炎疫苗,并于第2次接种乙型肝炎疫苗后1~2个月时检测血清抗-HBs,如仍无应答,可再接种1针60 μg重组酵母乙型肝炎疫苗。接种乙型肝炎疫苗后有抗体应答者的保护效果一般至少可持续30年[11],因此,一般人群不需要进行抗-HBs监测或加强免疫,但对高危人群或免疫功能低下者等可监测抗 -HBs,如抗 -HBs < 10 mIU/ml,可再次接种1针乙型肝炎疫苗[7]。
未感染过HBV的妇女在妊娠期间接种乙型肝炎疫苗是安全的[12-13];除按常规程序接种外,加速疫苗接种程序(0、1和2个月程序)已被证明是可行和有效的[14]。
意外暴露者是指其皮肤或黏膜接触HBsAg阳性或HBsAg不详患者的血液或体液,或被其污染的针头刺伤者。
2.管理传染源:对首次确定的HBsAg阳性者,如符合传染病报告标准的,应按规定向当地CDC报告,并建议对其家庭成员进行血清HBsAg、抗-HBs和抗-HBc检测,对易感者接种乙型肝炎疫苗。
HBV感染者的传染性高低主要取决于血液中HBV DNA水平,与血清ALT、天冬氨酸转氨酶(aspartate aminotransferase,AST)和胆红素水平无关。建议在不涉及入托、入学、入职的健康体格检查和医疗活动中,积极检测HBV感染标志物,以达到早期诊断、早期治疗、降低疾病危害的目的。对乙型肝炎患者和携带者的随访见本指南“十五、慢性HBV感染者的监测和随访管理”部分。慢性HBV感染者应避免与他人共用牙具、剃须刀、注射器及取血针等,禁止献血、捐献器官和捐献精子等,并定期接受医学随访。其家庭成员或性伴侣应尽早接种乙型肝炎疫苗。
3.切断传播途径:大力推广安全注射(包括取血针和针灸针等针具),并严格遵循医院感染管理中的标准预防(standard precaution)原则。服务行业所用的理发、刮脸、修脚、穿刺和文身等器具应严格消毒。若性伴侣为HBsAg阳性者,应接种乙型肝炎疫苗或采用安全套;在性伴侣的健康状况不明时,应使用安全套,以预防HBV和其他血源性或性传播疾病。对HBsAg阳性的孕妇,应尽量避免羊膜腔穿刺,保证胎盘的完整性,减少新生儿暴露于母血的机会。
推荐意见1:新生儿乙型肝炎疫苗预防
(1)对于HBsAg阴性母亲的新生儿,在出生12 h内尽早接种10 μg重组酵母乙型肝炎疫苗,在1月龄和6月龄时分别接种第2针和第3针乙型肝炎疫苗(A1)。
(2)对于HBsAg阳性母亲的新生儿,在出生12 h内尽早注射 100 IU 乙型肝炎免疫球蛋白(hepatitis B immunoglobulin,HBIG),同时在不同部位接种10 μg重组酵母乙型肝炎疫苗,并在1月龄和6月龄时分别接种第2针和第3针乙型肝炎疫苗。建议对HBsAg阳性母亲所生儿童,于接种第3针乙型肝炎疫苗后1~2个月时进行HBsAg和抗-HBs检测。若HBsAg阴性、抗 -HBs < 10 mIU/ml,可按 0、1 和 6 个月免疫程序再接种3针乙型肝炎疫苗;若HBsAg阳性,为免疫失败,应定期监测(A1)。
(3)对于HBsAg不详母亲所生早产儿、低体质量儿,在出生12 h内尽早接种第1针乙型肝炎疫苗和HBIG;满1月龄后,再按0、1和6个月程序完成3针乙型肝炎疫苗免疫(A1)。
(4)新生儿在出生12 h内接种乙型肝炎疫苗和HBIG后,可接受HBsAg阳性母亲的哺乳(B1)。
推荐意见2:对于未接种或未完成全程乙型肝炎疫苗免疫的儿童,应及时进行补种。第1针与第2针间隔时间应≥28 d,第2针与第3针间隔时间应≥60 d(A1)。
推荐意见3:对于免疫功能低下或无应答的成人,应增加疫苗接种剂量(如60 μg)和针次;对3针免疫程序无应答者,可再接种l针60 μg或3针20 μg乙型肝炎疫苗,并于第2次接种乙型肝炎疫苗后l~2个月时检测血清抗-HBs,如仍无应答,可再接种1针60 μg重组酵母乙型肝炎疫苗(A1)。
推荐意见4:意外暴露于HBV者可按照以下方法处理
(1)在伤口周围轻轻挤压,排出伤口中的血液,再对伤口用0.9% NaCl溶液冲洗,然后用消毒液处理(A1)。
(2)应立即检测HBV DNA、HBsAg,3~6个月后复查(A1)。
(3)如接种过乙型肝炎疫苗,且已知抗-HBs阳性(抗-HBs≥10 mIU/ml)者,可不进行处理。如未接种过乙型肝炎疫苗,或虽接种过乙型肝炎疫苗,但抗-HBs< 10 mIU/ ml或抗 -HBs水平不详者,应立即注射 HBIG 200~400 IU,同时在不同部位接种1针乙型肝炎疫苗(20 μg),于1个月和6个月后分别接种第2针和第3针乙型肝炎疫苗(20 μg)(A1)。
推荐意见5:鼓励在不涉及入托、入学和入职的健康体格检查中或就医时,进行HBsAg、抗-HBc和抗-HBs筛查;对高危人群、孕妇、接受抗肿瘤(化学治疗或放射治疗)或免疫抑制剂或直接抗HCV药物治疗者、HIV感染者,筛查HBsAg、抗-HBc和抗-HBs,对均阴性者,建议接种乙型肝炎疫苗(B1)。
三、病原学
HBV属嗜肝DNA病毒科(hepadnaviridae),是有包膜的DNA病毒,基因组长约3.2 kb,为部分双链环状DNA。其基因组编码HBsAg、HBcAg、HBeAg、病毒聚合酶和HBx蛋白。HBV的抵抗力较强,但65℃中10 h、煮沸10 min或高压蒸气均可灭活HBV。环氧乙烷、戊二醛、过氧乙酸和碘伏对HBV也有较好的灭活效果。
HBV通过肝细胞膜上的钠离子-牛磺胆酸-协同转运蛋 白(sodium taurocholate cotransporting polypeptide,NTCP)作为受体进入肝细胞[15]。侵入肝细胞后,部分双链环状HBV DNA在细胞核内以负链DNA为模板,延长正链以修补正链中的裂隙区,形成共价闭合环状DNA(covalently closed circular DNA,cccDNA)。cccDNA半寿(衰)期较长,难以从体内彻底清除,对慢性感染起重要作用。HBV可以整合入宿主基因。HBV以cccDNA为模板,转录成几种不同长度的mRNA。其中,3.5 kb大小的前基因组RNA(pregenome RNA,pgRNA)可释放入外周血,血清HBV RNA水平可反映肝组织内cccDNA的活性,并可能与患者病毒学应答和预后有关[16-18]。HBV至少有9个基因型(A型至I型)[19]。我国以B基因型和C基因型为主。B型和C型HBV感染者的母婴传播发生率高于其他基因型,C型与较早进展为肝细胞癌相关。HBV基因型与疾病进展和干扰素-α治疗应答有关[20-22]。HBeAg阳性患者对干扰素-α治疗的应答率,B基因型高于C基因型,A基因型高于D基因型[23]。
四、自然史及发病机制
(一)自然史
HBV感染的自然史主要取决于病毒和宿主相互作用,其中HBV感染时的年龄是影响慢性化的主要因素之一。新生儿及1岁以下婴幼儿的HBV感染慢性化风险为90%[24],我国HBV感染者多为围生期或婴幼儿时期感染。HBV母婴阻断在全球取得了巨大成功[25]。我国对HBsAg阳性母亲的新生儿已全面推广联合免疫(乙型肝炎疫苗联合HBIG)等措施,但仍有约5%~7%新生儿发生母婴传播,其中HBeAg阳性孕妇中为7%~11%,HBeAg阴性孕妇中为0 ~ 1%[26-27]。
慢性HBV感染的自然史根据自然病程一般可划分为4个期[28-30],即免疫耐受期(慢性HBV携带状态)、免疫清除期(HBeAg阳性CHB)、免疫控制期(非活动HBsAg携带状态)和再活动期(HBeAg阴性CHB),见表2(详见“九、临床诊断”部分)。并非所有慢性HBV感染者都经过以上4个期。青少年和成年时期感染HBV,多无免疫耐受期,直接进入免疫清除期。
免疫清除期患者可出现自发性HBeAg血清学转换,年发生率约为2%~15%。年龄< 40岁、ALT升高、HBV A基因型和B基因型者的发生率较高[28,31]。HBeAg血清学转换后,每年约有0.5%~1.0%发生HBsAg清除[32]。研究显示,HBsAg消失10年后,约14%的患者肝脏中仍可检测出cccDNA[33]。> 50岁,或已有肝硬化,或合并HCV或丁型肝炎病毒(hepatitis D virus,HDV)感染者,即使HBsAg消失,仍有可能发生肝细胞癌,但发生率较低[34]。
未经抗病毒治疗CHB患者的肝硬化年发生率为2%~10%[35],危险因素包括宿主(年龄较大、男性、发生HBeAg血清学转换时> 40岁、ALT持续升高[36-37]),病毒(HBV DNA > 2 000 IU/ml),HBeAg 持续阳性[38],C基因型,合并HCV、HDV或HIV感染,以及合并其他肝损伤因素(如嗜酒或肥胖等)[35]。代偿期肝硬化进展为失代偿期的年发生率为3%~5%,失代偿期肝硬化5年生存率为14%~35%[35]。非肝硬化HBV感染者的肝细胞癌年发生率为0.5%~1.0%[35]。肝硬化患者肝细胞癌年发生率为3%~6%[39-41]。肝硬化、合并糖尿病、直系亲属中有肝癌者、血清HBsAg高水平、接触黄曲霉毒素等均与肝癌高发相关[35,42-46]。较低的HBsAg水平常反映宿主对HBV复制和感染具有较好的免疫控制能力。研究显示,即使HBeAg阴性、HBV DNA低水平,不论B基因型还是C基因型,HBsAg水平较高(≥1 000 IU/ml)者发生肝细胞癌的风险仍较高[45-46]。
(二)发病机制
慢性HBV感染的发病机制较为复杂,迄今尚未完全阐明。HBV不直接杀伤肝细胞,病毒引起的免疫应答是导致肝细胞损伤及炎症坏死的主要机制,而炎症坏死持续存在或反复出现是慢性HBV感染者进展为肝硬化甚至肝癌的重要因素。
非特异性(固有)免疫应答在HBV感染初期发挥重要作用,它启动后续特异性(适应性)免疫应答[47-48]。HBV可依托自身HBeAg、HBx等多种蛋白质成分,干扰Toll样受体(Toll-like receptors,TLRs)、维甲酸诱导基因Ⅰ(retinoic acid inducible gene-Ⅰ,RIG-Ⅰ)两种抗病毒信号转导途径,从而抑制非特异性免疫应答的强度。CHB患者常表现为外周血中髓样树突状细胞(myeloid dendritic cell, mDC)和浆样树突状细胞(plasmacytoid dendritic cell,pDC)频数降低,且mDC成熟障碍,pDC产生干扰素-α能力明显降低,从而导致机体直接清除病毒和诱生HBV特异性T细胞的能力下降,不利于病毒清除。
HBV特异性免疫应答在清除HBV中起主要作用[49]。主要组织相容性复合物(major histocompatibility complex,MHC)Ⅰ类分子限制性的CD8+细胞毒性T淋巴细胞可诱导病毒感染肝细胞凋亡,也可通过分泌干扰素-γ,以非细胞溶解机制抑制肝细胞内的HBV基因表达和复制[50]。慢性感染时,HBV特异性T细胞易凋亡,产生细胞因子和增殖能力均显著降低,功能耗竭,可能是导致HBV持续感染的机制之一[51]。目前认为血清和肝组织中存在大量HBsAg,而HBsAg特异性细胞毒性T淋巴细胞数量缺乏和/或功能不足,是导致慢性HBV感染者发生免疫耐受的重要原因[52]。
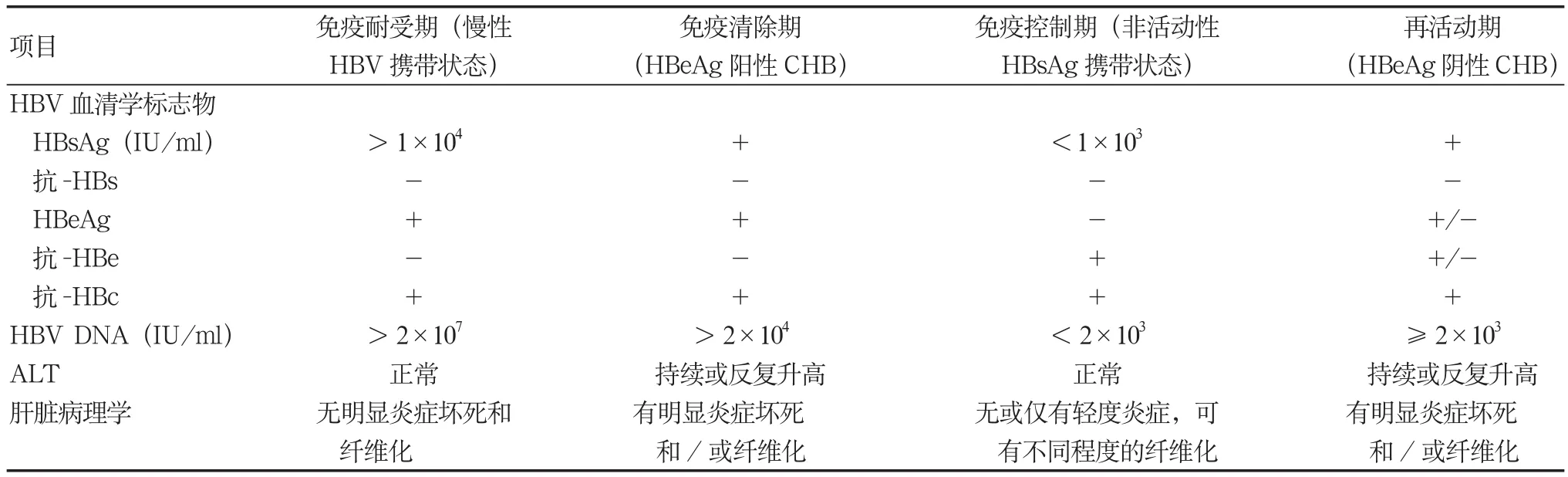
表2 慢性HBV感染自然病程分期
五、实验室检查
(一)HBV血清学检测
传统HBV血清学标志物包括HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc和抗-HBc IgM。血清HBsAg可由cccDNA转录为mRNA翻译产生,也可由整合人宿主基因组的HBV DNA序列转录翻译而来,HBsAg阳性表示HBV感染。抗-HBs为保护性抗体,阳性表示具备HBV免疫力,见于乙型肝炎康复期及接种乙型肝炎疫苗者;抗-HBc IgM阳性多见于急性乙型肝炎,慢性HBV感染急性发作多表现为低水平阳性;抗-HBc总抗体主要是抗-HBc IgG,只要感染过HBV,不论病毒是否被清除,此抗体多为阳性。
近年来,HBsAg定量检测已在临床中被广泛应用,其水平可反映疾病分期与疾病进展风险,也可用于指导重组人干扰素和聚乙二醇干扰素-α(peginterferon-α,Peg-IFN-α)治疗。
(二)HBV病毒学检测
1.HBV DNA定量:主要用于评估HBV感染者病毒复制水平,是抗病毒治疗适应证选择及疗效判断的重要指标。在抗病毒治疗过程中,获得持续病毒学应答可显著控制肝硬化进展和降低肝细胞癌发生风险[53-54]。HBV DNA定量采用实时定量聚合酶链反应法,检测下限值因不同生产厂商的试剂而异。
2.HBV基因分型:目前可鉴定出至少9种(A型至I型)HBV基因型和1种未定基因型(J型),一些基因型可分数种基因亚型。检测HBV基因型有助于预测干扰素疗效,判断疾病预后[55-58]。
3.耐药突变株检测:HBV是一个高变异的病毒,在反转录复制过程中,因RNA聚合酶和反转录酶缺乏校正功能,可使病毒在复制过程中发生一个或多个核苷酸的变异。HBV可以在慢性持续性感染过程中自然变异,也可因抗病毒药物治疗诱导病毒变异,均可导致对抗病毒药物敏感性下降[59]。及时进行耐药突变株检测有助于临床医师判断耐药发生并尽早调整治疗方案。目前,临床常用的耐药检测方法包括反转录酶(reverse transcriptase)区序列测定和线性探针反向杂交法(INNO-LIPA试剂盒)。
(三)HBV新型标志物检测
1抗-HBc抗体定量:新型双抗原夹心法可定量检测血清抗-HBc水平。在自然史研究中,免疫清除期和再活动期患者抗-HBc定量水平显著高于免疫耐受期和低复制期[60-61]。HBeAg阳性CHB患者基线抗-HBc定量水平可预测Peg-IFN-α和NAs的疗效[62-63]。此外,抗-HBc定量水平和ALT水平呈明显正相关;尤其在ALT正常患者,抗-HBc定量水平和肝脏组织学炎症坏死程度呈显著正相关[64]。
2.HBV RNA定量:与肝细胞内cccDNA转录活性有关,在评估NAs停药后复发风险方面值得深入研究[65-66]。目前存在的局限性在于不同研究团队采用的检测方法不完全相同。
3.乙型肝炎病毒核心相关抗原(hepatitis B corerelated antigen,HBcrAg):是一种包含 HBcAg、HBeAg、p22蛋白质的复合标志物,与肝细胞内cccDNA转录活性有关,在区分疾病分期、预测Peg-IFN-α和NAs抗病毒疗效,以及停药后复发、预测肝细胞癌发生风险等方面均有相关研究[67-70]。
(四)血清生物化学检查[71]
1.ALT和AST:可在一定程度上反映肝细胞损伤程度,特别是长期病毒抑制患者ALT升高,应进一步分析评估原因[72]。
2.总胆红素:与胆红素生成、摄取、代谢和排泄有关,升高的主要原因为肝细胞损伤、肝内外胆管阻塞、胆红素代谢异常和溶血。肝衰竭患者总胆红素可> 171 μmol/L,或每天上升 > 17.1 μmol/L。
3.血清白蛋白:反映肝脏合成功能,肝硬化和肝衰竭患者可有血清白蛋白水平下降。白蛋白水平同时也受到营养状况等的影响。
4.凝血酶原活动时间(prothrombin activity time,PT)、凝血酶原活动度(prothrombin activity,PTA)及国际标准化比值(international normalized ratio,INR):反映肝脏凝血因子合成功能,对判断疾病进展及预后有重要价值。
5.血清γ-谷氨酰转移酶(γ-glutamyl transferase,GGT):正常人血清中GGT主要来自肝脏,酒精性肝病、药物性肝病、胆管炎并肝内外胆汁淤积时可显著升高。
6.血清碱性磷酸酶(alkaline phosphatase,ALP):缺乏肝脏特异性,胆汁淤积刺激ALP合成,其升高的肝源性需通过GGT或ALP同工酶水平升高加以确认。临床上常借助ALP的动态观察来判断病情发展、预后和疗效评估。
7.甲胎蛋白及其异质体L3:是诊断肝细胞癌的重要指标。应注意甲胎蛋白升高的幅度、动态变化,以及其与ALT和AST的消长关系,并结合临床表现和肝脏影像学检查结果进行综合分析[73]。
8.维生素K缺乏或拮抗剂-Ⅱ诱导蛋白(protein induced by vitamin K absence or antagonist-II,PIVKA-Ⅱ):又名脱γ羧基凝血酶原(des-γcarboxy prothrombin,DCP),是诊断肝癌的另一个重要指标,可与甲胎蛋白互为补充[74]。
六、肝纤维化无创诊断技术
(一)天冬氨酸转氨酶和血小板比率指数(aspartate aminotransferase to platelet ratio index,APRI)评分
APRI是基于慢性HCV感染者数据研发的用于评估HCV相关肝纤维化程度的指标。计算公式:[AST/AST的正常值上限(upper limit of normal,ULN)×100]/ 血小板计数(×109/L),成人APRI≥2提示存在肝硬化,APRI < 1则排除肝硬化。但近期研究提示,该指数用于评估HBV相关肝纤维化程度的准确性较低[75-77]。
(二)肝纤维化4因子指数(fibrosis 4 score,FIB-4)
FIB-4是基于慢性HCV感染者数据研发的,用于评估HCV相关肝纤维化程度的指标。计算公式:FIB-4≥3.25诊断肝纤维化和肝脏炎症分级Metavir评分≥ F3,FIB-4 < 1.45 排除 Metavir评分≥ F3。近期研究提示,慢性HBV感染者以FIB-4≥3.25诊断Metavir评分≥F3的特异度为97%[76],> 30岁人群中FIB-4≤0.70排除乙型肝炎肝硬化的阴性预测值高达96%[78]。
(三)其他指标
细胞外基质成分如透明质酸、Ⅲ型前胶原肽、Ⅳ型胶原、层黏连蛋白等均可反映肝纤维化发生情况,但尚缺乏可供临床应用的统一诊断界值。γ-谷氨酰转移酶-血小板比值[γ glutamyl transpeptidase to platelet ratio,GPR ;GGT/GGT的ULN/血小板计数(×109/L)×100]、红细胞体积分布宽度 -血小板比值 [red cell distribution width to platelet ratio,RPR;红细胞体积分布宽度(%)/血小板计数(×109/L)]均由常规检测指标组成,稳定的诊断界值仍待确定[79-80]。血清高尔基体蛋白73(Golgi glycoprotein,GP73)联合AST及GGT可反映中、重度肝脏炎症[81]。血清壳多糖酶 3样蛋白 1(chitinase 3-like 1,CHI3L1或YKL-40)可预测ALT正常或轻度升高患者的中、重度肝脏纤维化[82-83]。
(四)肝脏硬度值测定
肝脏硬度值测定包括瞬时弹性成像(transient elastography,TE)、基于超声的声脉冲辐射力学(acoustic radiation force impulse,ARFI)和磁共振弹性成像(magnetic resonance elastography,MRE)。ARFI包括点剪切波弹性成像(point shear wave elastography,p-SWE)和二维剪切波弹性成像(2D shear wave elastography,2D-SWE)2种技术,ARFI、MRE技术仍然处于临床研究阶段。
TE已在美国、欧洲和亚太等地区与国家获得批准应用,能够比较准确地识别进展期肝纤维化及早期肝硬化[84-85],但测定值受肝脏炎症坏死、胆汁淤积和重度脂肪变等多种因素影响,TE结果判读需结合患者ALT及胆红素水平等指标[86-88]。TE与其他血清学指标联合使用可提高诊断效能[84,89-91]。我国多中心研究建议乙型肝炎肝硬化诊断界值为21.3 kPa(特异度为95%,阳性似然比为8.5),进展期肝纤维化诊断界值为12.4 kPa(特异度为95%,阳性似然比为11.8),显著肝纤维化诊断界值为9.1 kPa(特异度为95%,阳性似然比为6.4);肝硬化排除界值为8.2 kPa(灵敏度为95%,阳性似然比为0.07),进展期肝纤维化排除界值为5.8 kPa(灵敏度为95%,阳性似然比为0.10)[92]。TE的临床应用指导参见《瞬时弹性成像技术诊断肝纤维化专家共识(2018年更新版)》[85]。
七、影像学诊断
影像学检查的主要目的是监测慢性HBV感染的临床疾病进展,包括了解有无肝硬化及门静脉高压征象,发现占位性病变并鉴别其性质,通过动态监测及时发现和诊断肝细胞癌[93-94]。
(一)腹部超声检查
腹部超声检查无创、价廉、实时显像,便于反复进行,为最常用的肝脏影像学检查方法。可以观察肝脏和脾脏的大小、外形、实质回声,并能测定门静脉、脾静脉和肝静脉内径及血流情况,以及有无腹水及其严重程度,从而判断有无肝硬化及门静脉高压;能有效发现肝内占位性病变,对于监测和发现早期肝细胞癌至关重要。超声造影能更好地鉴别占位病变的性质。其局限性是图像质量和检查结果易受设备性能、患者胃肠道内气体和操作者技术水平等因素影响。
(二)电子计算机断层扫描(computed tomography,CT)
CT主要用于观察肝脏形态,了解有无肝硬化,发现占位性病变并鉴别其性质;动态增强多期CT扫描对于肝细胞癌的诊断具有较高的灵敏性和特异性。
(三)磁共振成像(magnetic resnane iamge,MRI)
MRI无放射性辐射,组织分辨率高,多方位、多序列成像,是非常有效的肝脏影像学检查。一般认为,动态增强多期MRI扫描及肝脏细胞特异性增强剂显像对鉴别良、恶性肝内占位性病变的能力优于增强CT。
八、病理学诊断
慢性HBV感染者肝组织检查的主要目的是评价肝脏炎症坏死及纤维化程度、明确有无肝硬化并排除其他肝脏疾病,从而为确定诊断、判断预后、启动治疗和监测疗效提供客观依据。
CHB的主要病理学特点是肝脏汇管区及其周围不同程度的炎症坏死和纤维化。汇管区浸润的炎症细胞以淋巴细胞为主,也可有少数浆细胞和巨噬细胞;炎症细胞聚集常引起界板破坏而形成界面炎(旧称碎屑样坏死)。小叶内有肝细胞变性、坏死(包括点灶、桥接、融合性坏死)和凋亡,并可见磨玻璃样肝细胞及凋亡肝细胞形成的凋亡小体,且随炎症病变活动而愈加显著。慢性肝脏炎症坏死可引起细胞外基质特别是胶原的过度沉积即纤维化,表现为不同程度的汇管区纤维性扩大、纤维间隔形成,Masson三色染色及网状纤维染色有助于判断肝纤维化程度及肝小叶结构。在弥漫性肝纤维化的基础上,一旦肝细胞结节性再生形成假小叶,即称为肝硬化。另外,免疫组织化学染色可检测肝组织内HBsAg和HBcAg的表达;核酸原位杂交法或PCR法可检测组织内HBV DNA或cccDNA。
对于慢性HBV感染者的肝组织炎症坏死分级和纤维化分期,国际文献中常采用Knodell、Scheuer,Metavir或Ishak评分系统[95-98]。Laennec肝硬化分级根据再生结节大小和纤维间隔宽度,将肝硬化(Metavir 4)细分为4A、4B和4C三级[99]。我国学者也提出了病毒性肝炎的组织病理学分级及分期标准[100]。各种分级及分期系统比较见表3和4。
利用计算机图像分析可以测定肝组织胶原染色切片的胶原面积比(collagen proportional area,CPA)。基于双光子二次谐波技术的纤维化定量技术(qFibrosis)可以在未经染色的肝组织切片中对胶原面积及其形态特征进行自动化定量分析,可重复性及准确性较高[101]。最近我国学者在国际上首次提出了肝纤维化P-I-R分类,根据纤维间隔的宽度及形态,将Ishak 3期以上肝纤维化分为进展为主型(P)、中间型(I)和逆转为主型(R),有助于判断肝纤维化的变化趋势[102]。
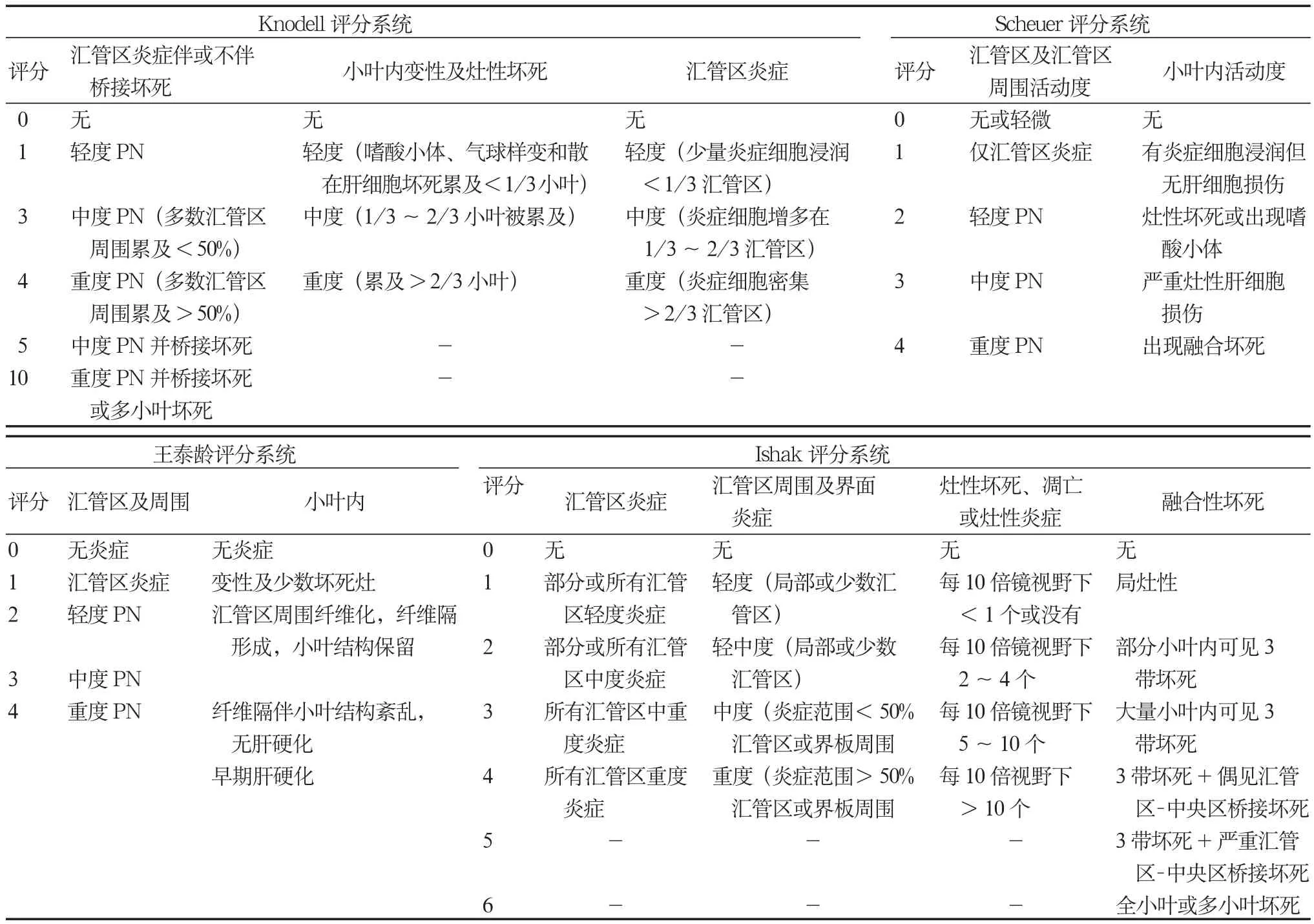
表3 不同肝脏炎症分级标准对照表
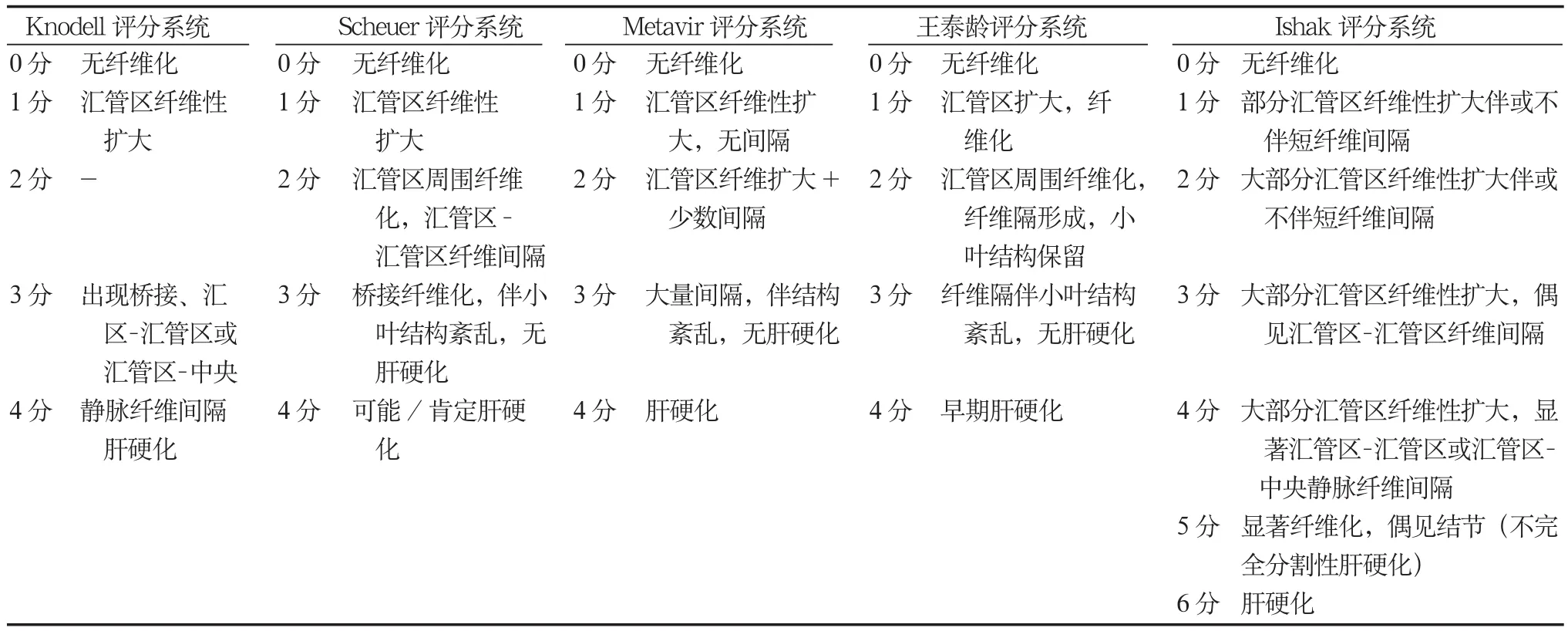
表4 国内外肝纤维化分期标准对照表
九、临床诊断
根据慢性HBV感染者的血清学、病毒学、生物化学、影像学、病理学和其他辅助检查结果,在临床上可分为以下几种诊断:
(一)慢性HBV携带状态
又称HBeAg阳性慢性HBV感染[103-104]。本期患者处于免疫耐受期,患者年龄较轻,HBV DNA定量水平(通常> 2×107IU/ml)较高,血清 HBsAg(通常 > 1×104IU/ml)较高、HBeAg阳性,但血清ALT和AST持续正常(1年内连续随访3次,每次至少间隔3个月),肝脏组织病理学检查无明显炎症坏死或纤维化。在未行组织病理学检查的情况下,应结合年龄、病毒水平、HBsAg水平、肝纤维化无创检查和影像学检查等综合判定。
(二)HBeAg阳性CHB
本期患者处于免疫清除期,其血清HBsAg阳性,HBeAg阳性,HBV DNA 定量水平(通常> 2×104IU/ml)较高,ALT持续或反复异常或肝组织学检查有明显炎症坏死和/或纤维化(≥G2/S2)。
(三)非活动性HBsAg携带状态[105-106]
又称HBeAg阴性慢性HBV感染。本期患者处于免疫控制期,表现为血清HBsAg阳性、HBeAg阴性、抗-HBe阳性,HBV DNA < 2 000 IU/ml,HBsAg < 1 000 IU/ml,ALT和AST持续正常(1年内连续随访3次以上,每次至少间隔3个月),影像学检查无肝硬化征象,肝组织检查显示组织活动指数(histological activity index,HAI)评分< 4或根据其他半定量计分系统判定病变轻微。
(四)HBeAg阴性CHB
此期为再活动期,其血清HBsAg阳性、HBeAg持续阴性,多同时伴有抗-HBe阳性,HBV DNA定量水平通常≥2 000 IU/ml,ALT持续或反复异常,或肝组织学有明显炎症坏死和/或纤维化(≥G2/S2)。
(五)隐匿性 HBV 感染(occult hepatitis B virus infection,OBI)[107]
表现为血清HBsAg阴性,但血清和/或肝组织中HBV DNA阳性。在OBI患者中,80%可有血清抗-HBs、抗-HBe和/或抗-HBc阳性,称为血清阳性OBI;但有1%~20%的OBI患者所有血清学指标均为阴性,故称为血清阴性OBI。其发生机制尚未完全阐明,一种可能是显性(急性或慢性)HBV感染后HBsAg消失,通常其血清或肝组织HBV DNA水平很低,无明显肝组织损伤;另一种是HBV S区基因变异,导致HBsAg不能被现有商品化试剂盒检测到,其血清HBV DNA水平通常较高,可能伴有明显肝脏组织病理学改变。此类患者可通过输血或器官移植将HBV传播给受者,其自身在免疫抑制状态下可发生HBV再激活。
(六)乙型肝炎肝硬化[108-109]
乙型肝炎肝硬化的诊断应符合下列1和2(病理学诊断),或1和3(临床诊断)。
1.目前HBsAg阳性,或HBsAg阴性、抗-HBc阳性且有明确的慢性HBV感染史(既往HBsAg阳性> 6个月),并除外其他病因者。
2.肝脏活组织检查病理学符合肝硬化表现者。
3.符合以下5项中的2项及以上,并除外非肝硬化性门静脉高压者:(1)影像学检查显示肝硬化和/或门静脉高压征象;(2)内镜检查显示食管胃底静脉曲张;(3)肝脏硬度值测定符合肝硬化;(4)血生物化学检查显示白蛋白水平降低(< 35 g/L)和 / 或 PT 延长(较对照延长 > 3 s);(5)血常规检查显示血小板计数< 100×109/L等。
临床上常根据是否曾出现腹水、食管胃底静脉曲张破裂出血和肝性脑病等严重并发症,将肝硬化分为代偿期及失代偿期。(1)代偿期肝硬化:病理学或临床诊断为肝硬化,但从未出现腹水、食管胃底静脉曲张破裂出血或肝性脑病等严重并发症者,可诊断为代偿期肝硬化;其肝功能多为Child-Pugh A级。(2)失代偿期肝硬化:肝硬化患者一旦出现腹水、食管胃底曲张静脉破裂出血或肝性脑病等严重并发症者,即诊断为失代偿期肝硬化[110];其肝功能多属于Child-Pugh B级或C级。
近年,为更准确地预测肝硬化患者的疾病进展、死亡风险或治疗效果,有学者建议将肝硬化分为5期[111],其中1、2期为代偿期肝硬化,3期至5期为失代偿期肝硬化。1期为无静脉曲张,无腹水;2期为有静脉曲张,无出血或腹水;3期为有腹水,无出血,伴或不伴静脉曲张;4期为有出血,伴或不伴腹水;5期为出现脓毒症。
随着抗病毒药物的进步,许多失代偿期肝硬化患者经过治疗可以逆转为代偿期肝硬化。表现为肝细胞功能改善如白蛋白水平较前升高,PT较前缩短,不再出现腹水、肝性脑病等严重并发症,不需要肝移植也可长期存活。这些现象被称为肝硬化再代偿期(re-compensation),但目前尚无准确定义和统一的诊断标准。
十、治疗目标
最大限度地长期抑制HBV复制[6,112-113],减轻肝细胞炎症坏死及肝脏纤维组织增生,延缓和减少肝功能衰竭、肝硬化失代偿、肝细胞癌和其他并发症的发生,改善患者生活质量,延长其生存时间。
对于部分适合条件的患者,应追求临床治愈。
临床治愈(或功能性治愈)[6,112,114-116]:停止治疗后仍保持HBsAg阴性(伴或不伴抗-HBs出现)、HBV DNA检测不到、肝脏生物化学指标正常。但因患者肝细胞核内cccDNA未被清除,因此存在HBV再激活和发生肝细胞癌的风险。
十一、抗病毒治疗的适应证
依据血清HBV DNA、ALT水平和肝脏疾病严重程度,同时需结合年龄、家族史和伴随疾病等因素,综合评估患者疾病进展风险,决定是否需要启动抗病毒治疗[6,112-113];动态评估比单次检测更有临床意义;见图1。
血清HBV DNA阳性的慢性HBV感染者,若其ALT持续异常(> ULN)且排除其他原因导致的ALT升高,建议抗病毒治疗。
导致ALT升高的其他原因包括:其他病原体感染、药物性肝损伤、酒精性肝炎、非酒精性脂肪性肝炎、自身免疫性肝病、全身系统性疾病累及肝脏等。同时,也应注意排除应用降酶药物后ALT的暂时性正常。
存在肝硬化的客观依据,不论ALT和HBeAg状态,只要可检测到HBV DNA,均应进行积极的抗病毒治疗。对于失代偿期肝硬化者,若HBV DNA检测不到但HBsAg阳性,建议抗病毒治疗。
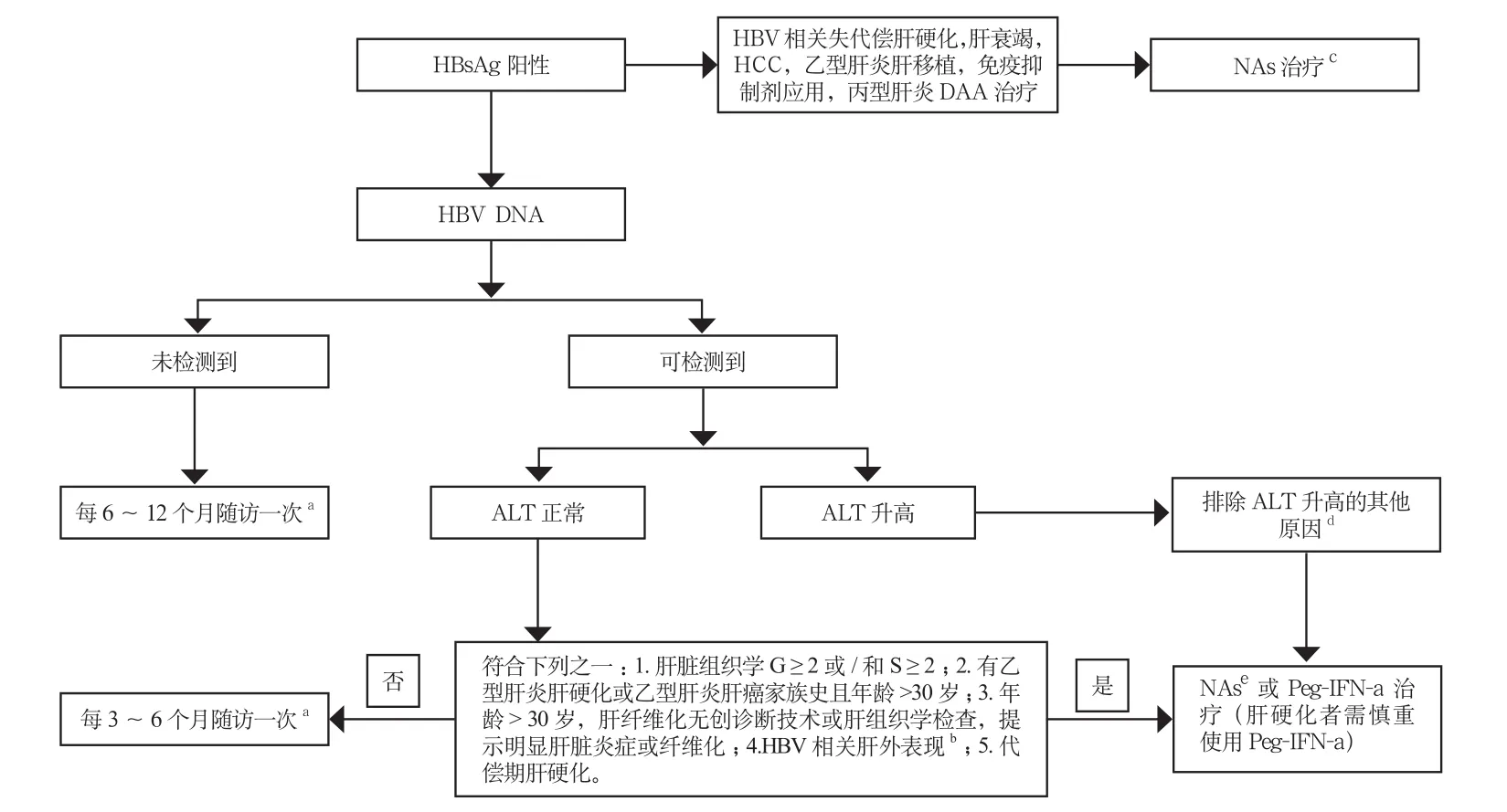
图1 慢性HBV感染抗病毒治疗适应证的选择流程图
血清HBV DNA阳性、ALT正常患者,如有以下情形之一,则疾病进展风险较大,建议抗病毒治疗:(1)肝组织学显示明显的肝脏炎症(≥G2)或纤维化(≥S2);(2)ALT 持续正常(每3个月检查1次,持续12个月),但有肝硬化/肝癌家族史且年龄> 30岁;(3)ALT 持续正常(每3个月检查1次,持续12个月),无肝硬化/肝癌家族史但年龄> 30岁,建议肝纤维化无创诊断技术检查或肝组织学检查,存在明显肝脏炎症或纤维化;(4)有HBV相关的肝外表现(肾小球肾炎、血管炎、结节性多动脉炎、周围神经病变等)。
推荐意见6:血清HBV DNA阳性、ALT持续异常(>ULN)且排除其他原因所致者,建议抗病毒治疗(B1)。
推荐意见7:对于血清HBV DNA阳性的代偿期乙型肝炎肝硬化患者和HBsAg阳性失代偿期乙型肝炎肝硬化患者,建议抗病毒治疗(A1)。
推荐意见8:血清HBV DNA阳性、ALT正常,有下列情况之一者建议抗病毒治疗。① 肝组织学检查提示明显炎症和/或纤维化[G≥2和/或S≥2](A1)。② 有乙型肝炎肝硬化或乙型肝炎肝癌家族史且年龄> 30岁(B1)。③ALT 持续正常、年龄> 30岁者,建议肝纤维化无创诊断技术检查或肝组织学检查,存在明显肝脏炎症或纤维化(A1)。④ HBV相关肝外表现(如HBV相关性肾小球肾炎等)(B1)。
十二、NAs治疗
(一)NAs药物的疗效和安全性
1.恩替卡韦(entecavir):大量研究数据显示,采用恩替卡韦治疗可强效抑制病毒复制,改善肝脏炎症,安全性较好[117-119],长期治疗可改善乙型肝炎肝硬化患者的组织学病变[120-121],显著降低肝硬化并发症和肝细胞癌的发生率,降低肝脏相关和全因病死率[53,122]。
在初治CHB患者中,恩替卡韦治疗5年的累积耐药发生率为1.2%;在拉米夫定(lamivudine)耐药的CHB患者中,恩替卡韦治疗5年的累积耐药发生率升至51%[123]。
2.富马酸替诺福韦酯(tenofovir disoproxil fumarate,TDF):应用TDF治疗CHB患者的多中心临床研究结果显示,可强效抑制病毒复制,耐药发生率低[124-125]。采用TDF治疗8年的研究数据显示,共有41例次病毒学突破,其中29例次(70%)的原因是依从性问题,59%发生病毒学突破的患者继续TDF治疗仍然获得病毒学应答,进一步的核酸序列测定未发现TDF相关的耐药[126]。TDF长期治疗显著改善肝脏组织学,降低肝细胞癌发生率[127-128]。
恩替卡韦耐药且血清中 HBV DNA>60IU/ml的 90例CHB患者,按照1∶1比例随机接受TDF单独或联合恩替卡韦治疗48周,TDF单独或联合恩替卡韦治疗组的HBV DNA阴转(<15IU/ml)率分别为73%和71%,HBV DNA 较基线分别下降 3.66lgIU/ml和 3.74lgIU/ml,分别有6例和3例患者仍保持了基线的耐药,两组安全性良好[129]。多项TDF治疗NAs经治患者的48~168周的研究显示,TDF用于拉米夫定耐药、阿德福韦酯(adefovir dipivoxil,ADV)耐药、恩替卡韦耐药或多药耐药患者的治疗,均可获得70%~98%的病毒学应答,且随着治疗时间的延长,病毒学应答率逐渐升高[129-139]。
3.富马酸丙酚替诺福韦片(tenofovir alafenamide fumarate tablets,TAF):全球Ⅲ期临床试验中,581例HBeAg阳性CHB患者(不包括失代偿期肝硬化)接受TAF 治疗 48 周,64% 的患者 HBV DNA<9IU/ml,ALT复常率为72%;10%发生HBeAg血清学转换,HBsAg消失率为1%;继续治疗至96周,73%的患者HBV DNA<29 IU/ml,ALT 复常率为 75% ;HBeAg 血清学转换率增至18%,HBsAg消失率为1%。285例HBeAg阴性CHB患者(不包括失代偿期肝硬化)接受TAF治疗48周,94% 的患者 HBV DNA<29IU/ml,ALT 复常率为 83%,HBsAg血清消失率为0;继续治疗至96周,90%患者HBV DNA<29 IU/ml,ALT 复常率为 81%,HBsAg 血清消失率<1%[140-142]。
96周治疗期间,头痛(12%)、恶心(6%)和疲劳(6%)是最常见的不良事件[142]。TAF治疗96周后髋关节、腰椎的骨密度下降值(-0.33%、-0.75%)低于 TDF(-2.51%、-2.57%),两者间差异有统计学意义(P<0.001);TAF 治疗后估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)下降的中位值也低于TDF(-1.2 mg/dl比 -4.8 mg/dl,P<0.001)[142]。
4.其他药物:替比夫定(telbivudine)可改善eGFR,但总体耐药率仍偏高[113]。替比夫定在阻断母婴传播中具有良好的效果和安全性(详见“特殊人群抗病毒治疗推荐意见”部分)。
(二)NAs的选择
初治患者应首选强效低耐药药物(恩替卡韦、TDF、TAF)治疗。不建议ADV和拉米夫定用于HBV感染者的抗病毒治疗。
正在应用非首选药物治疗的患者,建议换用强效低耐药药物,以进一步降低耐药风险。应用ADV者,建议换用恩替卡韦、TDF或TAF;应用拉米夫定或替比夫定者,建议换用TDF、TAF或恩替卡韦;曾有拉米夫定或替比夫定耐药者,换用TDF或TAF;曾有ADV耐药者换用恩替卡韦、TDF或TAF[143];联合ADV和拉米夫定/替比夫定治疗者,换用TDF或TAF。
(三)NAs耐药的预防和处理
1.初始治疗患者:强调选择强效低耐药药物,推荐恩替卡韦、TDF、TAF。
2.治疗中:定期检测HBV DNA定量,以便及时发现病毒学突破,并尽早给予挽救治疗(表5)。对于NAs发生耐药者,改用干扰素-α类联合治疗的应答率较低。

表5 核苷(酸)类似物耐药挽救治疗推荐
(四)NAs治疗的监测
1.治疗前相关指标基线检测:(1)生物化学指标主要有ALT、AST、胆红素、白蛋白等;(2)病毒学和血清学标志物主要有HBV DNA定量和HBsAg、HBeAg、抗-HBe;(3)根据病情需要,检测血常规、血清肌酐水平、血磷水平、肾小管功能等;(4)肝脏无创纤维化检测如肝脏硬度值测定;(5)当恩替卡韦和TDF用于肌酐清除率<50 ml/min患者时均需调整剂量;TAF用于肌酐清除率<15 ml/min且未接受透析的患者时无推荐剂量;其余情况均无需调整剂量。
2.密切关注患者治疗依从性问题: 包括用药剂量、使用方法、是否有漏用药物或自行停药等情况,确保患者已经了解随意停药可能导致的风险,提高患者依从性。
3.少见或罕见不良反应的预防和处理:NAs总体安全性和耐受性良好,但在临床应用中仍有少见、罕见严重不良反应的发生,如肾功能不全(服用TDF、ADV)、低磷性骨病(服用TDF、ADV)、肌炎/横纹肌溶解(服用替比夫定)、乳酸酸中毒等(服用恩替卡韦、替比夫定),应引起关注。建议治疗前仔细询问相关病史,以降低风险。对治疗中出现血肌酐、肌酸激酶或乳酸脱氢酶水平明显升高,并伴相应临床表现如全身情况变差、肌痛、肌无力、骨痛等症状的患者,应密切观察,一旦确诊为肾功能不全、肌炎、横纹肌溶解、乳酸酸中毒等,应及时停药并改用其他药物,同时给予积极的相应治疗干预。
4.耐药监测及处理:随着强效低耐药药物的应用,NAs长期治疗出现耐药发生率大幅降低。如果在治疗过程中出现 HBV DNA 定量较治疗中最低值升高>2lgIU/ml,排除依从性问题后,需及时给予挽救治疗,并进行耐药检测。
十三、干扰素-α治疗
我国已批准Peg-IFN-α和干扰素-α用于治疗。
(一)Peg-IFN-α治疗的方案及疗效
1.Peg-IFN-α初治单药治疗:多项多中心、随机、对照临床试验显示,HBeAg阳性CHB患者采用Peg-IFN-α-2a或国产Peg-IFN-α-2b治疗48周(180g/周),停药随访 24 周,HBV DNA <2000IU/ml的发 生率为30%,HBeAg血清学转换率为30.75%~36.3%(其中基线 ALT>2×ULN 且治疗 12 周时 HBsAg <1500 IU/ ml者可高达 68.4%),HBsAg转换率为 2.3% ~ 3%,停药3年 HBsAg 清除率为 11%[113,144-146]。Peg-IFN-α-2a治疗HBeAg阴性慢性HBV感染者(60%为亚洲人)48周,停药随访 24 周,HBVDNA<2000IU/ml的发生率为 43%,停药后随访48周时为42%;HBsAg消失率在停药随访24周、3 年、5 年时分别为 3%、8.7% 和 12%[113,146]。
Peg-IFN-α 治疗 24 周时,HBV DNA 下降<2lgIU/ml且 HBsAg 定量>20000IU/ml(HBeAg 阳性者)或下降<1 lgIU/ml(HBeAg 阴性者),建议停用Peg-IFN-α治疗,改为 NAs治疗[112,116,146]。
2.Peg-IFN-α 与NAs联合治疗 :对NAs经治 CHB患者中符合条件的优势人群联合Peg-IFN-α可使部分患者获得临床治愈[116,146]。治疗前 HBsAg 低水平(<1500IU/ml)及治疗中HBsAg快速下降(12周或24周时HBsAg<200IU/ml或下降 >1lgIU/ml)的患者,联合治疗后HBsAg阴转的发生率较高[147-151]。但联合治疗的基线条件、最佳疗程和持久应答率等,尚需进一步研究。
3.Peg-IFN-α进一步降低HBV相关肝癌的发生率:119对单独应用Peg-IFN-α或恩替卡韦治疗的CHB患者,随访5年发现,采用Peg-IFN-α治疗的患者5年内均未发生肝细胞癌;而采用恩替卡韦治疗者在随访第4、5年时分别有2例、1例发生肝细胞癌,与模型预测发生率间差异无统计学意义(P=0.36)[152]。另一项包括 682 例采用 NAs、430例应用干扰素-α单独或联合NAs治疗的回顾性研究显示,在中位随访时间5.41年时共31例发生肝细胞癌,接受干扰素-α治疗患者的10年累积肝细胞癌发生率明显低于NAs治疗患者(2.7% 比 8.0%,P<0.001)[146,153]。Peg-IFN-α在降低HBV相关肝癌发生率方面的作用值得进一步深入研究。
(二)Peg-IFN-α抗病毒疗效的预测因素
治疗前的预测因素:HBV DNA<2×108IU/ml,ALT高水平(2~10×ULN)或肝组织炎症坏死G2以上,A 或 B 基因型,基线低 HBsAg 水平(<25000IU/ml)[6,112-113,146,154-155],基线核心抗体定量检测(qAnti-HBc)定量高水平[62-63],基线信号转导及转录激活蛋白4 (signal transducer and activator of transcription,STAT4) 为rs7574865[156],是提示干扰素疗效较好的预测指标。Peg-IFN-α治疗12周时的HBV DNA水平、HBsAg定量及其动态变化,可用于预测干扰素疗效[146]。
(三)Peg-IFN-α的不良反应及其处理[6,112-113]
1.流感样症候群:发热、头痛、肌痛和乏力等,可在睡前注射干扰素-α或用药时服用非甾体抗炎药。
2.骨髓抑制:中性粒细胞计数≤0.75×109/L和/或血小板计数<50×109/L,应降低干扰素剂量;1~2周后复查,如恢复则增加至原量。中性粒细胞计数≤0.5×109/L和/或血小板计数<25×109/L,则应暂停使用干扰素。对中性粒细胞计数明显降低者,可试用粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)或粒细胞巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)治疗。
3.精神异常:抑郁、妄想、重度焦虑等。应及时停用干扰素,必要时会同精神心理方面的专科医师进一步诊治。
4.自身免疫病:部分患者可出现自身抗体,仅少部分患者出现甲状腺疾病、糖尿病、血小板计数减少、银屑病、白斑病、类风湿关节炎和系统性红斑狼疮样综合征等,应请相关科室医师会诊共同诊治,严重者应停药。
5.其他少见的不良反应:视网膜病变、间质性肺炎、听力下降、肾脏损伤、心血管并发症等,应停止干扰素治疗。
(四)Peg-IFN-α治疗的禁忌证[6,112-113]
1.绝对禁忌证:妊娠或短期内有妊娠计划、精神病史(具有精神分裂症或严重抑郁症等病史)、未能控制的癫痫、失代偿期肝硬化、未控制的自身免疫病,严重感染、视网膜疾病、心力衰竭、慢性阻塞性肺病等基础疾病。
2.相对禁忌证:甲状腺疾病,既往抑郁症史,未控制的糖尿病、高血压、心脏病。
推荐意见9:HBeAg阳性慢性感染者采用恩替卡韦、TDF或TAF治疗。治疗1年若HBV DNA低于检测下限、ALT复常和HBeAg血清学转换后,再巩固治疗至少3年(每隔6个月复查1次)仍保持不变,可考虑停药,延长疗程可减少复发(A1)。
推荐意见10:HBeAg阳性CHB患者采用Peg-IFN-α抗病毒治疗。治疗24周时,若HBV DNA下降<2lgIU/ml且 HBsAg 定量>20000IU/ml,建议停用 Peg-IFN-α 治疗,改为NAs治疗(A1)。有效患者治疗疗程为48周,可以根据病情需要延长疗程,但不宜超过96周(B1)。
推荐意见11:HBeAg阴性CHB患者采用恩替卡韦、TDF或TAF治疗,建议HBsAg消失且HBV DNA检测不到后停药随访(A1)。
推荐意见12:HBeAg阴性CHB患者采用Peg-IFN-α抗病毒治疗。治疗 12 周时,若 HBV DNA下降<2lg IU/ml,或 HBsAg 定量下降<1lgIU/ml,建议停用 Peg-IFN-α治疗,改为NAs治疗(B1)。有效患者治疗疗程为48周,可以根据病情需要延长疗程,但不宜超过96周(B1)。
推荐意见13:代偿期乙型肝炎肝硬化患者,推荐采用恩替卡韦、TDF或TAF进行长期抗病毒治疗,或采用PeglFN-α治疗,但需密切监测相关不良反应(A1)。
推荐意见14:失代偿期乙型肝炎肝硬化患者,推荐采用恩替卡韦或TDF长期治疗,禁用干扰素治疗(A1),若必要可以应用TAF治疗(C1)。
十四、其他治疗
抗HBV治疗可降低HBV相关并发症的发生率,降低HBV相关肝癌的发生率,提高患者生存率,是慢性HBV感染者最重要的治疗措施。此外还有抗炎、抗氧化、保肝、抗纤维化、调节免疫等治疗。
(一)抗炎、抗氧化、保肝治疗
HBV感染后导致肝细胞炎症坏死是疾病进展的重要病理生理过程。甘草酸制剂、水飞蓟素制剂、多不饱和卵磷脂制剂和双环醇等具有抗炎、抗氧化和保护肝细胞等作用,有望减轻肝脏炎症损伤。对肝组织炎症明显或ALT水平明显升高的患者,可以酌情使用,但不宜多种联合。
(二)抗纤维化治疗
多个抗纤维化中药方剂如安络化纤丸、复方鳖甲软肝片、扶正化瘀片等,在动物实验和临床研究中均显示一定的抗纤维化作用[157-161],对明显纤维化或肝硬化患者可以酌情选用。但尚需多中心随机对照研究进一步明确其疗程及长期疗效等。
十五、慢性HBV感染者的监测和随访管理[6,112-113]
(一)慢性HBV携带状态和非活动性HBsAg携带状态患者的管理
慢性HBV携带状态因处于免疫耐受期,患者肝内无炎症活动或仅有轻微炎症,且此期患者抗病毒治疗效果欠佳,所以目前不推荐进行抗病毒治疗。但需要强调,一部分免疫耐受期患者可能会进入免疫清除期而出现肝炎活动。非活动性HBsAg携带状态处于免疫控制期,但仍有发展成HBeAg阴性CHB的可能,且长期随访仍有发生肝细胞癌的风险。
因此,慢性HBV携带状态和非活动HBsAg携带状态的患者均建议每6~12个月进行血常规、生物化学、病毒学、甲胎蛋白、腹部超声和肝纤维化无创诊断技术等检查,必要时进行肝活组织检查,若符合抗病毒治疗指征,及时启动治疗。
(二)抗病毒治疗过程中的监测
抗病毒治疗过程中的定期监测是为了监测抗病毒治疗的疗效、用药依从性,以及耐药情况和不良反应。
1.应用Peg-IFN-α的患者:血常规检查(治疗第1个月每1~2周1次,稳定后每月1次),肝脏生物化学检查(每月1次),甲状腺功能和血糖值检测(每3个月1次),HBV DNA、HBsAg、HBeAg和抗-HBe定量检测(每3个月1次),肝脏硬度值测定(每6个月1次),腹部超声检查和甲胎蛋白检测等(无肝硬化者每6个月1次,肝硬化者每3个月1次),必要时做增强CT或增强MRI以早期发现肝细胞癌。
2.NAs类药物:血常规、肝脏生物化学指标、HBV DNA定量和HBV感染5项指标、肝脏硬度值测定等,每3~6个月检测1次;腹部超声检查和甲胎蛋白等(无肝硬化者每6个月1次,肝硬化者每3个月1次);必要时做增强CT或增强MRI以早期发现肝细胞癌。采用TDF者,每6~12个月检测1次血磷水平、肾功能,有条件者可监测肾小管早期损伤指标。
(三)抗病毒治疗结束后的随访
治疗结束后对停药患者进行密切随访的目的:评估抗病毒治疗的长期疗效,监测疾病进展以及肝细胞癌的发生。因此,不论患者在抗病毒治疗过程中是否获得应答,在停药后前3个月内应每月检测1次肝脏生物化学指标、HBV 感染5项指标和HBV DNA定量;之后每3个月检测1次,1年后每6个月检测1次。无肝硬化的患者需每6个月行1次腹部超声检查和甲胎蛋白检测等,肝硬化患者需每3个月检测1次,必要时做增强CT或增强MRI以早期发现肝细胞癌。
十六、特殊人群抗病毒治疗的推荐意见
(一)应答不佳患者
1.CHB患者:采用恩替卡韦、TDF或TAF治疗48周,若 HBV DNA > 2×103IU/ml,排除依从性和检测误差后,可调整NAs治疗方案(采用恩替卡韦者换用TDF或TAF[162-163],采用TDF或TAF者换用恩替卡韦,或两种药物联合使用)。也可以联合Peg-IFN-α治疗。
2.乙型肝炎肝硬化患者:采用恩替卡韦、TDF或TAF治疗 24 周,若 HBV DNA > 2×103IU/ ml,排除依从性和检测误差后,建议调整NAs治疗方案(采用恩替卡韦者可改用TDF或TAF,采用TDF或TAF者可改用恩替卡韦),或两种药物联合使用(恩替卡韦联用TDF或TAF)。
(二)应用化学治疗和免疫抑制剂治疗的患者
慢性HBV感染者接受肿瘤化学治疗或免疫抑制剂治疗有可能导致HBV再激活,重者可导致肝衰竭甚至死亡。大约20%~50%的HBsAg阳性、抗-HBc阳性肿瘤患者,8%~18%的HBsAg阴性、抗-HBc阳性肿瘤患者,在抗肿瘤治疗后发生HBV再激活[164-165]。预防性抗病毒治疗可以明显降低乙型肝炎再激活发生率[166-167]。建议选用强效低耐药的恩替卡韦、TDF或TAF治疗[168-170]。
所有接受化学治疗或免疫抑制剂治疗的患者,起始治疗前应常规筛查HBsAg、抗-HBc。
HBsAg阳性者应尽早在开始使用免疫抑制剂及化学治疗药物之前(通常为1周)或最迟与之同时应用NAs抗病毒治疗[6,171-172]。
HBsAg阴性、抗-HBc阳性患者,若HBV DNA阳性,也需要进行预防性抗病毒治疗[112];如果HBV DNA阴性,可每1~3个月监测ALT水平、HBV DNA和HBsAg,一旦HBV DNA或HBsAg转为阳性,应立即启动抗病毒治疗[112,173]。
HBsAg阴性、抗-HBc阳性者,若使用B细胞单克隆抗体或进行造血干细胞移植,HBV再激活风险高[174-175],建议预防性使用抗病毒药物治疗[112,165,168,176-177]。
应用化学治疗和免疫抑制剂的CHB或肝硬化患者,NAs抗病毒的疗程、随访监测和停药原则与普通CHB或肝硬化患者相同。处于免疫耐受和免疫控制状态的慢性HBV感染患者,或HBsAg阴性、抗-HBc阳性、需要采用NAs预防治疗的患者,在化学治疗和免疫抑制剂治疗结束后,应继续恩替卡韦、TDF或TAF治疗6~12个月[6,168,178]。对于应用B细胞单克隆抗体或进行造血干细胞移植患者,在免疫抑制治疗结束至少18个月后方可考虑停用NAs[179-180]。NAs停用后可能会出现HBV复发,甚至病情恶化,应随访12个月,其间每1~3个月监测HBV DNA。
(三)妊娠相关情况处理
育龄期及准备妊娠女性均应筛查HBsAg,对于HBsAg阳性者需要检测HBV DNA[181]。对于有抗病毒治疗适应证患者,可在妊娠前应用Peg-IFN-α治疗,以期在妊娠前6个月完成治疗。在治疗期间应采取可靠的避孕措施。若不适合应用Peg-IFN-α或治疗失败,可采用TDF抗病毒治疗。对于妊娠期间首次诊断CHB的患者,其治疗适应证同普通CHB患者,可使用TDF抗病毒治疗。妊娠前或妊娠期间开始服用抗病毒药物的CHB孕产妇,产后应继续抗病毒治疗,并根据病毒学应答情况,决定是继续原治疗方案,还是换用其他NAs或Peg-IFN-α继续治疗。
抗病毒治疗期间意外妊娠的患者,若正在服用TDF,建议继续妊娠;若正在服用恩替卡韦,可不终止妊娠,建议更换为TDF继续治疗;若正在接受干扰素-α治疗,建议向孕妇和家属充分告知风险,由其决定是否继续妊娠,若决定继续妊娠则要换用TDF治疗。
血清HBV DNA高水平是母婴传播的高危因素,妊娠中后期如果HBV DNA定量>2×105IU/ml[182],建议在与患者充分沟通,在其知情同意的基础上,于妊娠第24~28周开始抗病毒治疗,应用TDF或替比夫定[183-184]。应用TDF时,母乳喂养不是禁忌证[185-186]。
免疫耐受期口服NAs的孕妇,可于产后即刻或服用1~3个月后停药。停药后17.2%~62%的患者可能发生肝炎活动,且多发生在24周内[187-189],应加强产后监测。可于产后4~6周时复查肝脏生物化学指标及HBV DNA,如肝脏生物化学指标正常,则每3个月复查1次至产后6个月,如果乙型肝炎活动,建议抗病毒治疗。
男性患者抗病毒治疗相关生育问题:应用干扰素-α治疗的男性患者,应在停药后6个月方可考虑生育;应用NAs抗病毒治疗的男性患者,目前尚无证据表明NAs治疗对精子的不良影响,可与患者充分沟通的前提下考虑生育。
(四)儿童患者
儿童HBV感染者如果处于免疫耐受期,暂不考虑抗病毒治疗。对于慢性肝炎或肝硬化患儿,应及时抗病毒治疗。儿童CHB患者抗病毒治疗可明显抑制HBV DNA复制,增加ALT复常率及HBeAg转换率[190]。但需考虑长期治疗的安全性及耐药性问题[112,191-192]。
目前美国食品药品监督管理局(food and drug administration,FDA)批准用于儿童患者治疗的药物包括普通干扰素-α(≥1岁 )、恩替卡韦(≥2岁)和TDF(≥2岁,且体质量≥10 kg)[6,190]。我国已批准TAF用于青少年(≥12岁,且体质量≥35 kg)。Peg-IFN-α-2a可应用于≥5岁CHB儿童[6]。
ALT升高的HBeAg阳性CHB患者可选用有限疗程的普通干扰素-α或Peg-IFN-α-2a治疗以实现HBeAg转换[178,193],也可选用恩替卡韦、TDF或TAF治疗。普通干扰素-α用于儿童患者的推荐剂量为每周3次,每次300万~600万U/m2体表面积,最大剂量不超过1 000万U/m2体表面积,推荐疗程为24~48周;Peg-IFN-α-2a每次剂量 180 μg/1.73 m2体表面积,疗程为 48 周[194]。恩替卡韦、TDF或TAF剂量参照美国FDA、WHO推荐意见和相关药物说明书(表 6)[8,190,193]。
对于普通干扰素-α或Peg-IFN-α-2a治疗未实现HBeAg转换或HBeAg阴性的CHB患儿及肝硬化患儿,可应用NAs治疗[178]。
(五)肾功能损伤患者
肾脏损伤高危风险包括以下1个或多个因素:失代偿期肝硬化、eGFR < 60 ml·min-1·(1.73 m2)-1、控制不良的高血压、蛋白尿、未控制的糖尿病、活动的肾小球肾炎、伴随使用肾毒性药物或接受实体器官移植等[112]。当存在肾损伤高危风险时,应用任何NAs抗病毒过程中均需监测肾功能变化。若应用ADV或TDF治疗,无论患者是否存在肾脏损伤高危风险,均需定期监测血清肌酐、血磷水平[195-196]。
慢性肾脏病患者、肾功能不全或接受肾脏替代治疗的患者,推荐恩替卡韦或TAF作为一线抗HBV治疗药物,或可根据患者情况选用替比夫定进行抗病毒治疗,不建议应用ADV或TDF[142,197]。目前上市的NAs中,TAF在不合并HIV 感染的患者 eGFR ≥ 15 ml·min-1·(1.73 m2)-1时不需调整剂量,其他 NAs在 eGFR <50ml·min-1·(1.73m2)-1时则需调整给药剂量,具体剂量调整方案可参考相关药品说明书。
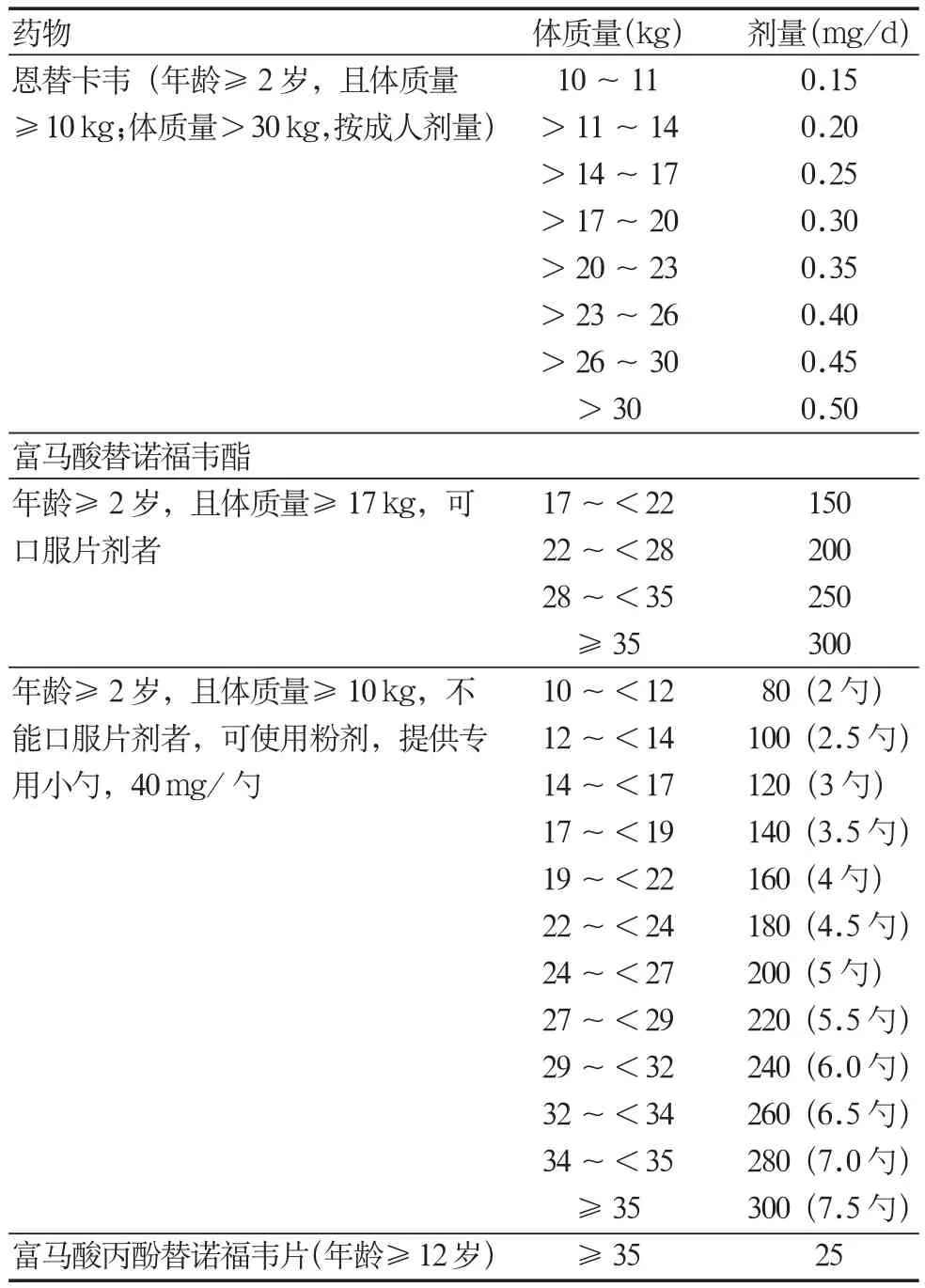
表6 儿童使用核苷(酸)类药的推荐剂量
对于HBsAg阳性的肾移植患者,可选用恩替卡韦或TAF作为预防或治疗药物。由于存在增加排斥反应的风险,肾移植患者应避免使用普通干扰素-α或Peg-IFN-α治疗。
HBV相关肾小球肾炎可应用NAs抗病毒治疗,推荐使用恩替卡韦或TAF[198]。
已应用ADV或TDF抗病毒治疗的患者,当发生肾脏或骨骼疾病或存在其他高危风险时,建议改用恩替卡韦或TAF[197]。
推荐意见15:CHB患者应用恩替卡韦、TDF或TAF治疗48周,若HBVDNA>2×103IU/ml,排除依从性和检测误差后,可调整NAs治疗(应用恩替卡韦者换用TDF或TAF,应用TDF或TAF者换用恩替卡韦,或两种药物联合使用)(C2)。也可以联合Peg-IFN-α治疗(B1)。
乙型肝炎肝硬化患者应用恩替卡韦、TDF或TAF治疗24周,若HBVDNA>2×103IU/ml,排除依从性和检测误差后,建议调整NAs治疗(应用恩替卡韦者换用TDF或TAF,应用TDF或TAF者换用恩替卡韦,或两种药物联合使用)(C2) 。
推荐意见16:所有接受化学治疗、免疫抑制剂治疗的患者,起始治疗前都应常规筛查HBsAg、抗-HBc(A1)。对于HBsAg阳性者,在开始免疫抑制剂及化学治疗药物前1周或同时进行抗病毒治疗(A1),应用恩替卡韦、TDF或TAF(B1)。对于HBsAg阴性、抗-HBc阳性者,若使用B细胞单克隆抗体或进行造血干细胞移植,建议应用恩替卡韦、TDF或TAF抗病毒治疗(B1)。
推荐意见17:慢性HBV感染者准备近期妊娠,或妊娠期间有抗病毒指征时,在充分沟通并知情同意后,可以使用TDF 治疗(B1)。
推荐意见18:抗病毒治疗期间意外妊娠的患者,若使用TDF治疗,建议继续妊娠;若使用恩替卡韦,可不终止妊娠,建议换用TDF治疗(B1)。若应用干扰素治疗,建议向孕妇和家属充分告知风险,由其决定是否继续妊娠,若继续妊娠应换用TDF治疗(C2)。
推荐意见19 :妊娠中后期 HBV DNA 定量> 2×105IU/ ml,在充分沟通并知情同意的基础上,可于妊娠第24~28周开始应用TDF或替比夫定抗病毒治疗(A1)。建议免疫耐受期孕妇于产后即刻或1~3个月停药。应用TDF治疗,母乳喂养不是禁忌证(C2)。停药后应至少每3个月检测肝脏生物化学和HBV DNA等指标,直至产后6个月,发生肝炎活动者应立即启动抗病毒治疗(A2)。
推荐意见20:对于进展期肝病或肝硬化患儿,应及时进行抗病毒治疗,但需考虑长期治疗的安全性及耐药性问题。1岁及以上儿童可考虑普通干扰素-α治疗,2岁及以上可选用恩替卡韦或TDF治疗,5岁及以上儿童可选用Peg-IFN-α-2a,12岁及以上可选用TAF治疗(A1)。
推荐意见21:慢性肾脏病患者、肾功能不全或接受肾脏替代治疗的患者,推荐恩替卡韦或TAF作为一线抗HBV治疗药物,或可根据患者情况选用替比夫定进行抗病毒治疗,不建议应用ADV或TDF(B1)。对于存在肾脏损伤高危风险的CHB患者,应用任何NAs抗病毒过程中均需监测肾功能变化。已应用ADV或TDF的患者发生肾脏或骨骼疾病或存在高危风险时,建议改用恩替卡韦或TAF(B1)。
(六)HBV和HCV合并感染患者
所有HBsAg阳性者都应筛查抗-HCV,如为阳性,则需进一步检测HCV RNA定量。HCV RNA定量阳性者均需应用直接抗病毒药物(direct acting agents,DAA)治疗。此类患者有发生HBV再激活的风险,因此在应用抗HCV治疗期间和停药后3个月内,建议联合恩替卡韦、TDF或TAF抗病毒治疗并密切监测[112]。
HBsAg阴性、抗-HBc阳性者应用DAA治疗丙型肝炎过程中也有 HBV再激活的风险,建议每月监测血清HBV DNA定量和HBsAg,若出现阳转,建议应用抗病毒治疗[112]。
推荐意见22:HCV和HBV合并感染者应用DAA治疗HCV时,若HBsAg阳性,需给予NAs治疗以预防HBV再激活,DAA治疗结束12周后,可考虑停止NAs治疗(B2);HBsAg阴性、抗-HBc阳性者应用DAA期间,需密切监测HBV DNA 和HBsAg定量,如阳转,建议应用NAs治疗(B2)。
(七)HBV和HIV合并感染患者
不论CD4+T淋巴细胞水平如何,只要无抗HIV暂缓治疗的指征,均建议尽早启动抗反转录病毒治疗(anti retroviral therapy,ART)。HIV和HBV合并感染者应同时治疗两种病毒感染,包括两种抗HBV活性的药物,高效抗反转录病毒治疗(highly active anti retroviral therapy,HAART)方案NAs选择推荐TDF或TAF+拉米夫定或依曲西他滨(emtricitabine,FTC)(其中TDF +FTC及TAF + FTC有合剂剂型)。治疗过程中需对HBV相关指标,如HBV DNA、肝生物化学指标、肝脏影像学指标等进行监测。对于HIV和HBV合并感染者,不建议选择仅含有1种对HBV有活性的NAs(TDF、拉米夫定、恩替卡韦、替比夫定、ADV)的方案治疗乙型肝炎,以避免诱导HIV对NAs耐药性的产生[199-200]。
需要注意,肾功能不全患者:① 如肌酐清除率< 60 ml/(min·1.73 m2体表面积),不能选择 TDF 或调整TDF剂量。② 肌酐清除率< 50 ml/(min·1.73 m2体表面积)而 > 30 ml/(min·1.73 m2体表面积),可考虑选择包含TAF+(FTC或拉米夫定)的方案。TAF 尚未被批准应用于 eGFR < 30 ml·min-1·(1.73 m2)-1患者。③不能使用TDF/TAF时,在HAART方案的基础上应加用恩替卡韦。妊娠期妇女:如HIV和HBV合并感染者为妊娠期妇女,建议使用包含拉米夫定(FTC)+ TDF在内的用药方案[201]。
推荐意见23:HBV和HIV合并感染者,建议选择对HIV和HBV均有效的抗病毒药物组合(A1)。
(八)HBV相关肝衰竭患者
HBV相关急性、亚急性、慢加急性和慢性肝衰竭患者的病死率高,若HBsAg阳性建议应用抗病毒治疗。
抗HBV治疗可改善HBV相关慢加急性肝衰竭(acuteon-chronic liver failure,ACLF)的长期预后[202-203]。多项临床研究证实,恩替卡韦和拉米夫定均可有效降低ACLF的病死率[204-205]。荟萃分析显示,治疗HBV相关的ACLF时,恩替卡韦优于拉米夫定[205-206]。也有小样本临床研究发现,替比夫定和TDF治疗HBV相关的ACLF可获益[207-208]。与TDF相比,TAF在保持抗病毒疗效的同时可减轻肾脏毒性[142],但是TAF治疗肝衰竭的临床证据尚不足。早期快速降低HBV DNA定量水平是治疗的关键[204,207],若HBV DNA定量水平在2~4周内能下降2 lgIU/ml,患者生存率可提高[206-207]。抗病毒药物应选择快速、强效、低耐药的NAs(恩替卡韦、TDF或TAF)[209]。肝衰竭患者恢复后,抗病毒治疗应长期坚持。
推荐意见24:HBV相关急性、亚急性、慢加急性和慢性肝衰竭患者,若HBsAg阳性建议应用恩替卡韦、TDF或TAF抗病毒治疗(A1)。
(九)HBV相关肝细胞癌患者
HBV DNA阳性的肝细胞癌患者接受抗HBV治疗可减少肝细胞癌术后的复发,提高总体生存率[210-216]。抗病毒药物应选择快速、强效的NAs(恩替卡韦、TDF或TAF)。无禁忌证患者也可应用干扰素-α。
HBsAg阳性而HBV DNA阴性的肝细胞癌患者接受肝脏切除、肝动脉化学治疗栓塞术、放射治疗或全身化学治疗时,都可能出现HBV再激活[217-221],建议使用恩替卡韦、TDF或TAF进行抗病毒治疗。
推荐意见25:HBV相关肝细胞癌患者,若HBsAg阳性,建议应用恩替卡韦、TDF或TAF进行抗病毒治疗(A1)。
(十)肝移植患者
患者因HBV相关疾病(包括肝衰竭、肝细胞癌)进行肝移植时,应合理选用抗HBV方案,减少移植肝再感染HBV的风险。其具体方案主要取决于再感染的主要风险因素,即移植前的HBV DNA定量水平。
如移植前HBV DNA定量阴性,则意味着再感染风险低,可在术前尽早使用强效低耐药的NAs,即恩替卡韦、TDF或TAF,预防HBV再激活,术后无需加用HBIG[222-223]。如移植前HBV DNA阳性,则意味着再感染风险高。术前尽早使用强效低耐药的NAs以降低HBV DNA水平;术中无肝期应静脉注射HBIG;术后除了长期应用NAs,还应联合应用低剂量HBIG持续0.5~1.0年,此后再继续单用NAs[222,224-225]。近年来,有研究发现在应用恩替卡韦治疗的患者中缩短HBIG疗程仍然有效[226]。如果患者已经应用了其他NAs药物,需密切监测HBV DNA,警惕耐药,及时调整方案。此外也有肝移植术后接种乙型肝炎疫苗预防复发的报道,但其临床应用尚有争议[227]。
推荐意见26:因HBV相关感染进行肝移植患者,若HBsAg阳性,建议在肝移植前开始应用恩替卡韦、TDF或TAF进行抗病毒治疗(A1)。
十七、尚待研究和解决的临床问题
1.发现和评价可用于鉴别慢性HBV感染自然史不同时期的新标志物。
2.明确新的血清标志物如抗-HBc定量水平在ALT水平正常患者治疗决策中的价值。
3.肝纤维化无创诊断指标在启动治疗、评价疗效和预测长期转归中的价值。
4.不同NAs长期治疗对肝硬化逆转及肝细胞癌发生率的影响。
5.指导安全停用NAs的临床指标及生物学标志物。
6.研发以临床治愈(功能性治愈)为目标的创新药物,并评价和现有药物的协同、联合等作用。
7.利用真实世界资料(如长期随访队列或医疗、医保大数据库)评价已上市药物的安全性、疗效和成本效益比,为临床和公共卫生决策提供证据。
8.创新CHB的管理模式,提高CHB发现率、诊断率和治疗率,降低乙型肝炎相关病死率。
执笔专家(按姓氏笔画排序):
王贵强 王福生 庄 辉 李太生 郑素军
赵 鸿 段钟平 侯金林 贾继东 徐小元
崔富强 魏 来
编写组专家(按姓氏笔画排序):
王 艳 王贵强 王福生 尤 红 宁 琴
任 红 庄 辉 李 杰 李太生 李兰娟
张文宏 张欣欣 陆伦根 陈 煜 郑素军
孟庆华 赵 鸿 南月敏 段钟平 侯金林
饶慧瑛 贾继东 徐小元 翁心华 唐 红
崔富强 彭 劼 斯崇文 韩 英 谢 青
窦晓光 魏 来
利益冲突所有作者均声明不存在利益冲突
志谢中华医学会感染病学分会和肝病学分会的全体委员完成了函审并对本版指南提出了富有建设性的意见和建议,多位同仁也对本版指南提出了宝贵的建议,在此特别致谢