Akt−Kv4.3−CaMKⅡ在有氧运动抑制压力负荷小鼠心肌肥厚中的作用及其机制
2020-03-22葛广全赵峰陈道虎石振塑陈泽伦王天光何书武魏以桢
葛广全,赵峰,陈道虎,石振塑,陈泽伦,王天光,何书武,魏以桢
目前,心脏病的运动康复方法以有氧训练为主,保持规律有氧运动有助于预防高血压和高血脂,有效改善老年患者心肌收缩和舒张能力,降低心衰发生及病死率[1−2]。既往研究显示,有氧运动能抑制心肌肥大,改善心功能[3−4],但相关机制尚未完全阐明。在自发性高血压大鼠模型中,运动训练能够减缓心衰的进展,并且通过活化Akt通路,调节心肌细胞大小,抑制凋亡、降低心肌纤维化,保护左室结构,但对其介导的下游相关信号机制尚少见报道[5]。有研究显示,心衰患者有更高的心律失常发生率,心衰时心肌细胞瞬时外向钾电流(transient outward K+current,Ito)及离子通道Kv4.3(potassium channel Kv4.3,Kv4.3)表达明显降低[6]。近期的研究发现,在神经细胞中丝氨酸/苏氨酸激酶Akt(又称作蛋白激酶B或PKB)信号通路的激活能够明显增强心肌细胞Ito的水平[7]。另外,在心肌细胞中,Kv4.3可以与钙调素依赖性蛋白激酶Ⅱ(Calcium/calmodulin−dependent protein kinaseⅡ,CaMKⅡ)结合,抑制后者的激活[8]。CaMKⅡ是介导病理性心肌重塑的重要分子,在心肌细胞中能够使谷氨酸受体广泛磷酸化,引起心肌肥大,最终造成严重的心力衰竭及心律失常[9]。有氧运动抑制压力负荷小鼠心肌肥厚的作用是否与Akt升高Kv4.3,进而抑制CaMKⅡ激活有关,目前尚鲜有明确报道。本研究拟通过构建压力负荷小鼠心肌肥厚模型,观察有氧运动对压力负荷心肌肥厚作用,并明确Akt−Kv4.3−CaMKⅡ信号在其中的作用及调节机制。
1 资料与方法
1.1 一般资料 雄性7~8周的SPF级C57BL/6小鼠60只,体质量24~28 g,许可证号:SCXK(京)2015−0008(北京百奥赛图基因生物技术有限公司)。心房钠尿肽(atrial natriuretic peptide,ANP)、磷酸化的丝氨酸/苏氨酸蛋白激酶(phospho−protein Kinase B,p−Akt)、Kv4.3和磷酸化的钙调素依赖性蛋白激酶Ⅱ(phospho−Calcium/calmodulin−dependent protein kinaseⅡ,p−CaMKⅡ)、甘油醛−3−磷酸脱氢酶(glyceraldehyde−3−phosphate dehydrogenase,GAPDH)、oligo(dT)18 primer and a RevetAid TM First Strand cDNA Synthesis和Maxima SYBR Green qPCR Master Mixes试剂盒购自美国Thermo Fisher Scientific公司;RIPA裂解液(强)购自上海碧云天生物技术有限公司,脱脂奶粉购自美国BD公司,麦胚凝集素(Wheat germ agglutinin,WGA)购自美国Sigma公司;异氟醚购自河北一品制药有限公司;倒置荧光显微镜(IX73)购自日本奥林巴斯;VeVo 770高分辨率小动物超声系统购自加拿大visualsonics公司;蛋白电泳及电转仪、ChemiDoc™XRS+凝胶成像系统购自美国Bio−Rad Laboratories公司。Perifosine购自美国Selleck Chemicals公司。
1.2 方法
1.2.1 小鼠主动脉缩窄手术及运动干预 (1)主动脉缩窄手术:小鼠术前胸部脱毛并禁食12 h,经2%异氟醚吸入麻醉,参照文献[10]进行主动脉缩窄手术。手术后连续注射抗生素3 d。(2)有氧运动干预方法:术后1周将小鼠置于(35±1)℃的恒温水池(300 cm×300 cm,水深30 cm),进行有氧运动训练,连续训练4周,每周5次,每次30 min。
1.2.2 实验分组 小鼠分为以下5组,每组12只:假手术(SHAM)组分离小鼠主动脉弓不结扎;主动脉缩窄手术(TAC)组行主动脉缩窄手术,分离小鼠主动脉弓并结扎。假手术+有氧运动(SHAM+Aerobic Exercise,SHAM+E)组进行假手术,术后1周开始进行有氧运动干预至第4周;主动脉缩窄术+有氧运动(TAC+Aerobic Exercise,TAC+E)组,进行主动脉缩窄手术,术后1周开始进行有氧运动干预至第4周;主动脉缩窄术+有氧运动+AKT抑制剂Perifosine(TAC+E+Peri)组,进行假手术,术后1周开始到第4周进行连续腹腔注射Perifosine(5 mg/kg)和有氧运动干预。后续检测中每组取6只小鼠检测心功能、心脏质量指数和心肌细胞横截面积,剩余6只小鼠摘取心脏用于提取蛋白和RNA,进行后续ANP、p−Akt、Kv4.3、p−CaMKⅡ的表达检测。
1.2.3 心功能指标检测 各组小鼠随机取6只在第5周进行小鼠胸部脱毛,经高分辨率小动物超声系统评价小鼠心脏结构和功能。通过M模式测定5个心动周期左室收缩末期直径(left ventricular end systolic diameter,LVESD)和左室舒张末期直径(left ventricular end diastolic diameter,LVEDD),检测小鼠左室扩大。通过计算左室射血分数(left ventricular ejection fraction,LVEF)和小轴缩短率(left ventricular fraction shortening,LVFS)反映收缩功能。
1.2.4 心脏质量指数测定 分组干预5周时对1.2.3所取小鼠称体质量(body weight,BW),小鼠经2%异氟醚吸入麻醉后,仰卧固定,摘取心脏,放入预冷磷酸盐缓冲溶液(phosphate buffer saline,PBS)中洗涤,滤纸吸干PBS,称心脏质量(heart weight,HW)并计算心脏质量指数(HW/BW)=HW/BW×100%。
1.2.5 小鼠心肌肥厚指标检测 采用1.2.3中的超声测量方法,VeVo 770高分辨率小动物超声系统检测舒张末期左室后壁厚度(left ventricular posterior wall thickness,LVPWS)及室间隔厚度(interventricular septal thickness,IVSS)和左室质量(left ventricular mass,LVM),评估心脏肥厚程度。
1.2.6 WGA染色检测心肌细胞横截面积 取1.2.4中新鲜心肌组织,置于4%多聚甲醛固定48 h,石蜡包埋,切片(6µm)。切片脱蜡处理,脱蜡结束后使用ddH2O水洗涤5 min,PBS洗涤3次×2 min;20 mg/L蛋白酶K孵育30 min,PBS洗涤5 min,共3次;加入20 mg/L WGA于37℃下避光孵育1 h。PBS再次洗涤5 min,共3次,倒置荧光显微镜(×20)拍照,随机抽取6个视野,测量心肌细胞横截面积。
1.2.7 荧光定量PCR(RT−qPCR)检测ANP表达 各组取剩余6只小鼠心脏组织用TRIzol裂解细胞后提取总RNA,配制总体积20µL,RNA样品500 ng的体系,参照cDNA合成试剂盒合成cDNA。参照试剂盒进行RT−qPCR测定。以GAPDH作为对照,引物:ANP,上游5′−GATAACAGCCAGGGAGGACAA−3′,下游5′−CTGCAGCTTAGATGGGATGA−5′;GAPDH,上游5′−TGTGTCCGTCGTGGATCTGA−3′,下游5′−TTGCTGTTGAAGTCGCAGGAG−5′。通过2−ΔΔCt算法进行分析。RT−qPCR反应条件:(1)95℃10 min;(2)95℃15 s,59℃30 s,72℃30 s,循环39次;(3)熔解曲线65℃~95℃,每秒钟升温0.5℃。
1.2.8 Western blot检测ANP、p−Akt、Kv4.3和p−CaMKⅡ蛋白表达 样本同1.2.7,称取100 mg心肌组织,加入RIPA裂解液(强)0.3 mL,提取总蛋白。以25µg/孔道进行上样,于120 V下进行SDS−PAGE电泳。使用半干法进行转膜。转膜结束后,将其置于5%脱脂奶粉中封闭2 h。然后裁剪条带,分别加 入1∶1 000稀 释 的ANP、p−Akt、Kv4.3和p−CaMKⅡ、GAPDH一抗,于4℃过夜孵育。TBST洗涤3次,每次10 min,之后加入二抗1∶6 000,于室温孵育90 min,TBST多次冲洗,使用Chemi Doc XRS凝胶成像系统进行ECL化学发光。
1.3 统计学方法 采用SPSS 18.0统计软件进行数据处理。符合正态分布的计量资料以均数±标准差表示,采用两因素两水平的析因设计方差分析。2组间比较用配对样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组心脏结构与功能检测 TAC手术和有氧运动对小鼠LVEDD、LVESD、LVEF及LVFS具有交互作用(P<0.01)。各单独效应下,TAC组LVEDD和LVESD均高于SHAM组(P<0.01),LVEF及LVFS均低于SHAM组(P<0.01)。但TAC+E相比于TAC组,LVEDD、LVESD降低,LVEF,LVFS升高(P<0.01),见表1。在给予有氧运动训练小鼠Akt信号抑制剂Perifosine后,TAC+E+Peri组相比于TAC+E组LVEDD、LVESD升 高,LVEF,LVFS降 低(P<0.01),见表2。
2.2 各组小鼠心肌肥厚指标结果比较 TAC手术和有氧运动对小鼠HW/BW、LVM具有交互作用(P<0.01),而BW、LVPWS及IVSS无交互作用。各单独效应下,TAC组HW/BW、LVM、LVPWS、IVSS均较SHAM组增加,2组BW差异无统计学意义;TAC+E组相比于TAC组HW/BW、LVM降低(P<0.01),BW、LVPWS和IVSS差异无统计学意义,见表3。而在给予有氧运动训练小鼠Akt信号抑制剂Perifosine后,TAC+E+Peri组HW/BW、LVM相比于TAC+E组升高(P<0.05),BW、LVPWS及IVSS差异无统计学意义,见表4。
Tab.1 Comparison of LVEDD,LVESD,LVEF and LVFS between four groups表1 各组小鼠LVEDD、LVESD、LVEF及LVFS比较 (n=6±s)
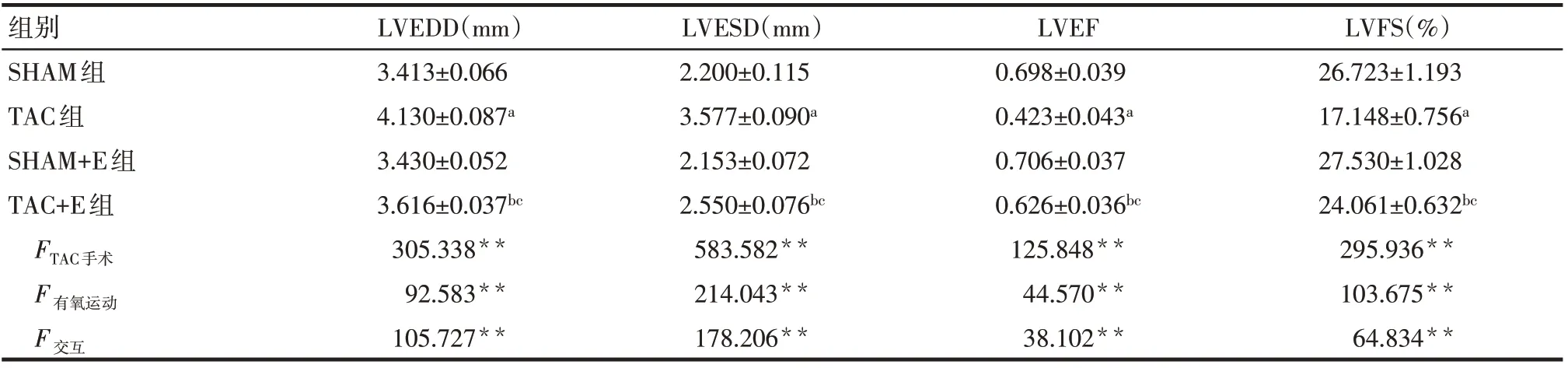
Tab.1 Comparison of LVEDD,LVESD,LVEF and LVFS between four groups表1 各组小鼠LVEDD、LVESD、LVEF及LVFS比较 (n=6±s)
*P<0.05,**P<0.01;a与SHAM组比较,b与TAC组比较,c与SHAM+E组比较,P<0.05;表2~8同
组别SHAM组TAC组SHAM+E组TAC+E组FTAC手术F有氧运动F交互LVEDD(mm)3.413±0.066 4.130±0.087a 3.430±0.052 3.616±0.037bc 305.338**92.583**105.727**LVESD(mm)2.200±0.115 3.577±0.090a 2.153±0.072 2.550±0.076bc 583.582**214.043**178.206**LVEF 0.698±0.039 0.423±0.043a 0.706±0.037 0.626±0.036bc 125.848**44.570**38.102**LVFS(%)26.723±1.193 17.148±0.756a 27.530±1.028 24.061±0.632bc 295.936**103.675**64.834**
Tab.2 Effects of perifosine on LVEDD,LVESD,LVEF and LVFS in TAC+E group表2 Perifosine对TAC+E组小鼠LVEDD、LVESD、LVEF及LVFS影响 (n=6,±s)

Tab.2 Effects of perifosine on LVEDD,LVESD,LVEF and LVFS in TAC+E group表2 Perifosine对TAC+E组小鼠LVEDD、LVESD、LVEF及LVFS影响 (n=6,±s)
组别TAC+E组TAC+E+Peri组t LVEDD(mm)3.616±0.037 3.869±0.082 7.434**LVESD(mm)2.550±0.076 2.969±0.081 8.092**LVEF 0.626±0.036 0.508±0.037 7.676**LVFS(%)24.061±0.632 19.049±0.700 11.373**
Tab.3 Comparison of HW/BW,LVM and other indexes of myocardial hypertrophy between four groups表3 各组小鼠心肌肥厚指标HW/BW、LVM等比较 (n=6,±s)

Tab.3 Comparison of HW/BW,LVM and other indexes of myocardial hypertrophy between four groups表3 各组小鼠心肌肥厚指标HW/BW、LVM等比较 (n=6,±s)
组别SHAM组TAC组SHAM+E组TAC+E组FTAC手术F有氧运动F交互BW(g)26.365±0.599 26.584±0.430 26.663±0.510 26.370±0.492 0.033 0.041 1.501 HW/BW(mg/g)5.323±0.363 7.098±0.298a 5.112±0.377 5.856±0.205bc 94.141**31.294**15.757**LVM(mm)51.957±7.767 98.736±5.816a 52.897±5.467 69.473±5.467bc 156.464**31.271**35.560**LVPWS(mm)1.138±0.031 1.378±0.062a 1.158±0.042 1.313±0.070 81.570**1.059 3.777 IVSS(mm)1.174±0.082 1.561±0.068a 1.195±0.067 1.473±0.048 145.286**1.491 3.883
Tab.4 Effects of perifosine on HW/BW,LVM and other indexes of myocardial hypertrophy in TAC+E group and TAC+E+Peri group表4 Perifosine对心肌肥厚指标TAC+E组BW、HW/BW等指标影响 (n=6,±s)
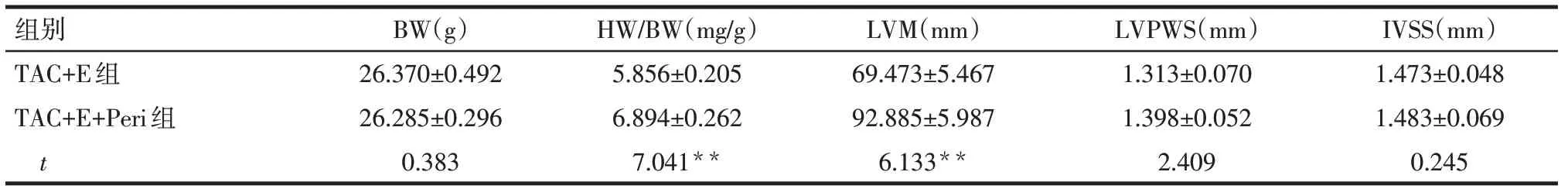
Tab.4 Effects of perifosine on HW/BW,LVM and other indexes of myocardial hypertrophy in TAC+E group and TAC+E+Peri group表4 Perifosine对心肌肥厚指标TAC+E组BW、HW/BW等指标影响 (n=6,±s)
组别TAC+E组TAC+E+Peri组t BW(g)26.370±0.492 26.285±0.296 0.383 HW/BW(mg/g)5.856±0.205 6.894±0.262 7.041**LVM(mm)69.473±5.467 92.885±5.987 6.133**LVPWS(mm)1.313±0.070 1.398±0.052 2.409 IVSS(mm)1.473±0.048 1.483±0.069 0.245
2.3 各组小鼠心肌细胞横截面积变化 SHAM组、TAC组、SHAM+E组、TAC+E组的心肌细胞横截面积分别为186.403±10.718、374.678±18.824、199.528±11.108、272.167±14.959(µm2,FTAC手术=500.327,F有氧运动=58.722,F交互=98.277,均P<0.05)。TAC手术和有氧运动对心肌细胞横截面积具有交互作用,各单独效应下,TAC组心肌细胞横截面积大于与SHAM组,而TAC+E组心肌细胞横截面积相比TAC组减小(P<0.01)。另外,TAC+E+Peri组心肌细胞横截面积为(326.500±22.474)µm2,较TAC+E组的(272.167±14.959)µm2明显增加(t=4.481,P<0.01),见图1。
2.4 ANP mRNA及蛋白水平检测 TAC手术和有氧运动对小鼠ANP mRNA及蛋白表达具有交互作用(P<0.01)。各单独效应下,TAC组ANP mRNA及蛋白表达均高于SHAM组(P<0.01)。但TAC+E组相比TAC组,ANP mRNA及蛋白表达均降低(P<0.01),见图2、表5。给予有氧运动训练小鼠Akt抑制剂Perifosine后,TAC+E+Peri组较TAC+E组ANP mRNA及蛋白表达增加(P<0.01),见图2、表6。
2.5 小鼠心肌组织p−Akt、Kv4.3和p−CaMKⅡ检测 TAC手术和有氧运动对小鼠小鼠心肌组织p−Akt、Kv4.3和p−CaMKⅡ表达具有交互作用(P<0.01)。各单独效应下,TAC组相比于SHAM组p−Akt、Kv4.3表达 降 低、p−CaMKⅡ表 达增 加(P<0.01)。但TAC+E组与TAC组相比,p−Akt、Kv4.3表达增加、p−CaMKⅡ下调(P<0.01),见图3、表7。给予有氧运动训练小鼠Akt抑制剂Perifosine后,TAC+E+Peri组相比于TAC+E组,p−Akt、Kv4.3下调、p−CaMKⅡ增高(P<0.05),见图3、表8。
Tab.5 The expressions of mRNA and protein of ANP in four groups表5 各组小鼠心脏ANP mRNA及蛋白表达(n=6,±s)

Tab.5 The expressions of mRNA and protein of ANP in four groups表5 各组小鼠心脏ANP mRNA及蛋白表达(n=6,±s)
?
Tab.6 Effects of perifosine on expressions of mRNA and protein of ANP in TAC+E group表6 Perifosine对TAC+E组ANP mRNA及蛋白表达影响(n=6,±s)

Tab.6 Effects of perifosine on expressions of mRNA and protein of ANP in TAC+E group表6 Perifosine对TAC+E组ANP mRNA及蛋白表达影响(n=6,±s)
组别TAC+E组TAC+E+Peri组t蛋白(ANP/GAPDH)0.317±0.018 0.640±0.044 17.048**mRNA(ANP/GAPDH)1.833±0.088 3.065±0.106 16.493**

Fig.1 Cardiomyocyte cross sectional area measured by WGA staining图1 WGA染色检测各组小鼠心肌细胞横截面积(标尺=50µm)
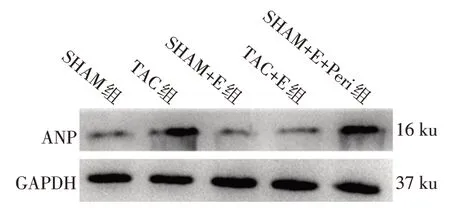
Fig.2 Western blot results of ANP protein expression in hearts of mice of five groups图2 Western blot检测各组小鼠心脏ANP蛋白表达
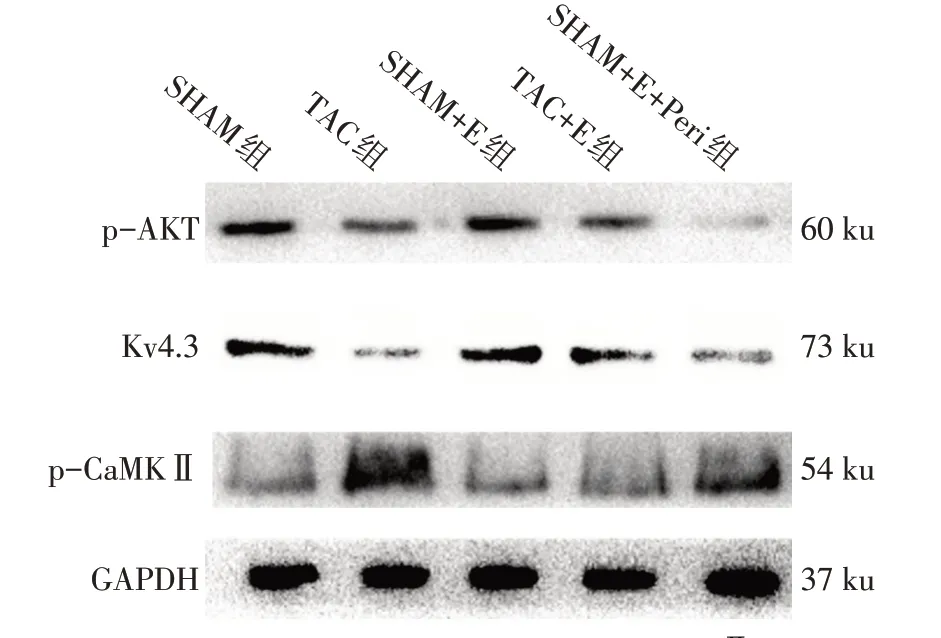
Fig.3 The expressions of p−Akt,Kv4.3 and p−CaMKⅡmeasured by Western blot assay图3 Western blot检测各组p−Akt、Kv4.3和p−CaMKⅡ蛋白表达
(n=6,±s)Tab.7 The expressions of p-Akt,Kv4.3 and p-CaMKⅡof four groups表7 各组小鼠心肌组织p-Akt、Kv4.3和p-CaMKⅡ表达

(n=6,±s)Tab.7 The expressions of p-Akt,Kv4.3 and p-CaMKⅡof four groups表7 各组小鼠心肌组织p-Akt、Kv4.3和p-CaMKⅡ表达
组别SHAM组TAC组SHAM+E组TAC+E组FTAC手术F有氧运动F交互p−Akt 3.878±0.230 1.024±0.064a 3.835±0.125 3.937±0.097bc 553.697**602.194**638.619**Kv4.3 5.538±0.272 1.067±0.075a 6.222±0.560a 7.216±0.260bc 157.557**608.247**389.137**p−CaMKⅡ1.031±0.139 5.933±0.493a 0.992±0.094 2.426±0.300bc 665.481**208.467**199.551**
3 讨论
流行病学研究显示,心力衰竭已成为日益突出的全球性公众健康问题,并呈逐年上升的趋势[11−12]。运动可有效延缓生命,减少心血管事件的发生和死亡率,而久坐式生活方式则可显著增加心血管事件的发生率和死亡率[1−2]。近年来大量研究认为,有氧运动能够通过抑制心肌肥大[13],从而改善心脏功能,但是具体作用机制尚未完全明了。本研究结果显示,TAC组较SHAM组LVEDD、LVESD、HW/BW、LVM、LVPWS与IVSS增加、LVEF及LVFS下降,心肌细胞横截面积和ANP增加,表明压力负荷促进心肌肥厚,恶化心功能。但给予有氧运动训练后,TAC+E组与TAC组相比LVESD、LVEDD、HW/BW和LVM降低,LVEF、LVFS增加,ANP表达下调,心肌细胞横截面积减小,表明有氧运动能够抑制压力负荷小鼠心肌肥厚,以上结果与既往研究结论一致[14−15]。
Tab.8 Effects of perifosine on expressions of p-Akt,Kv4.3 and p-CaMKⅡin TAC+E group表8 Perifosine对TAC+E组p-Akt、Kv4.3和p-CaMKⅡ表达影响 (n=6,±s)

Tab.8 Effects of perifosine on expressions of p-Akt,Kv4.3 and p-CaMKⅡin TAC+E group表8 Perifosine对TAC+E组p-Akt、Kv4.3和p-CaMKⅡ表达影响 (n=6,±s)
组别TAC+E TAC+E+Peri t p−Akt 3.937±0.097 0.968±0.065 61.898*Kv4.3 7.216±0.260 2.533±0.096 51.297**p−CaMKⅡ2.426±0.300 7.372±1.236 10.886**
Akt作为一种原癌基因,已经成为医学界主要的关注热点,这是因为它在调控各种不同细胞功能(包括代谢、生长、增殖、存活、转录以及蛋白质合成)方面发挥重要作用。既往研究显示,Akt在心肌肥厚中发挥了重要的调节作用[14],在压力负荷小鼠模型中,Akt活性较正常组增加[15−16],且运动训练能够过活化PI3K−Akt通路,减缓自发性高血压大鼠心衰的进展,降低心肌肥大与纤维化,保护左室结构[5]。但Akt在有氧运动抑制压力负荷心肌肥厚中的作用及其相关下游机制尚未完全阐明。Kv4.3是Ito的α亚基,在心肌细胞早期复极化中发挥重要作用,参与心肌肥厚等多种心脏生理病理过程的调节[17]。Ito是不依赖钙离子的钾电流,它主要构成心肌细胞动作电位复极过程中的1期外向电流,将心肌细胞动作电位降低到2期平台期,其激活和失活都很快。目前已经证实,犬类和人类心室外膜下和内膜下心肌细胞的Ito的α亚基都是由Kv4.3基因编码,大鼠心肌细胞上的Ito主要由Kv4.2及Kv4.3基因编码[18−19],Kv4.3基因表达异常可导 致Ito异常[20]。Lebeche等[21]发现,小鼠心肌组织过表达Kv4.3能够抑制压力负荷下的心肌肥大。而在神经细胞中,Akt信号通路的激活能够明显提高Ito的水平[7]。那是否在心肌细胞Akt能够调节Kv4.3,特别是在有氧运动抑制压力负荷心肌肥厚的过程中Akt是否能通过激活Kv4.3发挥保护作用,目前鲜有报道。本研究结果显示,TAC组较SHAM组p−Akt、Kv4.3表达降低,与相关研究的结果无差别[15,22],提示p−Akt、Kv4.3可能参与压力负荷介导的心肌肥厚。但有氧运动训练能增强p−Akt和Kv4.3表达。添加Perifosine抑制Akt后,有氧运动训练产生的心脏保护作用减弱,LVEDD、LVESD、HW/BW、LVM增加,LVEF及LVFS下降,心肌细胞横截面积和ANP增加,且Kv4.3表达降低,提示有氧运动通过激活Akt促进了Kv4.3表达,进而抑制压力负荷介导的心肌肥厚。
CaMKⅡ属于钙离子/钙调蛋白依赖的蛋白激酶家族成员,是一种多功能的丝氨酸−苏氨酸蛋白激酶,它可以通过自身磷酸化激活并磷酸化谷氨酸受体,造成级联效应[23]。心肌细胞中CaMKⅡ作为Kv4.3下游重要的信号,其能够通过磷酸化底物引起心肌肥大,最终造成严重的心力衰竭及心律失常[8,24]。本研究结果显示,TAC能使CaMKⅡ表达增高,这与Yang等[25]研究结果一致,提示CaMKⅡ参与压力负荷介导的心肌肥厚。但CaMKⅡ是否参与有氧运动抑制压力负荷心肌肥厚作用,及其与Akt的关系,目前仍鲜有研究。本研究结果显示,TAC+E组与TAC组相比,p−CaMKⅡ下调,提示有氧运动能抑制CaMKⅡ活化。而给予有氧运动训练小鼠Akt抑制剂Perifosine后,TAC+E+Peri组相比于TAC+E组p−CaMKⅡ增高,提示抑制Akt促进了p−CaMKⅡ表达。
综上所述,压力负荷诱导了心肌肥厚,恶化心功能,有氧运动训练能够通过Akt信号上调Kv4.3表达水平、抑制CaMKⅡ活性,从而心肌肥厚,改善心功能。
