早期乳腺癌新辅助化疗淋巴结转阴患者术后放疗的价值
2020-03-22程红莲王梦余岳曹旭晨
程红莲,王梦,余岳,曹旭晨
传统术后放疗(postmastectomy radiotherapy,PMRT)是乳腺癌患者的重要治疗措施,可以显著降低淋巴结阳性患者局部复发的风险,提高患者的整体生存率[1]。术前新辅助化疗(neoadjuvant chemotherapy,NAC)是指在实施局部治疗方法(如手术或放疗)前所做的全身化疗,目的是使肿块缩小、及早杀灭潜在的转移细胞,以利于后续的手术、放疗等治疗。PMRT的应用标准主要是基于传统的T和N分期。研究显示,接受NAC的80%~90%患者乳腺癌疾病分期状态发生了改变[2],所以,传统PMRT决策可能并不适用于接受NAC的患者。根据患者接受NAC疗效的判定,可以更好地选择出可能在PMRT治疗中获益的患者[3]。现有研究表明,NAC后仍有残留淋巴结阳性以及临床Ⅲ期乳腺癌患者具有较高的复发风险,应接受PMRT治疗[4]。对于在NAC后能够获得临床淋巴结阴性或者淋巴结完全病理缓解(pathologic complete response,PCR)的Ⅰ~Ⅱ期的乳腺癌患者,其局部复发率(LRR)较低,可以免除行术后放疗[5]。但是,仍没有足够的证据支持这类患者不会从PMRT治疗中获益。本研究旨在探索T1−2N1M0期乳腺癌NAC淋巴结转阴患者术后继续放疗价值,以期为该类患者临床治疗决策提供依据。
1 对象与方法
1.1 研究对象 选取2003年1月—2013年12月天津医科大学肿瘤医院收治并经组织病理学确诊为原发性乳腺癌,行术前NAC、改良根治术治疗的女性患者187例,按术后有无接受PMRT分为放疗组81例(43.3%),未放疗组106例(56.7%)。所有患者接受NAC前均经细针穿刺细胞学检查病理证实为初始腋窝淋巴结阳性。本研究以业界习惯,用40岁为界限进行年龄分组。2组患者年龄、NAC前临床T分期、NAC方案、NAC后病理T分期、PCR、分子分型、脉管瘤栓、软组织受累、组织学分级、PMRT这10项可能影响乳腺癌预后的临床病理特征上差异均无统计学意义(P>0.05),见表1。
1.2 治疗情况 NAC化疗方案主要分为蒽环类、紫杉类、蒽环类+紫杉类3种,化疗1~6个周期,中位化疗4个周期。所有患者的手术方式:187例患者全部接受乳腺癌改良根治术。放疗决策由乳腺外科专家和放疗专家共同制定,187例患者中,81例(43.3%)术后半年内接受放疗,106例(56.7%)未接受放疗。照射部位主要包括同侧胸壁和锁骨上区:胸壁采用电子线照射;锁骨上区采用6 MV X线或X线和电子线混合照射,照射剂量通过患者的体表面积而得出[6]。术后辅助化疗120例(64.2%),总化疗(新辅助+辅助化疗)周期数为1~12个,中位化疗6个周期,其中放疗组49例(60.5%),未放疗组71例(67%);分子分型为Luminal A或Luminal B型共104例患者(55.6%),其中放疗组38例(46.9%)、未放疗组66例(62.3%)全部接受内分泌治疗。

Tab.1 The clinical and pathologic characteristics in two groups of patients表1 患者临床及病理特征
1.3 研究方法 全部患者均从手术开始计算生存时间,随访截止时间为2017年12月31日。首要研究终点为局部区域复发时间,定义为从首次治疗到同侧胸壁、同侧腋窝、锁骨上下区和内乳淋巴结区任何部位复发的时间。次要研究终点包括远处转移时间、无病生存时间和总生存时间。远处转移时间定义为从手术之日到出现肿瘤远处转移的时间。无病生存时间定义为从手术之日至出现局部区域复发、远处转移和任何原因死亡的时间。总生存时间定义为从手术之日到任何原因死亡的时间。将失访患者和非肿瘤原因死亡的患者数据定义为删失值。
1.4 统计学方法 用SPSS 21.0软件进行统计学分析。对分类变量通过χ²检验进行比较,通过Kaplan−Meier对生存进行分析,通过Cox比例风险回归模型进行单因素和多因素分析,Cox回归分析时将在单因素分析中P<0.1的变量纳入多因素分析筛选出独立危险因素,方法采用向前LR法。以P<0.05为差异有统计学意义。
2 结果
2.1 生存情况 187例入组患者中位随访时间为5.1年(0.7~11.3年),放疗组较未放疗组拥有更高的无远处转移生存率(DMFS;Log−rankχ2=3.872,P=0.049);放疗组较未放疗组拥有更高的无病生存率(DFS;Log−rankχ2=5.165,P=0.023),2组患者的无局部复发生存率(LRRFS)和总生存率(OS)差异均无统计学意义(LRRFS:Log−rankχ2=2.323,P=0.127;OS:Log−rankχ2=1.484,P=0.223),见图1。
2.2 影响患者生存的单因素及多因素分析 选择年龄分层(<40岁=1;≥40岁=2)、NAC前临床T分期(T1=1;T2=2)、NAC方案(1:蒽环类;2:紫杉类;3:蒽环类+紫杉类类)、NAC后病理T分期(ypT0−ypT1=1,ypT2−ypT3=2)、PCR(无=0、有=1)、分子分型(Luminal A=1;Luminal B=2;HER−2过表达型=3;三阴型=4)、脉管瘤栓(无=0、有=1)、软组织受累(无=0、有=1)、组织学分级(1:I级;2:Ⅱ级;3:Ⅲ级;4:未知)、PMRT(无=0、有=1)共10项可能影响乳腺癌预后的临床病理因素为观察指标,进行LRRFS等Cox回归分析。结果显示,NAC后病理T分期较早者、行PMRT以及年龄≥40岁患者DMFS和DFS的预后较好(P<0.05)。软组织受累患者的LRRFS预后较差(P<0.05),见表2~6。
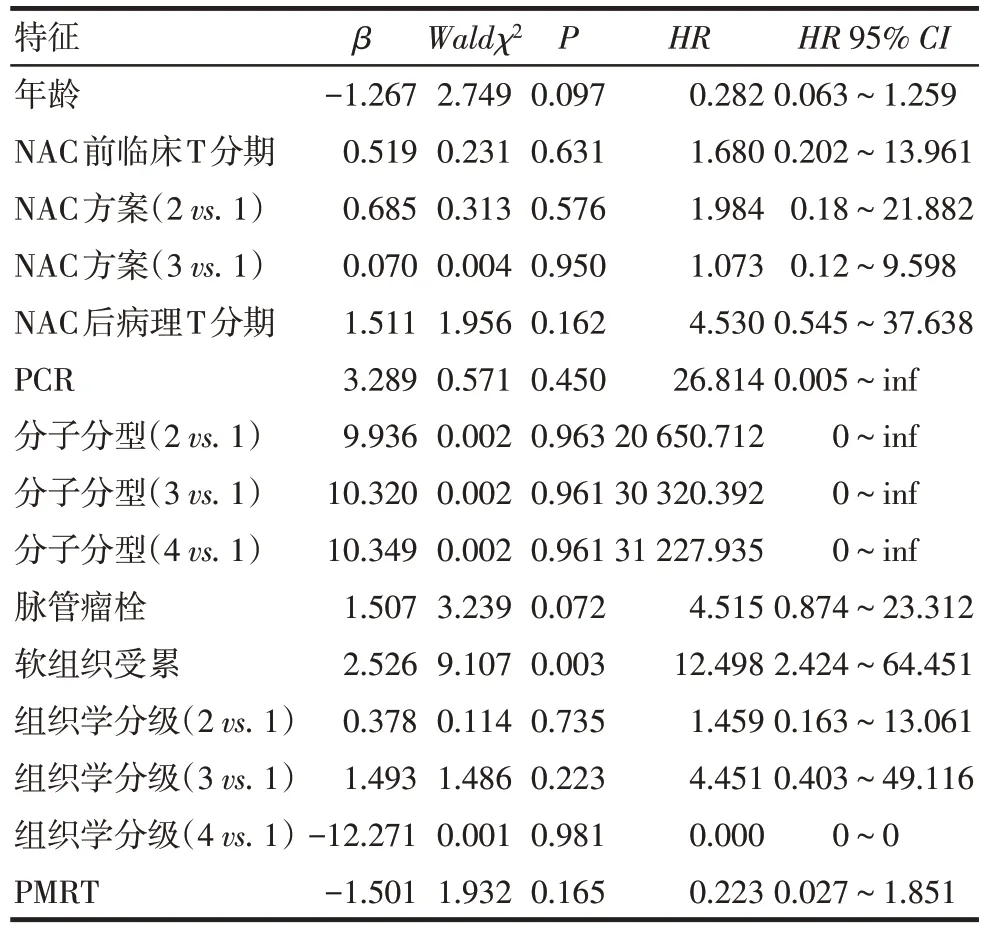
Tab.2 Univariate Cox regression analysis of LRRFS of patients表2 影响患者LRRFS的单因素Cox回归分析
3 讨论
乳腺癌是全世界女性发病率最高的恶性肿瘤[7],发病率逐年上升,严重威胁女性患者生命健康。乳腺癌的治疗在不断的发展,目前比较推崇的是以手术和放疗为主的局部区域性治疗,联合NAC、化疗、内分泌、靶向治疗为主的全身治疗。乳腺癌的临床、病理分期与术后复发风险和生存率密切有关,NAC很大程度上改变了术后病理分期,但术后的复发风险并不一定随病理分期相应的改变[8]。有关早期乳腺癌行术后放疗是否有必要仍无定论,尤其是接受术前新辅助化疗者。
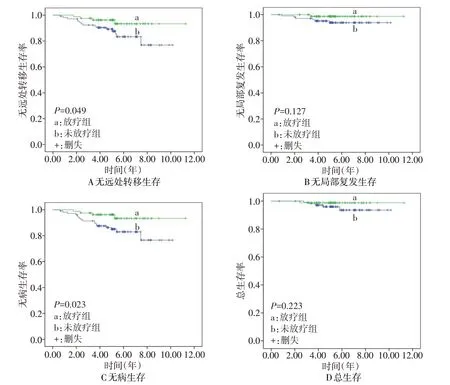
Fig.1 Kaplan−Meier survival curves according to receipt of PMRT图1 放疗组和未放疗组的Kaplan−Meier生存曲线
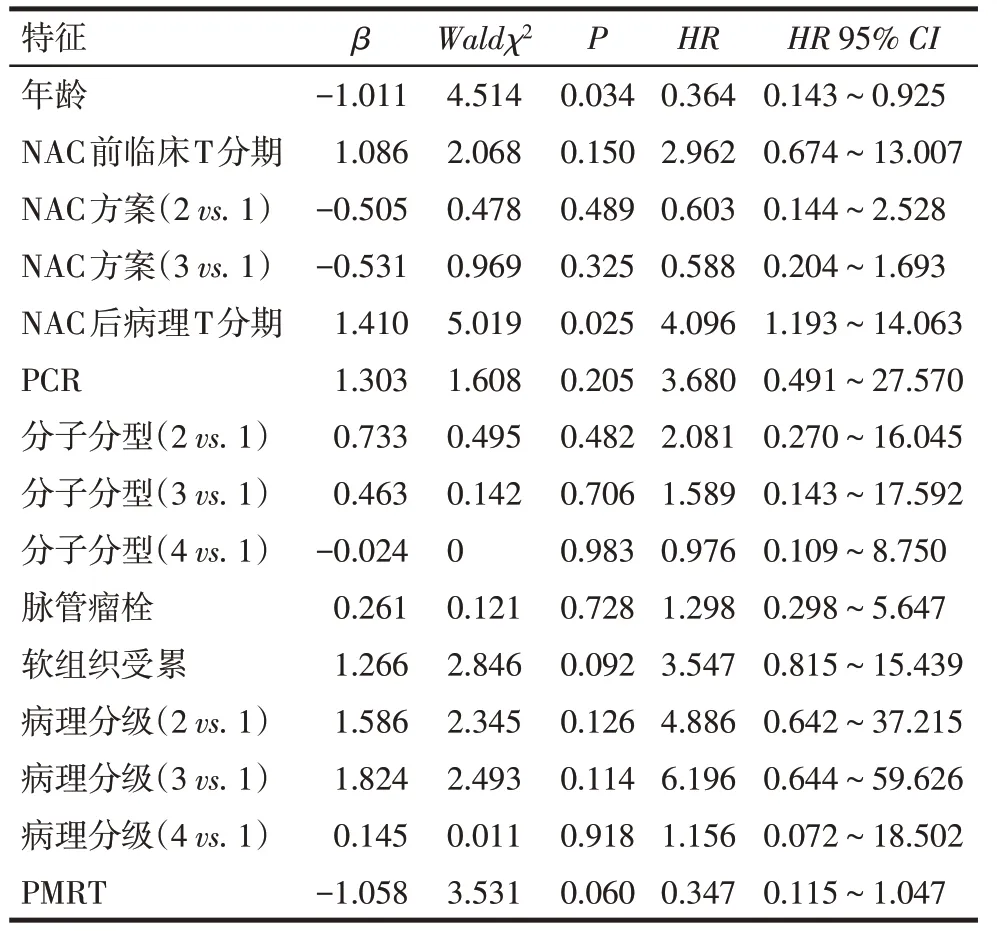
Tab.3 Univariate Cox regression analysis of DMFS of patients表3 影响患者DMFS的单因素Cox回归分析

Tab.4 Univariate Cox regression analysis of DFS表4 DFS单因素Cox回归分析
冷建彬等[9]研究认为,术后放疗可影响T1~2N1M0期伴1~3枚淋巴结转移的乳腺癌患者远期OS、PFS、LRFS的预后;术后放疗不仅可降低患者的局部复发率,还可提高患者的长期生存率。但许多研究认为对于此类患者,术后放疗并不能降低局部区域复发和远处转移风险。尤其是在NAC治疗后达到病理淋巴结阴性的患者,因为这部分患者的淋巴结状态及分期已经发生了明显改变,同时对化疗的积极反应是否意味着能完全免除后续PMRT治疗,仍无定论。Shim等[10]研究显示,对于达到ypN0的Ⅱ~Ⅲ期乳腺癌患者,术后放疗对其局部区域复发、远处转移、疾病进展和总生存均无改善,认为对这类患者无需进行术后放疗。但另有研究数据显示,NAC后放疗可以降低临床分期ⅡB期及Ⅲ期乳腺癌患者的LRR[11],对于临床Ⅰ~Ⅱ期乳腺癌患者,PMRT并不能改善其局部区域复发[12−13]。这与本研究结果相同,本研究生存分析显示,对于早期乳腺癌新辅助淋巴结转阴患者,术后放疗无法改善患者局部复发及总生存率,表明对于早期患者,术后放疗并不能转化为其生存的获益,考虑可能是因为早期乳腺癌生存率已经很高,局部复发率很低,所以增加治疗方式并不能提高总生存。美国国家癌症数据库(National Cancer Data Base,NCDB)的研究结果亦表明,PMRT的OS获益集中在临床分期T3/T4以及ⅢB/ⅢC,或者NAC后仍有乳房残余肿瘤的患者中,并不能改善Ⅱ期患者OS[14],但是该研究仅对患者总生存获益进行分析,并没有对远处转移及无病生存进行研究。

Tab.5 Univariate Cox regression analysis of OS表5 OS单因素Cox回归分析
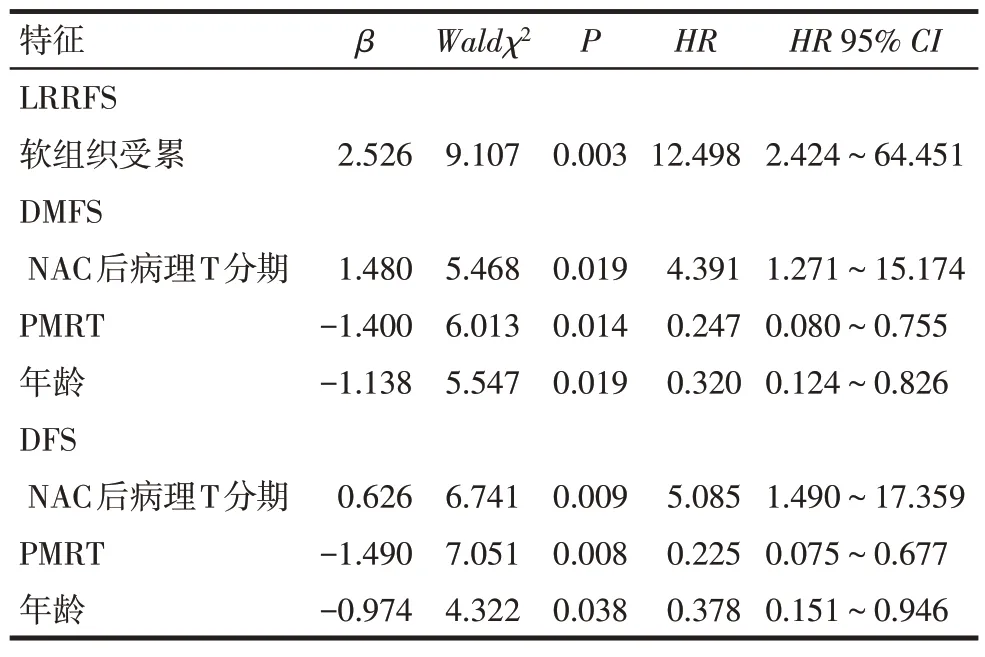
Tab.6 LRRFS,DMFS,and DFS multivariate Cox regression analysis表6 LRRFS、DMFS和DFS多因素Cox回归分析
与以上两个研究结论不同的是,本研究结果显示,术后放疗能显著改善患者远处转移和无疾病生存,此与荣庆林等[15]研究结论相吻合,该回顾性临床研究中,对于临床T1−3N1M0期乳腺癌接受NAC和改良根治术后达到ypN0的患者,术后放疗能明显降低远处转移率并提高无病生存率,并且可以降低临床Ⅲ期患者的局部区域复发率。Chen等[16]关于Ⅱ~Ⅲ期三阴型乳腺癌NAC和改良根治术后放疗价值的研究认为,放疗能显著改善IIA期患者的局部区域复发和无疾病生存。由此笔者认为对于这类患者,尚不能否定术后放疗的积极作用,但同时需要将患者的疾病根据患者具体临床病理特征以及患者对放疗的耐受程度,综合制定更加合理的放疗决策。另外,本研究多因素结果分析显示,病理T分期、PMRT以及年龄是NAC及改良根治术患者DMFS和DFS的独立预后因素。软组织受累作为乳腺癌预后因素与肿瘤局部复发有关,提示当患者存在这些危险因素时,可以更加积极地应用术后放疗。
综上所述,放射治疗在乳腺癌综合治疗当中扮演重要角色。对于临床T12N1M0期乳腺癌NAC后淋巴结转阴的患者,术后放疗可以改善乳腺癌患者的DFS和DMFS,但是未能提高患者的LRRFS以及OS。另外,本研究亮点在于入组187例患者均在NAC前行细针穿刺细胞学检查(FNAB),均经病理证实为N1期,不同于以往的临床阳性诊断。本研究也存在一定局限性,如随访时间及样本量有限,不能很好地体现术后放疗的生存获益。通过更大样本量的研究对患者进行分子分型亚组分析,能更好地筛选放疗获益人群。
