缝隙连接蛋白−43在糖尿病膀胱豚鼠模型中的表达及意义
2020-03-22李朋钱彪申茂磊赵国立王勤章
李朋,钱彪,申茂磊,赵国立,王勤章
糖尿病膀胱(diabetic cystopathy,DCP)是糖尿病泌尿系统并发症之一,在糖尿病患者中的发病率为25%~85%[1]。DCP临床主要表现为膀胱收缩功能障碍、膀胱顺应性增加、残余尿量增多、膀胱最大容量增大等症状,严重影响患者的生活质量[2−3]。目前,DCP的发病机制尚不明确。近年来多项研究表明,缝隙连接蛋白−43(connexin43,Cx43)是细胞之间兴奋传递的重要媒介,而各种因素导致的缝隙连接蛋白表达异常或者其结构破坏,均可导致细胞间的信息和物质传递通道受损、动作电位传导异常、平滑肌收缩障碍,这是导致糖尿病胃轻瘫、梗阻性肾积水、膀胱出口梗阻等疾病的主要病因之一[4−6]。Cx43也同样存在于膀胱逼尿肌中,但有关Cx43与DCP发病机制的关系也未明确。笔者推测Cx43在糖尿病膀胱的形成中起重要作用,Cx43表达下调可能使细胞间信息和物质交换功能受损[7],电偶联异常,细胞动作电位无法正常产生,进而导致膀胱逼尿肌收缩功能障碍,最终促进DCP的形成[8]。本研究建立豚鼠DCP模型,通过DCP膀胱组织中Cx43的定位、Cx43蛋白的定量分析,探讨Cx43在DCP膀胱中的表达情况及其与DCP发病的关系。
1 资料与方法
1.1 一般资料 (1)普通级荷兰种健康雄性豚鼠50只,2~4个月龄,体质量400~500 g,购于新疆医科大学动物实验中心〔合格证号SCXK(新)2018-0003〕。(2)尿动力仪(加拿大Laborie公司),免疫组化染色试剂盒(北京中杉金桥生物技术有限公司,PV−9000),浓缩型DAB试剂盒(北京索莱宝科技有限公司,DA1010),Western blot试剂盒(上海恒斐生物科技有限公司,L00205C−1),Cx43单克隆抗体(英国Abcam公司,Ab79010),荧光(FITC)标记羊抗小鼠IgG(武汉博士德生物工程有限公司,BA1031)。本研究经石河子大学医学院第一附属医院动物伦理委员会审核通过。
1.2 方法
1.2.1 诱导建立糖尿病豚鼠模型 参考李维仁等[9]方法建立糖尿病豚鼠模型。全部动物正常饮水饲料适应性喂养1周后随机分为3组:DCP组30只,枸橼酸钠组10只,空白对照组10只。DCP组豚鼠禁食12 h后按200 mg/kg体质量一次性腹腔注射链脲佐菌素[溶于0.1 mol/L枸橼酸钠(pH=4.4)中],枸橼酸钠组豚鼠按200 mg/kg一次性腹腔注射0.1 mol/L枸橼酸钠溶液,空白对照组豚鼠以200 mg/kg一次性腹腔注射生理盐水,以连续4周随机血糖≥16.7 mmol/L为标准筛选出糖尿病豚鼠,做标记并放回笼中以高糖高脂饲料饲养,其余豚鼠保持正常饮水饲料饲养。造模过程中DCP组豚鼠死亡2只,糖尿病诱导失败8只,共20只豚鼠糖尿病模型诱导成功。
1.2.2 尿动力学检测筛选DCP豚鼠 第9周时对糖尿病豚鼠行尿动力学检测。水合氯醛300 mg/kg腹腔注射麻醉,麻醉成功后仰卧位固定,暴露下腹部后碘伏消毒,在耻骨上部位行正中切口,逐层分离使膀胱充分暴露,两个4号留置针自膀胱顶穿刺进入,一个连接微量灌注泵(0.25 mL/min生理盐水灌注膀胱),另一个与压力换能感受器相连进行膀胱压力及膀胱残余尿量测定。连续记录5个排尿周期,分别记录每个模型的膀胱残余尿量、最大膀胱压力、最大膀胱容量及膀胱顺应性,以膀胱残余尿量/膀胱最大容量>10%为DCP诊断标准[10],筛选出DCP豚鼠共10只纳入研究。
1.2.3 免疫组织化学染色检测膀胱组织Cx43表达 3组膀胱组织石蜡包埋后经切片、烤片、脱蜡后进行抗原修复,滴加3%过氧化氢在切片组织上以阻断内源性过氧化物酶,室温孵育15 min后,滴加1∶100稀释好的Cx43一抗,于4℃湿盒中孵育过夜,滴加二抗,37℃孵育20~30 min,磷酸盐缓冲液(PBS)洗涤后滴加SABC于室温下孵育30 min。PBS洗涤3次,每次5 min后滴加DAB显色剂显色。自来水冲洗终止显色后加苏木素复染30~60 s,1%盐酸乙醇分化后用PBS冲洗返蓝,经无水乙醇,二甲苯脱水透明后封片镜检。
1.2.4 Western blot法检测Cx43表达 将少量膀胱组织于匀浆器中匀浆后,制作标准曲线并测定样品蛋白浓度后进行蛋白变性。SDS−PAGE电泳后转移至PVDF膜,使PVDF膜浸泡于Cx43一抗孵育液(按1∶100比例稀释)中,4℃孵育过夜。TBST洗去多余一抗,PVDF膜浸泡于稀释好的HRP标记二抗中,37℃摇床孵育2 h。用TBST洗涤PVDF膜5~6次,5 min/次,洗去多余二抗。显色曝光后晾干并扫描胶片,用Band Scan分析胶片灰度值。
1.3 统计学方法 采用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料用均数±标准差(±s)表示,多组间比较用单因素方差分析,组间多重比较采用SNK−q检验,P<0.05为差异有统计学意义。
2 结果
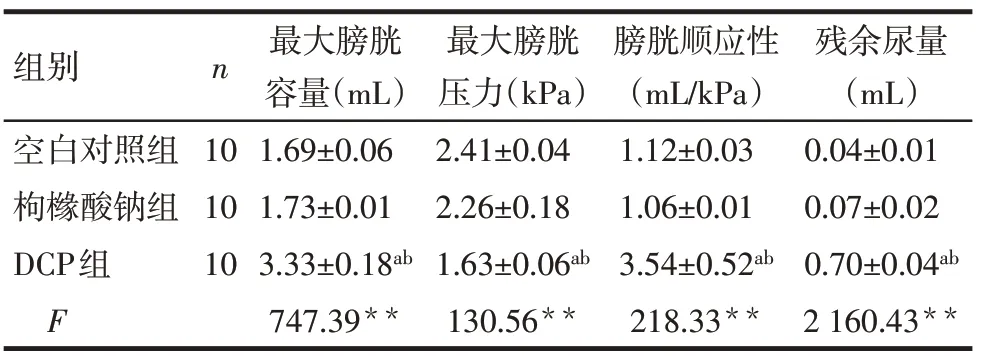
2.1 尿动力学检测结果 DCP组豚鼠最大膀胱容量、最大膀胱压力、膀胱顺应性及残余尿量较枸橼酸钠组和空白对照组明显增加(P<0.01),枸橼酸钠组和空白对照组上述指标比较差异均无统计学意义(P>0.05)。见表1。
Tab.1 Comparison of urodynamic parameters between three groups表1 3组尿动力学参数对比 (±s)
Tab.1 Comparison of urodynamic parameters between three groups表1 3组尿动力学参数对比 (±s)
**P<0.01;a与空白对照组比较,b与枸橼酸钠组比较,P<0.05
组别空白对照组枸橼酸钠组DCP组F n 10 10 10最大膀胱容量(mL)1.69±0.06 1.73±0.01 3.33±0.18ab 747.39**最大膀胱压力(kPa)2.41±0.04 2.26±0.18 1.63±0.06ab 130.56**膀胱顺应性(mL/kPa)1.12±0.03 1.06±0.01 3.54±0.52ab 218.33**残余尿量(mL)0.04±0.01 0.07±0.02 0.70±0.04ab 2 160.43**
2.2 免疫组织化学染色结果 逼尿肌细胞胞膜及部分胞质被染成棕黄色,Cx43主要表达于细胞膜上;空白对照组和枸橼酸钠组阳性染色强度明显强于DCP组,空白对照组和枸橼酸钠组之间阳性染色强度差异不明显,见图1。
2.3 Western blot检测Cx43蛋白表达 DCP组膀胱组织Cx43蛋白表达水平(0.52±0.02)低于空白对照组(0.68±0.02)和枸橼酸钠组(0.70±0.03),差异有统计学意义(F=155.92,P<0.05),空白对照组与枸橼酸钠组膀胱组织Cx43蛋白表达差异无统计学意义(P>0.05),见图2。
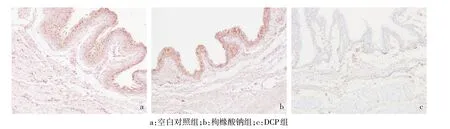
Fig.1 Expression of Cx43 in bladder detrusor of three groups of guinea pigs(immunohistochemistry staining,×100)图1 Cx43在3组豚鼠膀胱逼尿肌中的表达(免疫组化染色,×100)

Fig.2 Expression of Cx43 protein in bladder detrusor of three groups of guinea pigs图2 3组豚鼠膀胱逼尿肌中Cx43蛋白的表达
3 讨论
缝隙连接蛋白(connexin,Cx)是跨膜蛋白超家族的一员,广泛分布于除红细胞和骨骼肌之外的各器官和组织中,是构成细胞间缝隙连接(gap junction,GJ)的基本结构和功能蛋白[11−12]。6个Cx相互连接可形成六聚体,称为连接子或半通道。相邻细胞间两个连接子对接组成细胞间缝隙连接通道,介导细胞间缝隙连接通讯功能(gap junction intercellular communication,GJIC),负责细胞间信息和物质的交换,调控细胞新陈代谢、增殖和分化等生理过程[13−14]。目前已发现的Cx有20多种,其中Cx43数量最丰富且分布最为广泛,是缝隙连接最主要的组成蛋白[15−16]。Cx43构成的连接子在包膜上成簇出现,形成缝隙连接斑,其数量多少可以直接影响缝隙连接细胞间通讯功能[17]。既往研究证实,Cx43表达缺失或减少可能是糖尿病性胃轻瘫等胃肠动力障碍性疾病、心力衰竭等心血管疾病以及膀胱出口梗阻等泌尿系统疾病形成的重要病因之一[18−19],Cx43表达异常还与多种肿瘤的发生发展密切相关[20−21]。
糖尿病是由于机体胰岛素分泌相对或绝对不足而出现的以持续高血糖为主要特征的代谢紊乱综合征[22],DCP是糖尿病后期出现的泌尿系统并发症之一,临床主要特征为膀胱充盈受损、收缩功能障碍、残余尿量增多等,严重降低了患者的生活质量[23−24]。DCP病因和发病机制较为复杂,其主要发病机制之一是膀胱逼尿肌收缩功能降低[25]。另研究发现,Cx43是大鼠逼尿肌细胞中重要的连接蛋白[26−27],其构成的缝隙连接是逼尿肌细胞间兴奋传递的关键途径。相关研究表明,在膀胱过度活动症的大鼠逼尿肌中Cx43 mRNA和蛋白表达显著增加[28]。本研究免疫组织化学染色结果发现,逼尿肌细胞Cx43主要表达于胞膜,DCP组逼尿肌组织Cx43阳性染色强度与枸橼酸钠组和空白对照组相比明显较浅,Western blot结果显示DCP组Cx43蛋白的表达明显低于枸橼酸钠组和空白对照组,枸橼酸钠组和空白对照组无明显差异,表明DCP膀胱逼尿肌中Cx43表达明显降低,提示Cx43的低表达可能在DCP的形成中起重要作用,考虑具体机制可能是Cx43表达降低使逼尿肌细胞间缝隙连接减少,缝隙连接细胞间通讯功能受损[29],电信号传输异常[30],动作电位无法正常传导[31],导致兴奋无法广泛产生,逼尿肌收缩活动障碍,伴随后期膀胱的失代偿作用,最终导致了DCP的形成。
综上所述,缝隙连接蛋白−43表达量降低可能在糖尿病膀胱的形成中起重要作用,这为糖尿病膀胱发病的相关研究提供了新的方向,但有关具体机制仍需进一步研究。
