蝉芩颗粒通过下调COX-2抑制TRPV1通道减轻感染后咳嗽大鼠气道神经源性炎症
2020-03-21吕俊余小萍沈若冰
吕俊, 余小萍, 沈若冰
(上海中医药大学附属曙光医院,上海 201203)
感染后咳嗽(post-infectious cough,PIC)是指呼吸道感染的急性期症状消失后,咳嗽迁延不愈,多表现为刺激性干咳或咳少量白色黏液痰,伴咽痒,常于讲话、运动、冷空气刺激时诱发或加重[1]。由感觉神经末梢释放以P物质(SP)为主的速激肽或神经递质所介导的炎症反应称为神经源性炎症[2]。神经源性炎症是感染后咳嗽的重要机制之一,也是咳嗽高敏状态恶性循环的促动因素[3]。环氧化酶2(COX-2)—前列腺素E2(PGE2)—前列腺素E2受体亚型3(EP3)诱导瞬时受体电位类香草酸受体亚型1(TRPV1)通道活化导致速激肽释放可能在神经源性炎症中发挥重要作用[4-5]。蝉芩颗粒是上海市名中医黄吉赓先生结合多年临床经验研制的治咳验方,临床用于治疗急、慢性咳嗽,疗效确切。前期研究显示蝉芩颗粒可有效改善感染后咳嗽患者的临床症状,减轻气道神经源性炎症[6],可减少气道神经源性炎症模型大鼠血清中速激肽含量,减轻大鼠气道神经源性炎症[7]。本研究观察不同剂量蝉芩颗粒对感染后咳嗽大鼠COX-2、TRPV1通道的影响,旨在探讨蝉芩颗粒治疗感染后咳嗽大鼠气道神经源性炎症的作用机制,现将研究结果报道如下。
1 材料与方法
1.1 实验动物 8周龄SPF级雄性SD大鼠48只,体质量(200±50)g,购自上海西普尔—必凯实验动物有限公司,动物质量合格证号:200130016005160。大鼠分笼饲养于上海中医药大学实验动物中心,实验室常规条件下饲养,自由饮水,进食标准普通饲料。适应性喂养1周后进行实验。
1.2 实验药物 蝉芩颗粒(蝉衣6 g、僵蚕10 g、柴胡15 g、黄芩15 g、半夏10 g、桔梗9 g、枳壳9 g、射干15 g、杏仁10 g、紫菀15 g、前胡10 g、白前15 g),由曙光医院药剂室制备,批号:沪药制字Z06100006。阿斯美,第一三共制药(上海)有限公司生产,批准文号:国药准字H20033669。
1.3 主要试剂与仪器 内毒素(LPS),购自美国Sigma公司;辣椒素(CAP),购自MCE(中国)皓元生物有限公司;SP酶联免疫吸附分析(ELISA)试剂盒,购自上海威奥生物有限公司;TRPV1抗体,购自美国Proteintech公司。PowerPacTM通用电泳仪、Mini-PROTEANR Tetra电泳槽、小型Trans-Blot®转印槽(美国Bio-Rad公司); PCR仪(Roche480II Real Time PCR System,瑞士罗氏公司);NIKON ECLIPSE TI-SR倒置荧光显微镜、NIKON DS-U3成像系统(日本尼康公司);DENLEY DRAGON Wellscan MK3酶标仪(芬兰Thermo公司)。
1.4 感染后咳嗽模型制备
1.4.1 动物分组 将48只健康雄性SD大鼠适应性喂养1周后随机分为6组,即空白组,模型组,蝉芩颗粒低、中、高剂量组,阿斯美组,每组各8只。
1.4.2 造模方法 造模方法参照文献及课题组前期实验方案[6,8-11]:将大鼠放入0.5 m3的烟室,用50 g锯屑+5支香烟点燃烟熏,每次30 min,每日1次,连续10 d,期间自由进食、饮水。第11、14、17天异氟烷浅麻醉大鼠后,鼻腔滴入LPS溶液,浓度为0.4 mg/mL,滴入量按体质量1 μL/g计算。第12、13、15、16、18天,将大鼠放入密闭容器中,用10-4mol/L的辣椒素溶液雾化吸入,每次3 min,每日1次。造模结束后每组各处死1只大鼠验证造模结果。空白组不参与造模。
1.4.3 感染后咳嗽动物模型成功的判定标准 参照文献[6,8-11],大鼠表现出频繁咳嗽、鼻腔分泌物增多、腹部起伏运动、颈部伸前点头等特征,而肺实质未见明显病理改变,即可视为造模成功。
1.5 给药方法及疗程 造模成功后,除空白组外,各组大鼠按10 mL·kg-1的体积进行灌胃给药,每日1次,连续14 d。根据“人和动物按体表面积折算的等效剂量比值表”折算,给药剂量:蝉芩颗粒低剂组4.42 g/kg,蝉芩颗粒中剂组9.36 g/kg,蝉芩颗粒高剂组12.78 g/kg,阿斯美组4.78 mg/kg。模型组给予等体积生理盐水。灌胃期间大鼠自由进食、饮水。灌胃结束后24 h,各组大鼠进行咳嗽敏感性测试后处死、取材。
1.6 实验过程中动物死亡及实验方案调整分析 实验过程中,死亡大鼠总计5只。模型组和蝉芩颗粒低剂量组各1只大鼠于辣椒素雾化时因窒息死亡,蝉芩颗粒高、中剂量组和阿斯美组各1只大鼠灌胃时因误吸死亡;空白组无大鼠死亡。最终每组选用6只大鼠。
1.7 观察指标与方法
1.7.1 取材 (1)采血:取大鼠腹主动脉血2 mL至EP管中,分离血清,于4℃,1 500 r/min离心10 min,取上清液,-80℃冰箱中冻存备用,待测血清中SP含量。(2)取肺组织标本:于冰面上取大鼠肺右中叶,裁剪后置于4%多聚甲醛中固定6 h,石蜡包埋切片,待苏木素—伊红(HE)染色。取大鼠肺右下叶,放入EP管中,快速放入液氮,-80℃冰箱保存,供后期逆转录聚合酶链反应(RTPCR)、蛋白免疫印迹(Western Blot)法检测用。(3)取大鼠背根神经节:将大鼠俯卧置于冰面,剖开皮肤,钝性分离,暴露颈胸椎骨,以颈部最隆突(第二胸椎棘突)处定位C7至T5棘突,于正中处分离椎管,暴露脊髓。用显微外科镊将脊髓推向一侧,暴露并挑起脊神经,在椎间孔处可见背根神经节。用显微外科剪分离相应神经节,锡纸包裹,快速放入冷冻管,液氮速冻,保存于-80℃冰箱,供后期RT-PCR、Western Blot检测用。
1.7.2 辣椒素咳嗽激发实验 药物灌胃14 d后,进行辣椒素咳嗽激发实验。辣椒素激发溶液浓度为50 μmol/L,总量为1 mL,观测10 min(从辣椒素雾化开始计时),记录大鼠咳嗽次数及咳嗽潜伏期(从辣椒素雾化开始计时到第1次出现咳嗽的时间)。
1.7.3 HE染色 观察大鼠肺组织病变和炎症细胞浸润情况。
1.7.4 ELISA法测血清SP水平 采用双抗体夹心ABC-ELISA法,具体操作步骤严格按照试剂盒说明书进行。应用酶标仪于450 nm波长处测吸光度,绘制标准曲线,求出SP浓度。
1.7.5 RT-PCR法检测大鼠肺组织和背根神经节COX-2、EP3、TRPV1 mRNA表达水平 于-80℃冰箱中取出各组实验样品,分别将肺组织与背根神经节置于匀浆器中充分研磨,利用Trizol试剂盒提取组织RNA进行逆转录反应,将制备好的cDNA进行PCR扩增,cDNA引物序列分别见表1。离心混匀后,将反应管置于Real-time PCR检测仪反应。反应条件:95℃2 min,95℃5 s,60℃10 s,45个循环。作熔解曲线。所有数值先与内参做△Ct,然后用第一个样品做相对含量=2-△△Ct分析。

表1 COX-2、EP3、TRPV1 PCR引物序列Table 1 PCR prime sequences of COX-2,EP3 and TRPV1
1.7.6 Western Blot检测大鼠肺组织和背根神经节TRPV1蛋白表达 于-80℃冰箱中取出各组实验样品,分别将肺组织与背根神经节置于匀浆器中充分研磨,加入组织裂解液,提取总蛋白,经配胶、蛋白上样、十二烷基硫酸钠(SDS)—聚丙烯凝胶电泳(PAGE),转印蛋白,分别孵育一抗TRPV1抗体(1∶1 000稀释)、二抗,ECL发光、显影、定影,应用灰度分析软件进行光密度计算。用目的蛋白/内参灰度值比值(p)作为目的蛋白的表达量。
1.8 统计方法 采用SPSS 21.0统计软件进行数据分析,计量资料均服从正态分布,以均数±标准差()进行描述。多组比较采用单因素方差分析及LSD检验多重比较。均采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 动物的一般表现及咳嗽情况 造模过程中,可观察到大鼠逐渐出现不同程度的精神不振、毛色枯黄、咳嗽频繁、颈部伸前点头、前肢缩抬抓挠、腹肌抽搐等表现。
模型组大鼠咳嗽次数较空白组明显增多,差异有统计学意义(P<0.01);蝉芩颗粒各剂量组、阿斯美组大鼠咳嗽次数与模型组比较,差异均有统计学意义(P<0.01)。提示不同剂量蝉芩颗粒与阿斯美均可在一定程度上降低大鼠咳嗽次数。模型组大鼠咳嗽潜伏期较空白组明显缩短,差异有统计学意义(P<0.01);蝉芩颗粒各剂量组、阿斯美组大鼠咳嗽潜伏期延长,与模型组比较,差异有统计学意义(P<0.01)。说明蝉芩颗粒、阿斯美均可在一定程度上缓解咳嗽激发实验诱发的咳嗽,改善咳嗽敏感性。见表2。
表2 给药14 d后咳嗽激发实验咳嗽情况比较Table 2 Comparison of the cough status in various groups after medication for 14 days ()
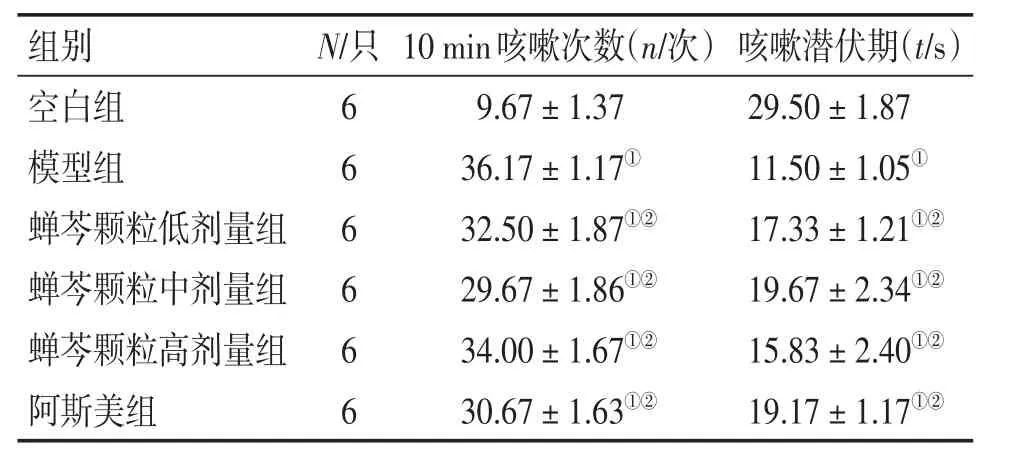
表2 给药14 d后咳嗽激发实验咳嗽情况比较Table 2 Comparison of the cough status in various groups after medication for 14 days ()
①P<0.01,与空白组比较;②P<0.01,与模型组比较
组别空白组模型组蝉芩颗粒低剂量组蝉芩颗粒中剂量组蝉芩颗粒高剂量组阿斯美组咳嗽潜伏期(t/s)29.50±1.87 11.50±1.05①17.33± 1.21①②19.67± 2.34①②15.83± 2.40①②19.17± 1.17①②N/只6 6 6 6 6 6 10 min咳嗽次数(n/次)9.67±1.37 36.17±1.17①32.50± 1.87①②29.67± 1.86①②34.00± 1.67①②30.67± 1.63①②
2.2 各组血清SP值比较 模型组血清中SP值较空白组显著升高(P<0.01),说明造模成功;治疗后蝉芩颗粒各剂量组、阿斯美组血清中SP值低于模型组,差异有统计学意义(P<0.01)。提示不同剂量蝉芩颗粒与阿斯美均可减少血清中SP的释放。各给药组组间血清中SP值差异无统计学意义(P>0.05)。见表3。
2.3 RT-PCR检测大鼠肺组织和背根神经节COX-2、EP3、TRPV1 mRNA表达的结果
2.3.1 各组大鼠肺组织中COX-2、EP3、TRPV1 mRNA表达的比较 与空白组比较,模型组肺组织中COX-2 mRNA表达增高,差异有统计学意义(P<0.01);与模型组比较,蝉芩颗粒高剂量组COX-2 mRNA表达水平降低,差异有统计学意义(P<0.05)。提示高剂量蝉芩颗粒可降低感染后咳嗽大鼠肺组织COX-2 mRNA水平。与空白组比较,模型组肺组织中EP3 mRNA表达增高,差异有统计学意义(P<0.01);蝉芩颗粒低、中、高剂量组及阿斯美组EP3 mRNA表达水平低于模型组,但差异无统计学意义(P>0.05)。与空白组比较,模型组肺组织中TRPV1 mRNA表达增高,差异有统计学意义(P<0.01);蝉芩颗粒各剂量组、阿斯美组肺组织TRPV1 mRNA表达低于模型组,差异有统计学意义(P<0.01)。提示蝉芩颗粒、阿斯美均可降低感染后咳嗽大鼠肺组织中TRPV1 mRNA表达水平。见表4。
表3 各组血清SP值比较Table 3 Comparison of the serum SP values in various groups[,ρ/(pg·mL-1)]
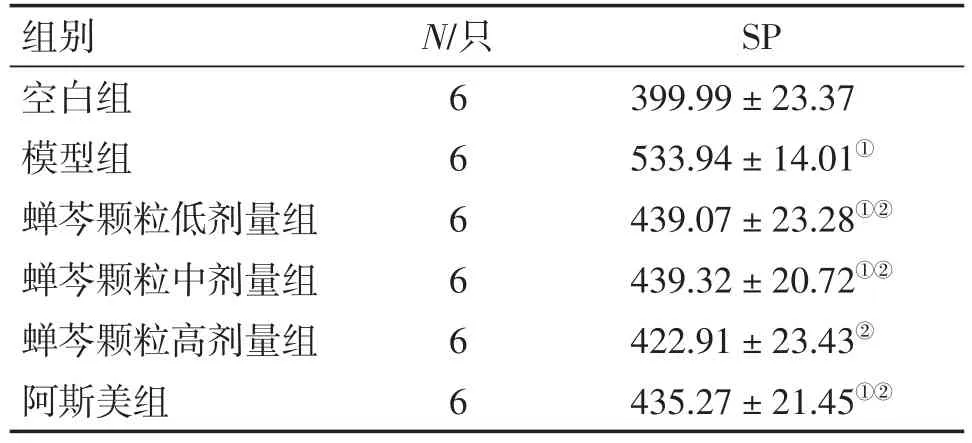
表3 各组血清SP值比较Table 3 Comparison of the serum SP values in various groups[,ρ/(pg·mL-1)]
①P<0.01,与空白组比较;②P<0.01,与模型组比较。F=27.987
SP 399.99±23.37 533.94±14.01①439.07± 23.28①②439.32± 20.72①②422.91±23.43②435.27± 21.45①②组别空白组模型组蝉芩颗粒低剂量组蝉芩颗粒中剂量组蝉芩颗粒高剂量组阿斯美组N/只6 6 6 6 6 6
表4 各组大鼠肺组织COX-2、EP3、TRPV1 mRNA相对表达量的比较Table 4 Comparison of the mRNA relative expression levels of COX-2,EP3 and TRPV1 in lung tissue of various groups ()

表4 各组大鼠肺组织COX-2、EP3、TRPV1 mRNA相对表达量的比较Table 4 Comparison of the mRNA relative expression levels of COX-2,EP3 and TRPV1 in lung tissue of various groups ()
①P<0.05,②P<0.01,与空白组比较;③P<0.05,④P<0.01,与模型组比较
TRPV1 mRNA 1.00±0.05 2.14±0.17②1.80±0.09②④1.78±0.11②④1.73±0.12②④1.76±0.12②④63.419组别空白组模型组蝉芩颗粒低剂量组蝉芩颗粒中剂量组蝉芩颗粒高剂量组阿斯美组F N/只6 6 6 6 6 6 COX-2 mRNA 1.01±0.14 1.69±0.11②1.62±0.16②1.58±0.12②1.51±0.18②③1.59±0.15②15.575 EP3mRNA 1.01±0.12 1.27±0.11②1.26±0.14①1.25±0.11②1.19±0.09①1.26±0.15①4.098
2.3.2 各组大鼠背根神经节中COX-2、EP3、TRPV1 mRNA表达的比较 与空白组比较,模型组背根神经节中COX-2 mRNA表达水平增高,差异有统计学意义(P<0.01);蝉芩颗粒高剂量组COX-2 mRNA表达水平低于模型组,差异有统计学意义(P<0.05)。与空白组比较,模型组背根神经节中EP3 mRNA表达水平增高,差异有统计学意义(P<0.01);蝉芩颗粒低、中、高剂量组、阿斯美组EP3 mRNA表达水平低于模型组,但各组间差异无统计学意义(P>0.05)。与空白组比较,模型组背根神经节中TRPV1 mRNA表达水平增高,差异有统计学意义(P<0.01);蝉芩颗粒低、中、高剂量组TRPV1 mRNA表达水平低于模型组(P<0.05或P<0.01)。见表5。
表5 各组大鼠背根神经节COX-2、EP3、TRPV1 mRNA相对表达量的比较Table 5 Comparison of the mRNA relative expression levels of COX-2,EP3 and TRPV1 in dorsal root ganglion of various groups (,p)
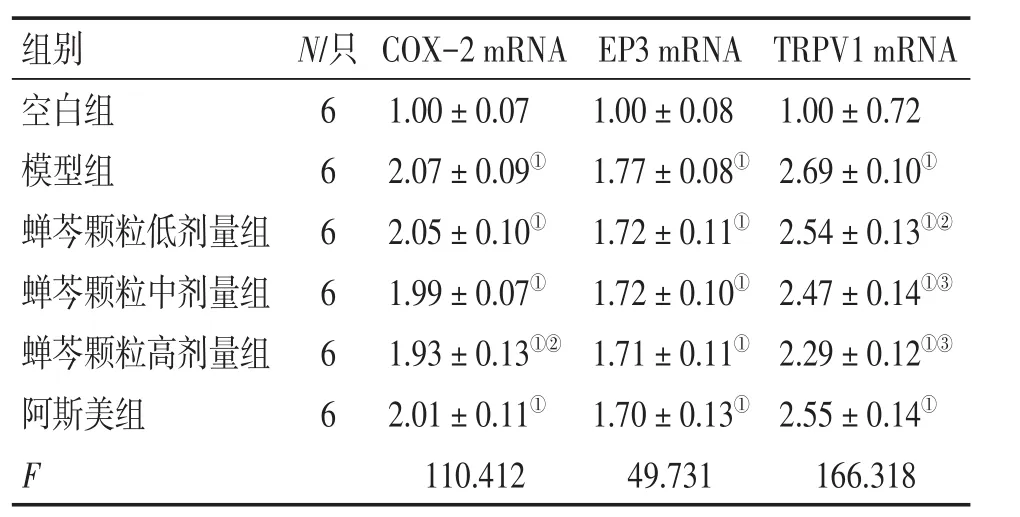
表5 各组大鼠背根神经节COX-2、EP3、TRPV1 mRNA相对表达量的比较Table 5 Comparison of the mRNA relative expression levels of COX-2,EP3 and TRPV1 in dorsal root ganglion of various groups (,p)
①P<0.01,与空白组比较;②P<0.05,③P<0.01,与模型组比较
TRPV1 mRNA 1.00±0.72 2.69±0.10①2.54± 0.13①②2.47± 0.14①③2.29± 0.12①③2.55±0.14①166.318组别空白组模型组蝉芩颗粒低剂量组蝉芩颗粒中剂量组蝉芩颗粒高剂量组阿斯美组F N/只6 6 6 6 6 6 COX-2 mRNA 1.00±0.07 2.07±0.09①2.05±0.10①1.99±0.07①1.93± 0.13①②2.01±0.11①110.412 EP3 mRNA 1.00±0.08 1.77±0.08①1.72±0.11①1.72±0.10①1.71±0.11①1.70±0.13①49.731
2.4 Western Blot检测大鼠肺组织和背根神经节TRPV1蛋白表达的结果 与空白组比较,模型组肺组织和背根神经节TRPV1蛋白表达升高,差异有统计学意义(P<0.01);与模型组比较,蝉芩颗粒各剂量组、阿斯美组肺组织和背根神经节TRPV1蛋白表达降低,差异有统计学意义(P<0.01);蝉芩颗粒中、高剂量组及阿斯美组TRPV1蛋白表达较蝉芩颗粒低剂量组降低,差异有统计学意义(P<0.01)。见表6、图1。
2.5 各组大鼠肺组织HE染色结果 空白组:肺泡上皮完整,未见明显病理改变,见图2-a。模型组:肺泡间隙增厚,伴大量中性粒细胞等炎性细胞浸润,见图2-b。蝉芩颗粒低剂量组可见肺泡上皮细胞少量脱落,中性粒细胞浸润,见图2-c。蝉芩颗粒中剂量组肺泡间隙稍增厚,少量炎性细胞浸润、中性粒细胞浸润,见图2-d。蝉芩颗粒高剂量组可见肺泡间隙稍增厚,有少量淋巴细胞、中性粒细胞浸润,见图2-e。阿斯美组:肺泡间隙增厚,伴少量淋巴细胞、中性粒细胞浸润,肺泡组织结构未见明显损伤,见2-f。
表6 各组大鼠肺组织、背根神经节TRPV1蛋白表达Table 6 Comparison of the protein expression levels of TRPV1 in lung tissue and dorsal root ganglion of various groups (,p)

表6 各组大鼠肺组织、背根神经节TRPV1蛋白表达Table 6 Comparison of the protein expression levels of TRPV1 in lung tissue and dorsal root ganglion of various groups (,p)
①P<0.01,与空白组比较;②P<0.01,与模型组比较;③P<0.01,与蝉芩颗粒低剂量组比较
背根神经节0.108±0.023 0.982±0.124①0.756±0.044①②0.616 ± 0.078①②③0.590 ± 0.054①②③0.544 ± 0.072①②③93.546组别空白组模型组蝉芩颗粒低剂量组蝉芩颗粒中剂量组蝉芩颗粒高剂量组阿斯美组F N/只6 6 6 6 6 6 TRPV1/GAPDH肺组织0.094±0.016 0.918± 0.151①0.771± 0.103①②0.388 ± 0.074①②③0.428 ± 0.074①②③0.593 ± 0.057①②③65.208

图1 各组大鼠肺组织和背根神经节TRPV1蛋白Western Blot条带Figure 1 Comparison of the Western Blot strips of TRPV1 in lung tissue and dorsal root ganglion of various groups
3 讨论

图2 各组大鼠肺组织病理变化比较(HE染色,×400)Figure 2 Comparison of the pathological features of lung tissue in various groups(by HE staining,×400)
感染后咳嗽的咳嗽反射主要受2种不同类别的感觉传入神经纤维控制,分别为有髓鞘Aδ纤维和无髓鞘C纤维,而大于90%含速激肽的传入纤维是C纤维,其神经元胞体源于颈神经节[12]。C纤维最显著的特征是纤维末梢上有TRPV1的功能性表达。TRPV1又称辣椒素受体,是瞬时受体电位通道蛋白的超家族成员之一,在中小型神经纤维有着较高的表达,在人组织的血管平滑肌、支气管上皮细胞也有表达[13]。TRPV1可被体内多种炎症因子激活,其中以PGE2为主的炎症因子可降低TRPV1的活化阈值从而增加它的敏感性[14]。
COX-2是催化花生四烯酸氧化反应的限速酶,也是炎症部位的主要环氧化物酶,与神经源性炎症密切相关。PGE2是COX-2的主要产物,也是COX-2发挥生物学作用的主要信使。有研究认为PGE2激活TRPV1的主要途径是与EP3受体结合,通过EP3受体耦联的G蛋白传导信号,然后经过CAMP/PKA机制激活和增敏TRPV1,产生钙离子内流引起冲动,释放SP等速激肽,形成神经源性炎症[4-5]。可见COX-2诱导PGE2分泌,对TRPV1具有激动作用,COX-2有可能成为治疗感染后咳嗽的重要靶点。
本研究结果显示,模型组大鼠血清SP值、肺组织和背根神经节中COX-2、EP3、TRPV1表达升高,说明烟熏结合内毒素滴鼻及辣椒素刺激造模可通过促进大鼠COX-2表达升高,使PGE2的重要受体EP3表达增加,通过增加气道C纤维兴奋性激活TRPV1通道,从而激活蛋白激酶A释放SP等速激肽类物质,导致气道神经源性炎症。治疗后,蝉芩颗粒组血清SP值下降、肺和背根神经节中COX-2 mRNA表达下调、节中EP3受体mRNA表达无明显变化、TRPV1 mRNA及蛋白表达均下调,提示蝉芩颗粒可通过下调感染后咳嗽大鼠肺组织和背神经根节COX-2及TRPV1表达,减少速激肽SP的释放,从而减轻气道神经源性炎症。
蝉芩颗粒各剂量组大鼠肺和背根神经节中EP3 mRNA表达水平与模型组比较,差异无显著性,但表现出一定的下调趋势。其原因分析有二:一是样本量较小,导致差异不明显;二是介导PGE2生物学效应的EP受体有4种亚型,EP1和EP3受体均可增加细胞外钙离子内流[15],从而发挥相应的生物学效应。从目前实验结果看,需要扩大样本量以进一步观察变化趋势,且需要观察蝉芩颗粒对其他EP受体的作用,以更好地了解蝉芩颗粒对感染后咳嗽的作用机制。
