ST段抬高型心肌梗死患者相关风险评估与治疗
2020-03-21梁峰胡大一方全沈珠军
梁峰,胡大一,方全,沈珠军
作者单位:1 102600 北京,首都医科大学大兴教学医院心内科;2 100044 北京,北京大学人民医院心脏中心;3 100730 北京,中国医学科学院北京协和医院心内科
近几十年来由于再灌注治疗尤其直接经皮冠脉介入治疗(PCI)的普及应用,急性ST段抬高型心肌梗死(STEMI)患者院内死亡率从心血管重症监护病房年代之前的30%以上降为4%~12%,注册研究STEMI 1年死亡率约10%[1]。STEMI诊治的临床实践中,非常重要的是识别可能发生的并发症,以及风险评估预测预后,警示医生可能发生不良事件,以便制定更积极的策略。本文全面综述STEMI患者相关的风险评估和治疗指导。
1 急性期风险评估及治疗选择
1.1 依据获益-风险评估选择再灌注策略STEMI再灌注治疗始终追求的目标为早期、完全、持续心外膜血管再通以及微血管灌注恢复,以降低死亡率、再梗死、缩小梗死范围以及改善左室功能,是STEMI患者治疗的基石[2,3]。目前院前急救的任务包括识别不适宜溶栓患者直接送可行PCI的医院行直接PCI;STEMI缺血症状持续≤12 h,非高危及高危患者(心源性休克或血流动力学不稳定及室性心律失常,以及广泛ST段抬高、新发左束支阻滞、既往心肌梗死、Killip心功能2级以上、左室射血分数≤35%)应立即行直接PCI,如果直接PCI不能迅速进行(STEMI诊断到直接PCI导丝通过预期>120 min)就地溶栓治疗后,尽快转院行冠状动脉(冠脉)造影及PCI。纤溶治疗失败(60~90 min时ST段下移<50%)后即刻或只要出现血流动力学不稳定、电不稳定、或缺血恶化则随时适宜实施补救PCI(ⅠA)[1];再发缺血或证据显示成功纤溶治疗后再闭塞的患者,适宜冠脉造影以及如果需要进行PCI(ⅠB)[1];若纤溶治疗成功,从纤溶治疗起至冠脉造影的间隔时间为2~24 h。无ST段抬高,疑似持续缺血症状提示心肌梗死的患者,至少合并如下一项标准适宜直接PCI:血流动力学不稳定或心源性休克、药物难治性反复或持续性胸痛、威胁生命的心律失常或心脏骤停、心肌梗死机械并发症、急性心力衰竭、反复ST段和T波动态变化尤其间断性ST段抬高(ⅠC)[1]。对症状持续>12 h患者,并伴有持续缺血的临床和(或)心电图证据,以及心力衰竭、休克或恶性心律失常征象,遵循直接PCI策略;症状发作后就诊较晚的患者(12~48 h),应考虑常规直接PCI策略。急性心肌梗死(AMI)事件后几天就诊的患者,只有出现反复心绞痛或明确的残留缺血以及大面积心肌分布区无创影像检查显示存活心肌,此时如果梗死相关动脉(IRA)闭塞可考虑再血管化治疗[1]。如IRA不能行PCI,持续缺血和大面积心肌处于危险状态的患者,应考虑CABG(ⅡaC)。心肌梗死后稳定的患者常规晚期对闭塞IRA进行PCI,较单纯药物治疗无更多获益;这些患者可按慢性完全闭塞病变患者处理。而非IRA血管重建的时机,非IRA的生理学评价,血管内影像指导的直接PCI及改进的血栓抽吸技术在高危患者作用需进一步研究明确[4]。
1.2 STEMI合并心源性休克患者的急性期风险评估2017年欧洲指南推荐,心力衰竭或休克的患者,如果适宜推荐行急诊冠脉造影和PCI(ⅠA)[1];心源性休克患者如果冠脉解剖不适合PCI或PCI失败,推荐急诊冠状动脉旁路移植术(CABG)(ⅠB)。2018年欧洲血运重建指南强调,心源性休克和院外心脏骤停的高危患者,是快速救治PCI最大获益者[5]。合并休克但无院外心脏骤停的患者,首次医疗接触后60~180 min内,PCI每延迟10 min,死亡率额外增加3.3%;院外心脏骤停而无休克者,PCI每延迟10 min,死亡率额外增加1.3%;而稳定的患者则死亡率只额外增加0.3%。急性STEMI合并心源性休克时,有3个主要治疗目标。首先须行辅助循环支持,以维持足够的平均动脉压和全身器官灌注;其次减轻心室负荷,降低心肌耗氧量;三是开通闭塞冠脉以便增加心肌灌注。心肌血液供需比正向转换的净效果是进一步减轻心肌缺血和损伤的总负荷。除血管重建外,合理使用急性机械循环支持可实现上述三个目标[6]。而机械并发症是致命性的,需及时检查和治疗。突发低血压、胸痛复发、新出现心脏杂音提示二尖瓣反流或室间隔穿孔;肺淤血以及颈静脉充盈,应引起疑似诊断。当疑似机械并发症时,需立即行超声心动图检查。2017年欧洲指南推荐:由于机械并发症导致血流动力学不稳定或心源性休克的患者,应考虑主动脉内球囊泵(IABP)置入(ⅡaC);可以考虑正性肌力药物或血管收缩药物稳定血流动力学(ⅡbC);顽固性休克患者,考虑短期机械辅助循环支持(ⅡbC);心源性休克患者不适宜常规IABP置入(ⅢB);也不推荐直接PCI同期常规非IRA病变血管重建(ⅢA)。
目前AMI合并心源性休克患者院内死亡率仍然极高,既使早期进行PCI死亡率接近50%[7]。心源性休克的严重性和临床预后相关性差,需要一种急性期准确的风险分层,便于治疗决策选择如高级别治疗,尤其积极的机械辅助装置。IABP-SHOCKⅡ评分系统[8]基于IABP-SHOCK Ⅱ试验预测AMI合并心源性休克30 d死亡率,6项参数确定为独立的风险预测因素,年龄>73岁计1分,卒中史计2分,就诊时血糖>10.6 mmol/L(191 mg/dl)计1分,血清肌酐>132.6μmol/l(1.5 mg/dl)计1分,动脉血乳酸水平>5 mmol/L计2分,PCI后TIMI血流<3级计2分,共计9分。IABP-SHOCKⅡ积分从低危0~2分,中危3~4分,到高危5~9分;30 d死亡率从23.8%、49.2%到76.6%;受试者工作特征曲线下面积(AUC)为0.74。IABP-SHOCK Ⅱ注册人群验证模式的AUC为0.79,CardShock试验人群验证模式的AUC为0.73。IABPSHOCK Ⅱ评分系统适宜于日常临床实践,能够依据短期死亡风险进行风险分层,有利于临床决策制定。
1.3 STEMI患者住院期或30 d风险评估模式STEMI所有患者应及早进行评估短期风险,包括心肌损伤的面积,成功再灌注,以及发生事件的高危临床指标如高龄、心率快、低血压、Killip心功能分级>I级、前壁心肌梗死、既往心肌梗死、初始血清肌酐升高、心力衰竭史、外周动脉疾病。风险分层对合适的决策制定非常重要,如是否需转运至三甲医疗中心,治疗策略强度,住院期限以及应进行何种药物和介入治疗。依据再灌注治疗前急性期容易识别的指标,开发了多种积分系统,而过去多种PCI风险预测模式不能代表现代临床实践[9]。STEMI患者推荐GRACE和TIMI评分系统进行风险评价和风险调整。以及近期开发的适宜于现代人群ACTION Registry-GWTG模式[10]和适宜于亚洲人群的CAMI评分系统[11]。
GRACE院内死亡风险评分系统是日常临床实践中基于非选择性急性冠脉综合征(ACS)患者11 389例,建立简单模式评估住院死亡风险[12]。用于明确哪些因素可预测研究人群的风险及校正风险因素差异进行非随机研究比较;开发简单模式能够准确预测所有ACS个体患者住院死亡率。GRACE具体评分方法如表1,八项独立的危险因素可解释89.9%预后信息,建模数据库的C统计量为0.83,两个验证数据库的C统计量分别为0.84和0.79。Grace评分从≤60分增加到≥250分,住院死亡率从≤0.2%逐步升高到≥52%;其中Killip分级是最强的预测风险因素,Killip分级每升高1级死亡风险增加2倍。对STEMI患者,如果GRACE评分49~125分,则患者住院死亡风险<2%,为低危风险;评分126~154分,住院死亡风险为2%~5%,为中危风险;评分155~319分,住院死亡风险>5%,为高危风险。GRACE评分未包含的某些因素可提供进一步预后和长期信息;故GRACE评分的简单和易用性抵消了其完整性和准确性。尽管没有模式性能比较的共识,但GRACE评分判别意义及拟合优度的小幅下降可能反映临床价值的下降。虽然就诊时风险评估具有价值,但理想的是依据患者临床过程进行动态反复风险评估。GRACE评分2.0将肌钙蛋白纳入评分系统。
TIMI评分系统[13]是基于STEMI适合溶栓就诊的14 114例患者(InTIME Ⅱ试验),用于预测30 d死亡率的简单风险评估系统。由10项基线参数组成,能够提供多变量模型97%的预测力。包括:年龄65~74岁2分,>75岁计3分;糖尿病、高血压史或心绞痛史计1分;收缩压<100 mmHg计3分;心率>100 次/min计2分;Killip分级Ⅱ-Ⅳ级计2分;体重<67 kg计1分;前壁STEMI或左束支阻滞(LBBB)计1分;治疗时间延迟>4 h计1分;最高计14分。随着积分增加,死亡率逐渐上升,积分从0~>8分每增加1分,30 d死亡率分别为0.8%、1.6%、2.2%、4.4%、7.3%、12.4%、16.1%、23.4%、26.8%、到35.9%(P<0.0001)。简单的TIMI风险积分模式捕捉大多数预后信息,可床旁预测死亡率,识别高风险患者针对性给予积极措施以改善预后,C统计量0.779;其他试验的验模C统计量0.746。对溶栓适应证的患者可能更适合。
由于现代心肌梗死人群临床特征发生变化,新型检查和治疗的使用使AMI的诊断和预后不同于过去,需要开发适合现代人群的预测模式。ACTION Registry-GWTG模式[10]为基于2012年1月至2013年12月现代人群共24 3440例急性心肌梗死患者,预测住院死亡率,进行风险分层以及用于质量改进以利于日常临床治疗。ACTION Registry-GWTG具体评分方法如表2,其中肌酐清除率使用Cockcroft-Gault公式计算,基线肌钙蛋白比定义为基线肌钙蛋白检查值除以该实验室正常上限值。积分从最低危的<30,低危为30~39分、中危40~49分、高危50~59分、极高危>59分,住院死亡率分别为0.4%、1.7%、5.5%、18.5%、49.5%。C统计量为0.88。该模式可能更适用于行PCI医院的患者。
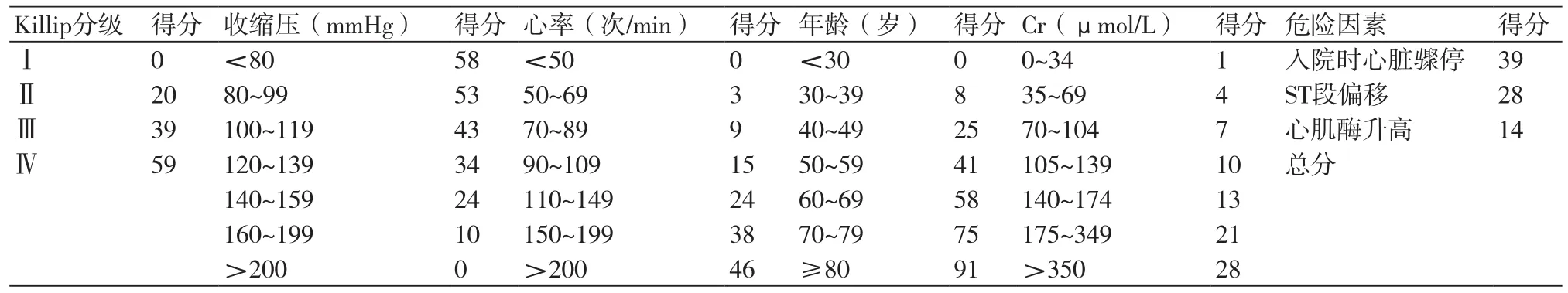
表1 GRACE院内死亡风险评分表
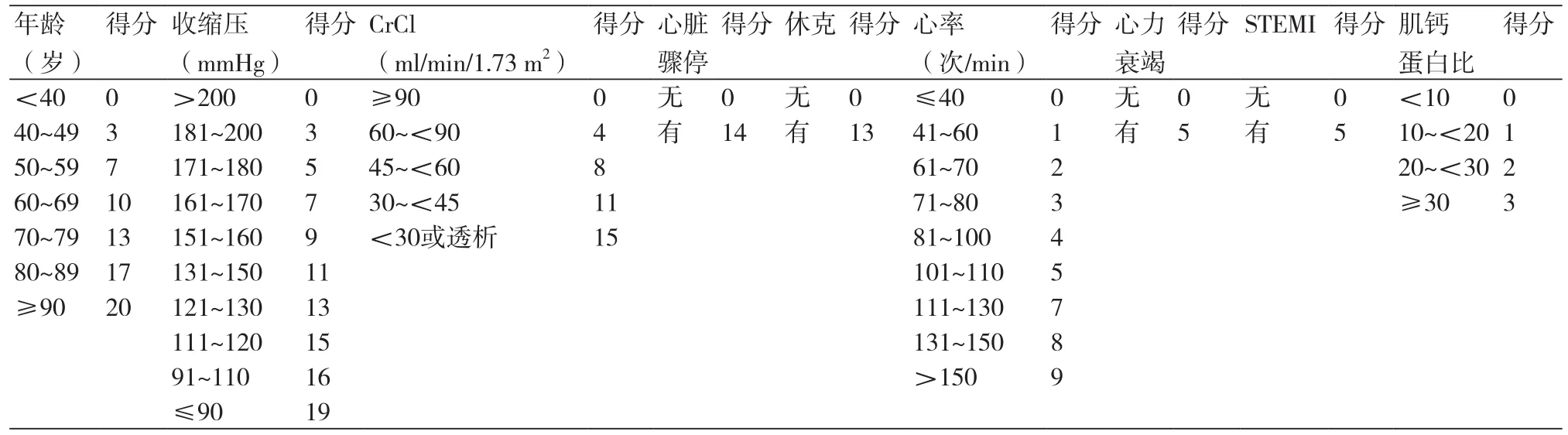
表2 ACTION Registry-GWTG评分表
由于亚洲人群庞大,急性冠脉综合征死亡率占据世界一半,因此开发适宜于亚洲人群的现代预测模式具有重要意义,近期阜外医院团队基于2013年1月至2014年9月CAMI注册研究23 417例急性心肌梗死患者开发了CAMI评分系统,预测急性心肌梗死住院死亡率[11],16项参数确立为独立预测因素,具体评分方法如表3。建模人群的AUC为0.83,验证模式人群的AUC为0.84。用于预测中国人现代急性心肌梗死患者的住院死亡率。积分从低危0~93,中危94~117,到高危≥118;建模和验模的住院死亡率分别为1.12%和0.79%,3.47%和3.24%,到14.70%和13.66%。用于就诊时快速风险分层和选择最佳治疗,但未包含某些辅助检查如肌钙蛋白和左室射血分数。
2 出血风险评估和预测模式
出血并发症为STEMI和PCI患者随后死亡率的独立风险因素,其风险等同于或高于心肌梗死本身,同时严重出血也使住院时间延长。目前降低出血并发症的策略包括使用新型抗栓药物减低出血可能,避免药物过量,以及识别处于严重出血事件风险患者。由于新型强效抗血小板和抗凝药物的临床使用,可能增加出血并发症,因此识别处于出血并发症风险的患者尤为重要。开发简单的出血风险评估模式可规范治疗标准及改善预后。目前常使用的模式包括CRUSADE、ACUITY-HORIZONS-AMI和ACTION Registry-GWTG,由于CRUSADE模式基于非ST段抬高型心肌梗死(NSTEMI)人群开发故本文不再叙述。SWEDEHEART是最新发表的出血预测模式。
ACUITY/HORIZONS-AMI 出血风险预测模式是基于ACUITY和HORIZONS-AMI试验17 421例ACS患者[14],用于预测ACS患者非冠脉旁路移植术(non-CABG)相关的30 d严重出血风险和并发症。6项基线因素和1项治疗相关因素确定为预测因素,具体评分方法如表4。积分从0分每增加5分直到40分,30d non-CABG严重出血发生率为0.9%、1.6%、2.8%、4.7%、7.9%、12.9%、20.4%、30.7%、到43.5%,C统计量为0.74。积分从低危<10分,中危10~14分,高危15~19分,到极高危≥20分;使用肝素和血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂(GPI)组30d non-CABG严重出血事件为1.9%,3.3%,6.9%、12.4%;而比伐卢定组分别为0.7%、2.0%、3.7%、8.4%。严重出血为死亡率的独立预测因素。严重出血定义为颅内出血,眼内出血,穿刺部位出血需要干预,血红蛋白下降≥4 g/dl但无明显出血源,血红蛋白下降≥3 g/dl且可发现明显出血源,出血需要再次手术或输注血液成分。不包括局部血肿和CABG相关出血。贫血定义为红细胞压积男性<39%,女性<36%。
新型ACTION Registry-GWTG出血评估模式是基于2012年1月1日至2013年12月31日ACTION Registry-GWTG试验真实世界数据共241 484例AMI患者[15],开发AMI人群住院期严重出血风险的预测模式。8项独立的因素与严重出血发生率相关,具体计分方法如表5,建模和验模C统计量均为0.74。验模人群的积分从极低危≤15分,低危16~20分,中危21~25分,高危26~30分,到极高危>30分;严重出血发生率从2.2%、5.1%、10.1%、16.3%、25.2%。ACTION Registry-GWTG出血评估模式有助于临床决策制定以及医院质量评价,尽管有助于急性期决策制定,但对长期出血评价也可提供重要信息。院内严重出血定义为,脑出血;明确或疑似腹膜后出血;基线血红蛋白≥9 g/dl患者需输注红细胞;疑似出血事件患者血红蛋白<9 g/dl需输注红细胞(出血事件定义为,血红蛋白下降≥3 g/dl,或出血部位需介入或手术干预逆转或终止出血或纠正出血,如手术探查或修补动脉切口部位,球囊封闭动脉破损,胃肠出血进行内镜下电灼止血);或血红蛋白绝对下降≥4 g/dl(基线值减去最低值)。进行CABG患者,如符合上述标准并排除CABG相关的输血,归为严重出血事件。
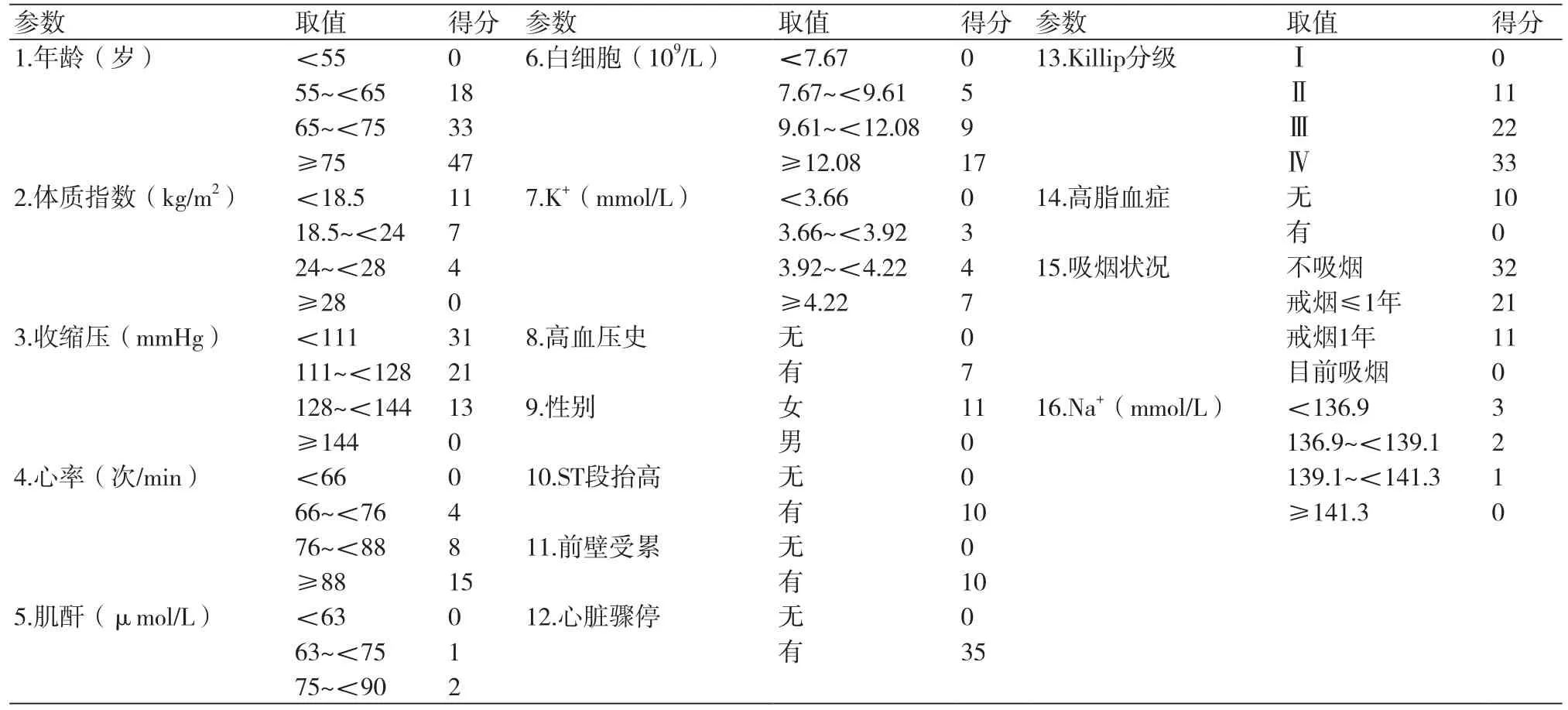
表3 CAMI评分表
SWEDEHEART出血预测模式是基于2009~2014年瑞典全国SWEDEHEART注册试验97 597例心肌梗死患者,预测患者住院期间严重出血的发生风险。5项预测因素为血红蛋白、年龄、性别、血清肌酐和C反应蛋白,具体积分方法及出血风险预测如图1,或网站(http://m.medsci.cn/scale/show.do?id=f46e2398d5),整体建模C统计量为0.80,出血预测性能优于CRUSADE和ACTION Registry-GWTG评估模式,可能更适合于瑞典心肌梗死人群。严重出血定义为致命性出血、脑出血、出血需要手术或输血干预[16]。
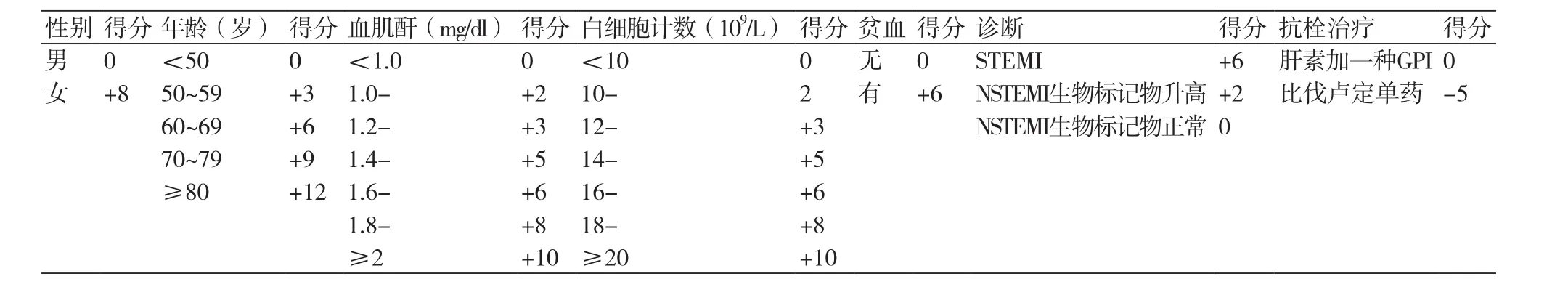
表4 ACUITY/HORIZONS-AMI 出血风险评分表
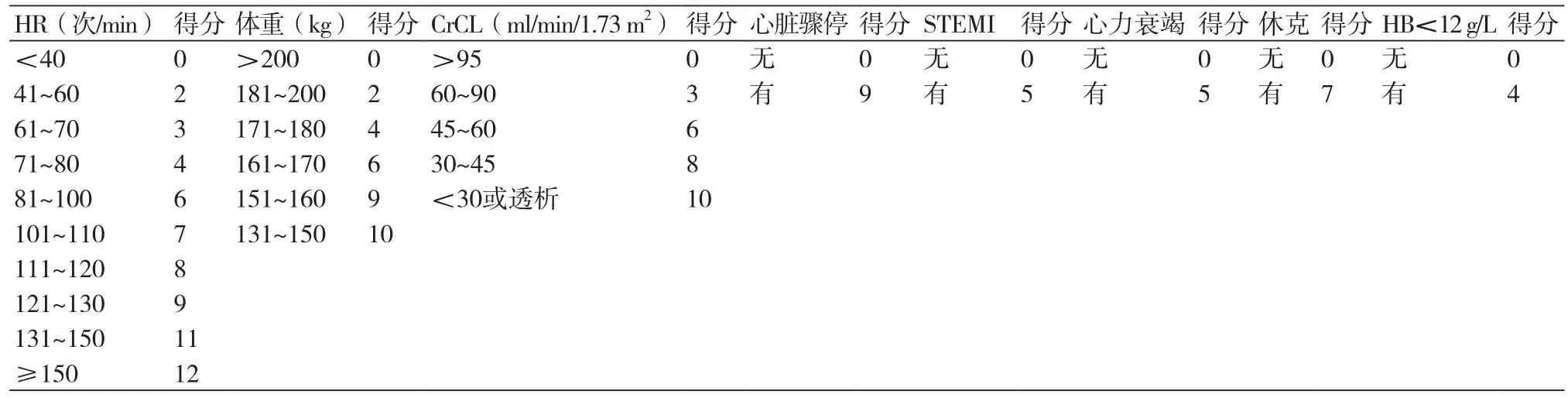
表5 新型ACTION Registry-GWTG出血风险评分表

图1 SWEDEHEART积分列线图
3 心肌梗死后心力衰竭发生的风险预测
心肌梗死(MI)后心力衰竭(HF)导致成功血管重建后晚期死亡率大幅增加,梗死范围及微血管阻塞是心力衰竭的重要预测因素,对HF发生高风险患者治疗性干预预防HF发生具有重要价值。虽然多种临床、造影、生理学、影像和生物标记物方法被推荐进行MI后HF发生的风险分层,但几乎未应用于临床实践。新型影像和冠脉生理学结合的方法,不仅可预测预后,也对于揭示各种不同亚组患者HF的机制带来希望[17]。
临床方面,梗死面积是下游HF和预后的主要影响因素。入院时HF的预测因素为基础左室功能(如既往MI)、冠状动脉病变严重性的临床因素(如糖尿病)及广泛的心肌梗死的特征(如前壁部位梗死、再灌注治疗延迟)[18]。HORIZONS-AMI人群2年新发HF的预测因素为MI史[比值比(OR)=1.81]、射血分数(每降低10%,OR=1.35)、女性(OR=1.34)以及胰岛素治疗的糖尿病(OR=1.68)[19]。CARE和VALIANT研究MI幸存者,晚发HF的预测因素为年龄、糖尿病、肾功能衰竭、MI后左室射血分数(LVEF)和MI时Killip分级≥2。GRACE评分最初是为急性冠脉综合征风险分层开发的,但目前显示可预测STEMI后晚发HF事件发生。
冠脉造影方面,多支冠脉病变、介入后TIMI血流≤2级、冠脉微血管灌注异常、无复流、介入术中血栓事件(IPTE)、左室舒张末压力升高均与死亡和严重不良心脏事件(MACE)有关[20,21]。冠脉生理学指标在HF发生风险分层的最佳指标有待研究确立;如微循环阻力指数(IMR)、充血的微血管阻力(HMR)、冠状动脉血流储备(CFR)、冠脉零流量压(Pzf)、冠状动脉血流储备分数(FFR)[17]。
超声心动图指标中的射血分数、左室容量、室壁运动积分指数、E/E’比率以及右室功能提供心肌梗死后的预后情况。最近纵向和环向应变率显示预测死亡和HF住院;纵向应变率增强全因死亡率的预测价值超越临床指标、LVEF和室壁运动积分指数[22]。心脏核磁(CMR)提供组织和功能特征的多种补充,包括处于风险心肌范围的定量、梗死面积、心肌挽救指数、微血管阻塞(MVO)、出血、异质性、瘢痕、不良重构。多种指标可独立预测预后,包括CMR确定的梗死面积、心肌挽救指数、微血管阻塞程度[23]。18氟脱氧葡萄糖(118 F-FDG)核磁共振成像(MRI)代谢融合显像可能进一步提供心肌损伤和修复的特征[24]。FDG信号仍为梗死面积和心功能的独立预测因素。正电子发射型计算机断层显像(PET)对理解体内愈合反应的生物学异质性方面具有巨大的潜力。
心脏生物标记物如肌钙蛋白和脑钠肽也可预测长期预后。最近研究显示传统生物标记物的系列联合检测可预测左室重构(AUC=0.85)。生物标记物可定义处于HF发生风险的特定生物群体而使用新型药物针对性治疗。这些可能包括炎症、持续纤维化或基质重塑的生物标记物。有研究强调对HF发生风险检测炎症级联反应的潜在价值。有许多新型生物标记物预测随后HF,包括细胞粘合素C、髓过氧化物酶、细胞因子、基质金属蛋白酶和生长因子[25];其他因子包括和肽素,可溶性生长刺激表达基因2蛋白(sST2),血清生长分化因子-15(GDF-15)。2017年美国心脏病学会(ACC)、美国心脏协会(AHA)以及美国心力衰竭学会(HFSA)心力衰竭管理指南更新推荐[26],处于HF发生风险的患者,以利钠肽为基础的筛选后进行团队干预,包括指南导向治疗,可有效预防左室功能障碍(收缩性或舒张性)或新发HF的发生(ⅡaB-R)。
4 长期风险评估及相关治疗
所有STEMI患者也应在出院前评估长期风险,包括LVEF,冠脉病变严重性及冠脉血管重建的完全性,残留心肌缺血,住院期间并发症的发生,以及代谢性疾病风险的水平,包括总胆固醇、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、空腹三酰甘油、血糖和肾功能。未获得成功再灌注的患者早期并发症和死亡的风险较高。这些患者应评价残留缺血,如果适宜应评估心肌存活。由于事件的风险随时间而降低,故宜早期评估[1]。多种PCI长期风险预测模式不适宜现代临床实践,如PAMI、CADILLAC、APEX-AMI、Washington PCI、Mayo PCI risk score 2010等,需要开发新的模式适应现代患者人群[9]。而常用的模式如GRACE可预测6个月[27,28]、1年、3年(www.outcomes.org/grace)[29]和5年死亡率[30],TIMI评分系统可预测6个月和1年死亡率[13]。
GRACE 6个月死亡风险评分系统基于1999年4月1日至2002年3月31日GRACE注册研究完成6个月随访的15 007例(87.5%完成)患者[28],开发ACS患者出院后6个月死亡风险评估模式;并用该注册研究2002年4月1日至2003年12月31日入组的7638例患者进行模式验证。9项独立的因素为预测参数,具体计分方法如表6,对STEMI患者建模和验模C统计量分别为0.71和0.76。对STEMI患者,从低危27~99分,中危100~127,高危128~263分;6个月死亡率从<4.5%、4.5%~11%、>11%。对现代STEMI患者人群验证[31],低危27~99分,中危100~127,高危128~263分;6个月死亡率从0.57%,2.74%,至8.55%,AUC为0.902。GRACE 6个月死亡风险预测模式可用于STEMI患者,具有良好的分辨力,简单实用。
TIMI评分系统不仅可预测30 d死亡率,而且可预测6个月和1年死亡率,C统计量分别为0.773和0.765。对30 d存活者1年死亡率的预测仍具有良好的判别力,C统计量为0.725;积分从0到>8分每增加1分,1年死亡率分别为1.0%、1.0%、1.8%、3.0%、4.2%、6.7%、7.7%、12.1%、16.3%、17.2%(P<0.0001)。该模式未包含缺血诱发试验信息,左室功能评价,冠脉造影及心脏标记物和ST段回落等预后指标,TIMI评分系统简单适用,可捕捉到主要预后信息[13]。
4.1 心源性猝死的评估及干预STEMI发病48 h内的室性心动过速或心室颤动(VT/VF)应尽早实施PCI、优化缺血心肌再灌注治疗、防止缺血进展及由此导致的心衰和心源性休克均非常重要。常规超声心动图检查,明确左室功能和机械并发症,静脉或口服β-受体阻滞剂,应用胺碘酮或利多卡因、电复律,进行冠脉造影及相应处理,纠正电解质紊乱,电风暴药物难以控制考虑导管消融,深度镇静,不能行导管消融者行超速抑制,口服β-受体阻滞剂预防室性心律失常。
AMI发病48 h后,40 d内出现持续性VT或VF,与心肌缺血进展和再梗死无关,如果无引起VT的可纠正的其他原因,可植入埋藏式复律除颤器(ICD)。AMI发病48 h后,40 d内发生多形性VT或VF,如血运重建不完全,且在本次AMI前已存在左心室功能障碍、LVEF降低,考虑植入ICD。AMI发病48 h后,在血运重建和最佳药物治疗的基础上,如仍反复发生VT/VF或电风暴,可经导管射频消融治疗。AMI发病48h后,40 d内发生持续性VT,采用导管消融治疗VT。AMI发病40 d内,出现持续性VT,如与心肌缺血有关,应针对缺血采取综合治疗以改善心肌缺血[32]。
心肌梗死后长期按冠心病二级预防治疗对降低总死亡率和心源性猝死(SCD)均十分重要。LVEF≤40%的患者,推荐完全血管重建联合最佳药物治疗后6~12周重新检测LVEF,以评价ICD一级预防的潜在需求。梗死范围及微血管阻塞是STEMI幸存者长期死亡率和心力衰竭的预测因素。STEMI后≥40 d或血运重建90 d后ICD治疗的适应证依据LVEF和NYHA心功能分级。如LVEF仍≤0.35且NYHAⅡ或Ⅲ级,或无论症状如何但LVEF≤0.30,推荐ICD治疗[1,2]。STEMI晚期、恢复期心脏再同步治疗(CRT)的适应证包括残留左心室功能不全、NYHA心功能分级、QRS间期和LBBB形态。
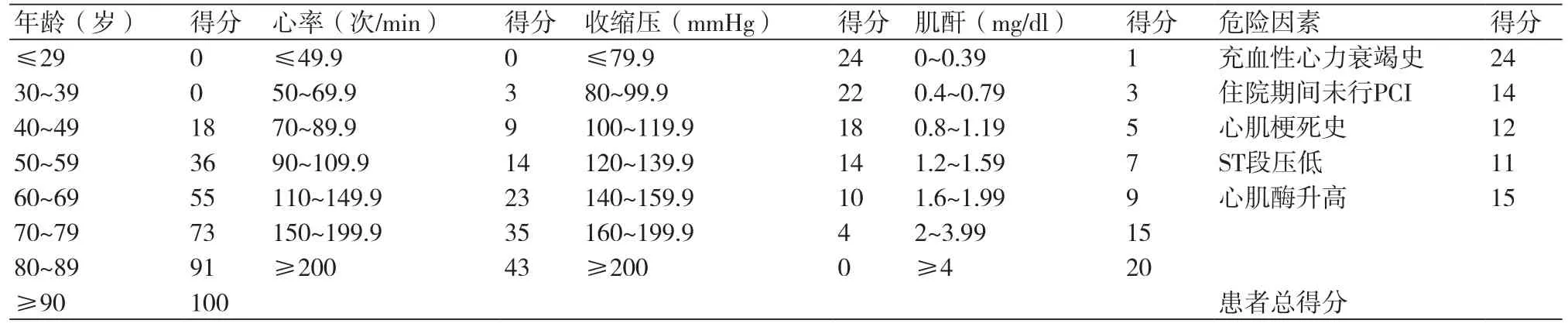
表6 GRACE出院后6个月死亡风险评分表
2018年欧洲心脏病学会(ESC)晕厥诊断和治疗指南建议[33]:由于室上性心动过速(SVT)或VT导致晕厥的患者,适宜导管消融预防晕厥再发(ⅠB);由于VT和LVEF≤35%导致晕厥的患者,宜ICD治疗(ⅠA);既往心肌梗死合并晕厥患者,当电生理检查诱发VT 时宜ICD治疗(ⅠC);有症状性心力衰竭(NYHA心功能Ⅱ-Ⅲ级)及优化治疗≥3个月后LVEF≤35%,预计良好状态生存1年患者,推荐ICD治疗降低SCD(ⅠA);既往心肌梗死合并不明原因晕厥患者,可诱发持续性单形性VT建议按室性心律失常指南治疗(ⅠB)。既往心肌梗死而LVEF保留的患者,出现可诱发的持续性单形性VT强烈预示晕厥的原因;而可诱发的VF认为非特异性表现;无诱发的室性心律失常确定为心律失常性晕厥低危组。
4.2 残余心肌功能的评估仅处理了IRA病变的多支血管病变患者,或晚期就诊的STEMI患者,评价残余心肌缺血或心肌存活可能获益。心肌梗死急性事件后几天就诊的患者,出现反复心绞痛或明确心肌缺血,以及大面积区域心肌存活,可有助于确定闭塞IRA的计划血管重建策略,尽管证据有争议[1]。多支血管病变患者非IRA病变应在出院前进行处理,即完全血管重建治疗。但未解决的争议将是指导PCI的最佳标准(冠脉造影、FFR、斑块易损性评价),如适宜则完全血管重建的最佳时机(直接PCI同期或分期,包括住院期间分期处理与出院后分期处理)。
检查残余心肌缺血和心肌存活的最佳影像技术[超声心动图、单光子发射计算机化断层显像(SPECT)、CMR或PET]和时机无法判断,但也取决于当地医院的可用性和经验。得到最好验证和广泛使用的检查为负荷超声心动图和SPECT(都与运动和药物负荷试验结合),但PET和CMR同样适宜。心肌梗死后患者,超声心动图检查残留心肌缺血具有挑战性,由于已存在的室壁运动异常。晚期钆增强心脏磁共振(LGE-CMR)显像对评价透壁心肌瘢痕组织具有较高诊断准确性。但检查心肌存活的性能和预测室壁运动恢复并不优于其他影像检查。对缺血性左室功能障碍的患者,LGE-CMR出现功能障碍的存活心肌是死亡的独立预测因素。
最近发现,出现室壁变薄及有限瘢痕负荷时,血管重建后收缩改善及室壁变薄缓解,强调除室壁厚度外心肌存活的重要性及心肌血管重建改善预后。PET也是高分辨率的技术,但由于其价格和获得性而使应用受限。一项随机PET显像临床试验显示,存在大量功能障碍但存活心肌的患者可能受益于心肌血管重建治疗,以及显示局部和整体收缩功能、症状、活动耐量和长期预后改善。心肌存活和血管重建后生存改善的相关性也得到荟萃分析证实[1]。
4.3 风险评分指导的左主干和多支血管病变的处理策略STEMI多支血管病变患者血流动力学稳定时,择期完成非梗死相关动脉的PCI,也可考虑直接PCI同期完成非IRA的PCI。2018年欧洲血运重建指南对慢性心力衰竭和左室功能障碍患者推荐[5]:多支血管病变同时手术风险可接受的患者,CABG推荐为首选的血管重建策略选择(ⅠB)。单支或双支冠脉病变的患者,当PCI可获得完全血管重建时,应考虑为CABG的替代治疗(ⅡaC)。三支病变的患者,依据患者冠脉解剖、血管重建预期完全化、糖尿病及伴发病的评估,PCI应行心脏团队决策(ⅡaC)。NYHA心功能Ⅲ-Ⅳ级、巨大左心室壁瘤、巨大左室血栓形成、或室壁瘤为心律失常起源的患者,应考虑CABG中同时行左室壁瘤切除(ⅡaC)。
风险-获益评估是对患者进行血运重建治疗决策的基础。运用危险评分可以预测心肌血运重建手术病死率或术后主要不良心脑血管事件(MACCE)发生率,指导医师对患者进行风险分层,从而为选择适宜的血运重建策略提供参考。常用的危险评分系统包括SYNTAX评分[34]和SYNTAXⅡ评分系统[35],欧洲心脏手术风险评估系统Ⅱ(EuroSCOREⅡ)[36],美国胸外科医师协会(STS)风险评分[37]。
对左主干和(或)前降支近段病变、三支病变的患者,CABG还是PCI仍有争议,建议对上述患者,根据SYNTAX评分和SYNTAX Ⅱ评分评估中、远期风险,选择合适的血运重建策略。SYNTAX评分系统[34]对冠脉病变数量、功能影响、位置和复杂性11项特点进行定量评价,预测因素包括冠状动脉分布优势类型、狭窄部位、是否完全闭塞、三叉病变、双分叉病变、主动脉相关开口病变、严重扭曲、病变长度>20 mm、严重钙化、血栓、弥漫病变/小血管病变。SYNTAX具体评分方法见文献,于www.syntaxscore.com网站计算积分。依据SYNTAX积分欧洲指南推荐,CABG对所有左主干病变均为ⅠA推荐;而PCI对左主干病变SYNTAX评分≤22分患者为ⅠA推荐,左主干病变SYNTAX评分23~32为ⅡaA推荐,左主干病变SYNTAX评分>32为ⅢB推荐。CABG对所有三支病变患者均为ⅠA推荐;而PCI对三支病变SYNTAX评分≤22无糖尿病者为ⅠA推荐而合并糖尿病者为ⅡbA,三支病变SYNTAX评分>22患者PCI为ⅢA推荐[5]。SYNTAX评分不适宜于既往心脏手术,合并严重疾病,虚弱,或不能活动而禁忌CABG等预计死亡率高的患者。SYNTAXⅡ评分包括8项预测因素:SYNTAX积分、年龄、肌酐清除率、LVEF、无保护左主干病变、周围血管疾病、女性、慢性阻塞性肺部。SYNTAXⅡ具体评分方法见文献,于www.syntaxscore.com网站分别计算CABG和PCI积分,预测患者行CABG或PCI各自四年死亡率[35]。虽然文献强调SYNTAXⅡ较SYNTAX评分系统更好预测左主干和复杂三支病变血运重建的远期死亡率;但中国指南推荐SYNTAXⅡ评价CABG和PCI策略均为ⅡaB,而SYNTAX评分对指导CABG和PCI策略均为ⅠB[4]。
EuroSCORE Ⅱ评分系统18项预测因素包括年龄、性别、肾功能损伤、外周动脉疾病、严重活动障碍、既往心脏手术史、慢性肺脏疾病、活动性心内膜炎、术前状态差、正在应用胰岛素治疗的糖尿病、纽约心脏协会(NYHA)心功能分级、加拿大心血管病学学会心绞痛分级、左室功能、近期心肌梗死、肺动脉高压、紧急外科手术、是否为单纯CABG和胸主动脉手术。EuroSCORE Ⅱ具体评分见文献,于www.EuroSCORE.org网站预测心脏术后死亡率,AUC为0.8095[36]。STS风险评分系统是基于美国胸外科医师协会美国成人心脏外科数据库单纯行CABG成人患者建立,众多预测变量筛选用于风险评估,预测手术死亡率和其他8项预后终点(http://riskcalc.sts.org)。在验模人群中,预测手术死亡率的C统计量为0.812,其他终点的C统计量从再次手术的0.653到肾功能衰竭的0.793[37],2018年欧洲血运重建指南推荐,STS风险评分系统用于评价CABG后住院或30 d死亡率,以及住院期间的发病率(ⅠB),推荐力度强于EuroSCOREⅡ评分系统(ⅡbB)[5,38]。
4.4 药物治疗相关风险评价及应对措施STEMI患者急性期后幸存者处于心血管事件发生极高危状态,需要长期二级预防治疗和风险因素控制,以改善患者的生活质量和远期预后。有关长期干预治疗不详细阐述,仅叙述治疗中相关的风险评价。
4.4.1 风险评估指导双联抗血小板治疗STEMI患者无论是否接受早期再灌注治疗,尽早和充分使用快速、强效的抗血小板药物治疗可改善临床预后。对于血栓事件风险相对较高的ACS患者,如糖尿病、慢性肾脏病(CKD)及复杂冠脉病变等,抗血小板治疗首选替格瑞洛(负荷剂量180 mg,维持剂量90 mg 2/d)与阿司匹林联合应用至少12个月。对于≥75岁高龄患者,鉴于其出血风险高,使用替格瑞洛时需评估出血风险。对于已知CYP2C19中间代谢型、慢代谢型的患者,或血小板功能检测提示有残余高反应者,如无出血高危因素,在进行双联抗血小板治疗时应优先选择替格瑞洛。出血高危患者,如近期创伤/手术、凝血功能障碍、活动性或近期胃肠道出血、有活动性病理性出血、颅内出血病史或中-重度肝损害的患者禁用替格瑞洛[39]。
冠脉支架术后双联抗血小板治疗(DAPT)期间最常发生不良事件是自发性出血,随着新型强效抗栓药物的临床使用出血事件进一步增加。PRECISE-DAPT评分系统专门预测DAPT(主要阿司匹林和氯吡格雷)出血事件,可改善风险评价及有助于DAPT决策。5项风险因素预测DAPT患者出院后出血风险,年龄、肌酐清除率、白细胞计数、血红蛋白、出血史,具体积分见图2(或网站www.precisedaptscore.com/predapt/webcalculator.html);总积分从0~100分。出院后出血指首次有创性介入后7 d或以后发生的出血,建模的C统计量0.73。心肌梗死溶栓试验(TIMI)标准的大出血:颅内出血或临床可见出血(包括影像学诊断),伴血红蛋白浓度下降≥5 g/dl;TIMI小出血:临床可见出血(包括影像学诊断),伴血红蛋白浓度下降3~5 g/dL。依据PRECISEDAPT积分高低分为极低危(≤10分)、低危(11~17分)、中危(18~24分)和高危(≥25分), 从极低危到高危患者TIMI大出血或小出血发生率明显增加。PRECISE-DAPT积分≥25分可能获益于短期的DAPT如<12个月(3~6个月);PRECISE-DAPT积分<25分可能获益于接受标准12个月DAPT或12个月以上的DAPT,而并不发生严重出血风险。该模式不适宜于有口服抗凝适应证的患者[40]。
DAPT评分系统[41]是基于2009年8月至2014年5月DAPT随机研究的11 648例患者,开发一种临床工具识别PCI术1年后持续噻吩吡啶类药物治疗获益或有害患者。9项因素可预测PCI后12~30个月缺血(支架血栓或心肌梗死)和出血风险(GUSTO中重度出血),年龄≥75岁计-2分,65-<75岁计-1分,<65岁计0分;当前吸烟计1分;糖尿病计1分;就诊时心肌梗死计1分;既往PCI或心肌梗死史计1分;紫杉醇支架计1分;支架直径<3 mm计1分;充血性心力衰竭或LVEF<30%计2分;静脉移植血管PCI计2分。总积分从-2至+10分。预测缺血和出血风险建模的C统计量分别为0.70和0.68,验模的C统计量均为0.64。DAPT积分≥2分,延长双联抗血小板治疗至30月,可降低缺血事件,而出血事件无明显增加;DAPT积分<2分延长双联抗血小板治疗30个月,缺血事件无明显降低,而出血事件显著增加。
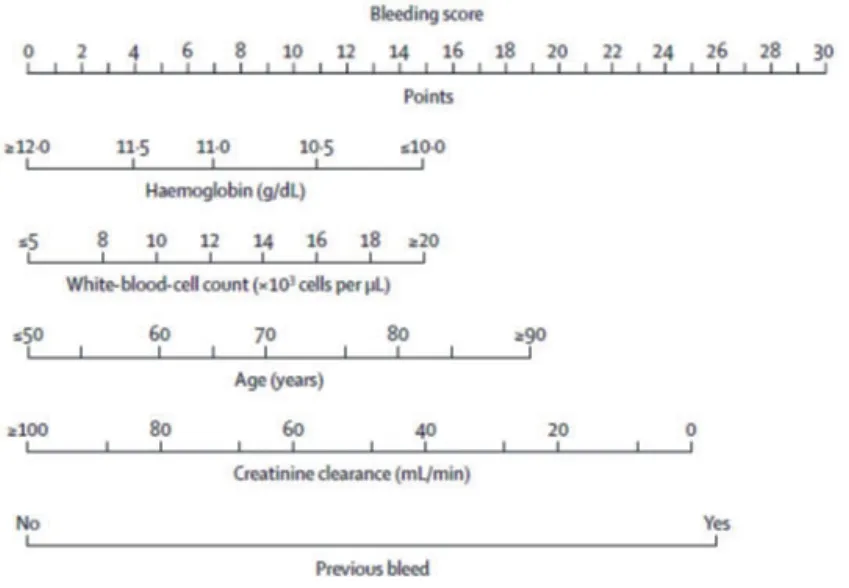
图1 PRECISE-DAPT积分列线图
最近GLASSY研究显示,PCI后阿司匹林与替格瑞洛联合1个月,随后替格瑞洛单药使用23个月方案不劣于传统抗血小板治疗方案。STOPDAPT-2研究[42]显示PCI后阿司匹林联合氯吡格雷治疗1月,其后氯吡格雷单药治疗,1年时较传统治疗组降低出血事件风险,不增加缺血事件。SMARTCHOICE[43]发现PCI后阿司匹林联合一种P2Y12抑制剂(氯吡格雷、替格瑞洛或普拉格雷)3个月,之后P2Y12抑制剂单药使用,不良心血管事件与传统治疗方案无差异,但短期双联抗血小板治疗组出血事件降低。三项研究均为最新一代支架及STEMI患者入组数量有限,虽然这些结果不能简单推广至所有STEMI置入药物支架患者,尚需更多研究论证,但部分患者双联抗血小板治疗的疗程有望缩短,关键是缺血事件风险和出血事件风险及二者间的平衡是确定抗血小板治疗方案的重要依据,如果血栓事件风险很高而出血风险很低,则双联抗血小板治疗延长至1年以上或许更多获益。
2019年欧洲慢性冠脉综合征诊治指南推荐[44],对缺血事件高危而无出血高危特征的患者,应考虑阿司匹林加用另一种抗栓药物(包括氯吡格雷75 mg 1/d;普拉格雷10 mg 1/d,如体重<60 kg或年龄>75岁则为5 mg 1/d;利伐沙班2.5 mg 2/d;替格瑞洛60 mg 2/d)作为长期二级预防治疗(ⅡaA);对至少合并一项中等增加缺血事件的风险因素而无出血高危特征的患者,可考虑阿司匹林加用另一种抗栓药物作为长期二级预防治疗(ⅡbA)。缺血事件高危风险特征为:弥漫多支冠脉病变合并至少一项如下因素:药物治疗的糖尿病、复发性心肌梗死、外周动脉疾病(PAD)、CKD者估算的肾小球滤过率(eGFR)为15~59 ml/min/1.73 m2。中危缺血事件风险特征为合并至少一项下列因素:多支或弥漫冠脉病变、药物治疗的糖尿病、复发性心肌梗死、PAD、HF或CKD者eGFR为15~59 ml/min/1.73 m2。出血高危风险为:脑出血或缺血性卒中史、其他颅内疾病史、近期胃肠出血或可能由于胃肠出血导致的贫血、其他胃肠疾病导致出血风险增加、肝功能衰竭、出血素质或凝血功能障碍疾病、高龄或虚弱、肾功能衰竭需透析或eGFR<15 ml/min/1.73 m2。
4.4.2 合并非瓣膜病房颤患者的风险评估和抗栓治疗指导高达21%的STEMI患有房颤。房颤可能既往存在,首次检出或新发。房颤具有血栓栓塞风险的患者,应长期口服抗凝药物(OAC)治疗。STEMI急性期明确新发房颤患者,应依据CHA2DS2-VASc积分长期口服抗凝治疗,同时考虑联合抗栓治疗(ⅡaC)[1]。2018美国胸科医师协会关于房颤抗栓治疗指南和专家组报道[45],对非瓣膜病房颤合并CHA2DS2-VASc一项非性别风险因素患者,建议口服抗凝治疗优于不治疗、单纯阿司匹林、或阿司匹林联合氯吡格雷。对脑卒中高风险的患者(如男性CHA2DS2-VASc≥2分或女性≥3分)推荐口服抗凝治疗优于不治疗、单纯阿司匹林、或阿司匹林联合氯吡格雷;并建议使用新型口服抗凝药物。故STEMI合并房颤患者应行抗凝治疗。注意每次就诊时纠正出血风险因素,HAS-BLED用于评价出血风险,重视≥3分的高出血风险患者并密切随访,防止出血事件。
具有抗凝适应证的房颤患者合并ACS,同时接受PCI或支架的抗栓治疗,2018年美国胸科医师协会关于房颤抗栓治疗指南和专家组报道推荐[45]。如果ACS或支架血栓风险高,出血风险相对低(HAS-BLED积分0-2分),建议三联抗栓治疗6个月,随后OAC联合一种抗血小板药物(最好氯吡格雷)的双联抗栓治疗至12个月。如果出血风险高(HASBLED积分≥3分),建议三联抗栓治疗1~3个月,随后OAC加一种抗血小板药物(最好氯吡格雷)的双联抗栓治疗至12个月。如果出血风险很高,而血栓风险低,建议OAC加一种抗血小板药物(最好为氯吡格雷)双联抗栓治疗6~9个月,随后可OAC单药治疗。12个月后所有患者可OAC单药治疗。AUGUSTUS研究[46]为阿哌沙班对华法林和阿司匹林对安慰剂的2×2因子随机双盲试验,结果表明近期ACS或支架置入合并房颤患者阿哌沙班联合氯吡格雷治疗6个月能明显降低出血风险,但不增加血栓事件。出血风险很高的患者可能包括HAS-BLED≥3分合并近期急性出血事件患者;高血栓风险可能包括左主干支架,或多支PCI或支架等患者。欧洲指南推荐男性患者CHA2DS2-VASc≥1分,女性≥2分,卒中预防可能获益,同时抗栓药物类型和持续时间的具体决策应依据临床情况和患者特征(如择期PCI或ACS,冠脉疾病进展风险因素,冠脉事件,出血风险),以及可能结合患者意愿[47]。目前证据支持新型口服抗凝药联合一种P2Y12抑制剂的双联抗栓治疗为房颤患者PCI后的首选方案;通常应避免使用传统的三联抗栓治疗,即VKA联合双联抗血小板治疗(阿司匹林加一种P2Y12抑制剂)。
慢性冠脉综合征合并房颤患者,PCI无并发症,如果支架血栓风险低或出血风险考虑强于支架血栓风险,无论支架类型如何均考虑早期(≤1周)停用阿司匹林,随后持续口服抗凝药和氯吡格雷双联抗栓治疗;对支架血栓风险中或高危患者,无论支架类型如何,可口服抗凝药联合替格瑞洛或普拉格雷双联抗栓治疗替代口服抗凝药、阿司匹林和氯吡格雷的三联抗栓治疗[44]。不推荐使用替格瑞洛或普拉格雷联合阿司匹林和口服抗凝药物的三联抗栓治疗(Ⅲ C)。
CHA2DS2-VASc评分在世界范围用于房颤卒中和血栓栓塞风险分层,也用于房颤合并冠心病支架治疗的患者。充血性心力衰竭或左室收缩功能障碍计1分,高血压计1分,年龄≥75岁计2分,糖尿病计1分,卒中或短暂脑缺血发作(TIA)或血栓栓塞症计2分,血管疾病(既往心肌梗死、外周动脉疾病或主动脉斑块)计1分,年龄65~74岁计1分,性别(女性)计1分,共9分。随积分增加栓塞发生率升高,C统计量0.606。从0分到最高9分,1年的血栓栓塞发生率分别为0%、1.3%、2.2%、3.2%、4.0%、6.7%、9.8%、9.6%、12.5%和15.2%。高血压为血压持续高于140/90 mmHg或药物治疗的高血压。缺血性卒中定义为突发局灶性神经功能缺损,由神经科医生诊断、持续>24 h并由缺血导致。TIA为突发局灶性神经功能缺损,由神经科医生诊断、持续<24 h。外周血管栓塞为脑部、心脏、眼部和肺脏外的血栓栓塞症。肺栓塞由主管医生诊断。血栓栓塞事件标准定义为缺血性卒中,外周血管栓塞或肺栓塞[48]。
HAS-BLED是基于2003~2004年欧洲心脏调查(EHS)5333例房颤患者,开发一种适用性风险模式预测真实世界房颤患者1年严重出血风险(包括大出血和出血性卒中)。未控制高血压,收缩压>160 mmHg计1分;肾功能异常计1分,为慢性肾透析、肾移植或血清肌酐≥200 μmol/L;肝功异常计1分,为慢性肝病(如肝硬化)、或生化检查肝功明显异常(如胆红素>正常上限2倍,相关的天冬氨酸转氨酶或丙氨酸转移酶或碱性磷酸酶升高>正常上限3倍等);卒中计1分,卒中史,尤其腔隙性卒中;出血史或出血性素质计1分;国际标准化比值(INR)不稳定[如,治疗目标范围时间(TTR)<60%]计1分;年龄>65岁计1分;联合使用药物如抗血小板药物、非甾体抗炎药物(NSAIDs)计1分;过渡饮酒(每周饮酒≥8个单位)计1分;共9分。随着积分升高1年大出血发生率增加,建模C统计量为0.72;单纯抗血小板人群C统计量为0.91。1年出血率,0分为0%,1分为1%,2分为2%,3~4分为6%,5~6分为16%,没有患者评分达到>6分。大出血定义为出血需要住院和(或)导致血红蛋白降低>2 g/L和(或)需要输血,但非出血性卒中。出血性卒中定义为突发局灶性神经功能缺损,由神经科医生诊断、持续>24 h并由出血导致[49]。
近日一项丹麦的国家级注册研究纳入了272 315例平均年龄75岁的房颤患者,总随访时间达1 373 131例·年。研究发现双联抗血小板治疗、维生素K拮抗剂加一种抗血小板药物的双联治疗和新型口服抗凝药物加一种抗血小板药物的双联治疗的出血风险分别是单联维生素K拮抗剂的1.13、1.82和1.28倍;而三联治疗中,维生素K拮抗剂和双联抗血小板治疗的出血风险是单联维生素K拮抗剂的3.73倍(95%CI:3.23~4.31),新型口服抗凝药物和双联抗血小板治疗为2.28倍(95%CI:1.67~3.12)。亚组分析结果显示,三联抗栓治疗的患者中,出血风险最高的患者为年龄>90岁(IR 22.8/100 人·年)或CHA2DS2-VASc评分>6分(IR 17.6/100 人·年)或既往有大出血事件病史(IR 17.5/100人·年)的患者[50]。
4.4.3 高胃肠出血风险者的用药指导胃肠出血高风险患者,推荐一种质子泵抑制剂(PPI)联合DAPT(ⅠB);如胃肠出血史,抗凝治疗,慢性非甾体抗炎药或糖皮质激素使用者,以及≥2项或更多下列因素者:年龄≥65岁、消化不良、胃食管反流性疾病、幽门螺杆菌感染、慢性酗酒[1]。2019年欧洲慢性冠脉综合征诊治指南推荐,服用阿司匹林单药、双联抗血小板药物、或口服抗凝药单药治疗的患者,如处于胃肠出血高风险状态,推荐同时使用一种PPI。
4.4.4 血脂管理相关风险评估和指导用药胆固醇管理的临床获益除取决于LDL-C降低的程度外,动脉粥样硬化性心血管疾病(ASCVD)风险越高的患者获益越明显。2018年AHA/ACC胆固醇临床实践管理指南强调[51]风险评估,个体化治疗。对临床明确诊断为ASCVD患者,应使用高强度或最大耐受量他汀治疗;LDL-C降低越明显随后风险降低越大;使用最大耐受量他汀使LDL-C水平降低≥50%。对既往多次严重ASCVD事件或既往1次严重ASCVD事件合并多项高风险因素的最高危患者,最大耐受量他汀治疗时仍然LDL-C≥70mg/dl(1.8 mmol/L)则他汀治疗基础上加用依折麦布是合理的;最大耐受量他汀和依折麦布治疗时LDL-C仍≥70 mg/dl(1.8 mmol/L),加用一种前蛋白转化酶枯草杆菌蛋白酶9(PCSK9)抑制剂是合理的。严重ASCVD事件包括:近12个月ACS,既往心肌梗死史(非近12个月ACS),缺血性卒中史,有症状的外周动脉疾病(既往间歇性跛行合并踝肱指数<0.85,或既往外周动脉血管重建治疗或截肢)。高风险因素包括:年龄≥65岁,杂合子家族性高胆固醇血症,主要ASCVD事件外的CABG或PCI史,糖尿病,高血压,慢性肾脏病(eGFR 15~59 ml/min/1.73 m2),目前吸烟,既使使用最大耐受量他汀和依折麦布治疗LDL-C持续≥100 mg/dl(≥2.6 mmol/L),充血性心力衰竭史。缺血性心脏病导致射血分数降低心衰(HFrEF)患者未使用他汀治疗,预计有合适的寿命(3~5年),考虑启动中等强度他汀治疗以降低ASCVD事件的发生率。
2019年欧洲血脂异常管理指南推荐[52],对极高危患者的二级预防,推荐LDL-C从基线降低≥50%以及LDL-C靶目标<1.4 mmol/L(<55 mg/dl);ASCVD患者,在服用最大耐受量他汀期间的2年内发生第二次血管事件(不需与第一次事件相同),考虑LDL-C靶目标<1.0 mmol/L(<40 mg/dl)。该文档极高危患者包括下列患者:既往ACS(心肌梗死或不稳定型心绞痛),稳定型心绞痛,冠脉血管重建术(PCI、CABG、其他动脉血管重建术),卒中,TIA,周围血管疾病或家族性高胆固醇血症合并ASCVD。而未控制的高血压和血管脆弱患者更低的LDL-C脑出血风险似乎增加。
5 结语
风险评估指导的STEMI治疗,有利于选择最佳的治疗方案,降低死亡率,改善预后;但风险评估需动态进行,不断纠正风险因素及评估,以达到最佳预后。同时风险评估模式不可能包含患者的所有风险信息,需结合临床并在治疗时结合患者意愿,必要时需多学科共同决策。
