干扰素α1b注射液雾化吸入治疗小儿病毒性肺炎的剂量效应研究
2020-03-20卓华升
卓华升
(汕头潮南民生医院儿科,广东 汕头 515144)
病毒性肺炎是小儿常见的呼吸系统疾病,病原菌包括呼吸道合胞病毒、腺病毒和流感病毒等,其中以呼吸道合胞病毒肺炎最为多见,约占小儿肺炎的50%。由于小儿免疫抵抗较差、病情易进展,严重时可导致心衰、呼吸衰竭甚至休克,危害患儿的身心健康和生命安全。以往临床处理以对症治疗为主,但患儿症状体征缓解效果较慢、临床疗效欠佳[1-2]。重组人干扰素α1b(IFNα1b)是我国第一个基因工程I类新药,随着医学对IFNα1b的基因来源、分子结构、作用机制以及安全性试验的研究不断完善,在儿科尤其是呼吸道感染方面的应用逐渐受到重视,根据IFNα1b的理化性质,多推荐以雾化吸入的形式给予治疗[3]。但IFNα1b临床具体应用中给药剂量存在较大差异,不同IFNα1b给药剂量和临床疗效有无量效关系尚需大量研究探讨。笔者查阅文献发现,目前关于IFNα1b雾化吸入治疗小儿病毒性肺炎的报道尤其是剂量效应的报道较少,据此本研究随机选取84例患儿开展双盲研究,探讨IFNα1b在小儿病毒性肺炎的临床疗效,观察不同剂量IFNα1b和疗效的关系。现报告如下。
1 资料和方法
1.1一般资料选取本院儿科2017年3月2019年3月收治的84例病毒性肺炎患儿,纳入标准:(1)有发热、头痛、乏力、咳嗽等临床表现,结合胸部X线检查符合《儿童社区获得性肺炎管理指南》(2013年修订)[4]的诊断标准;(2)年龄范围6个月~5岁,发病至入院间隔时间≤3 d;(3)患儿监护人签署研究知情同意书。排除合并先心病、免疫缺陷、肺结核或细菌性肺炎。将84例呼吸道合胞病毒肺炎患儿随机分为对照组(n=30)和观察组(n=54),对照组男17例,女13例;年龄6个月~5岁,平均(2.76±0.62)岁;发病时间10~72 h,平均(29.84±7.53) h。观察组男31例,女23例;年龄6个月~5岁,平均(2.74±0.60)岁;发病时间11~74 h,平均(30.24±7.39)h。两组患儿资料分布均衡,差异均无统计学意义(P>0.05)。进一步将观察组分为观察A组(n=27)和观察B组(n=27),观察A组男16例,女11例;年龄6个月~5岁,平均(2.75±0.60)岁;发病时间14~70 h,平均(30.35±7.23) h。观察B组男17例,女10例;年龄6个月~5岁,平均(2.73±0.57)岁;发病时间12~72 h,平均(30.13±7.16) h。观察A、B组患儿资料比较,差异亦无统计学意义(P>0.05)。本研究获得医院伦理委员会批准。
1.2方法对照组给予抗病毒、抗感染、止咳化痰、平喘、退热、保持呼吸道通畅和纠正水电解质平衡紊乱等基础对症治疗,注意隔离,避免误用或滥用碱性药物等。观察组在对照治疗基础上给予IFNα1b(商品名:运德素;北京三元基因工程有限公司;国药准字S20010008;规格:30 μg/支)雾化吸入治疗,其中观察A组、B组给药剂量分别为1.0 μg·kg-1和2.0 μg·kg-1,持续时间15 min/次,bid,均持续治疗7 d。
1.3研究指标记录各组患儿发热、咳嗽和肺部啰音等症状体征消失时间以及住院时间;参考《儿童社区获得性肺炎管理指南》(2013年修订)评估临床疗效,根据症状体征缓解情况评定为显效、有效和无效,总有效率=(显效+有效)/总数×100%。记录组间患儿治疗期间不良反应发生情况。
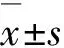
2 结 果
2.1不同组间患儿临床症状体征消失时间及住院时间比较观察组发热、咳嗽、肺部湿啰音消失时间及住院时间均短于对照组,差异有统计学意义(P<0.05);观察组不同剂量亚组比较,上述指标差异均无统计学意义(P>0.05),见表1。
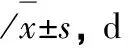
表1 不同组间患儿主要临床症状体征消失效果比较
2.2不同组间患儿总有效率和不良反应率比较与对照组比较,观察组临床总有效率明显较高,差异有统计学意义(P<0.05),两组不良反应包括疲劳、食欲下降等,症状较轻,停药后恢复,血生化检查、肝肾功能检查均无异常改变,组间不良反应率比较,差异无统计学意义(P>0.05);观察组不同剂量亚组间比较,临床总有效率和不良反应率差异均无统计学意义(P>0.05),见表2。
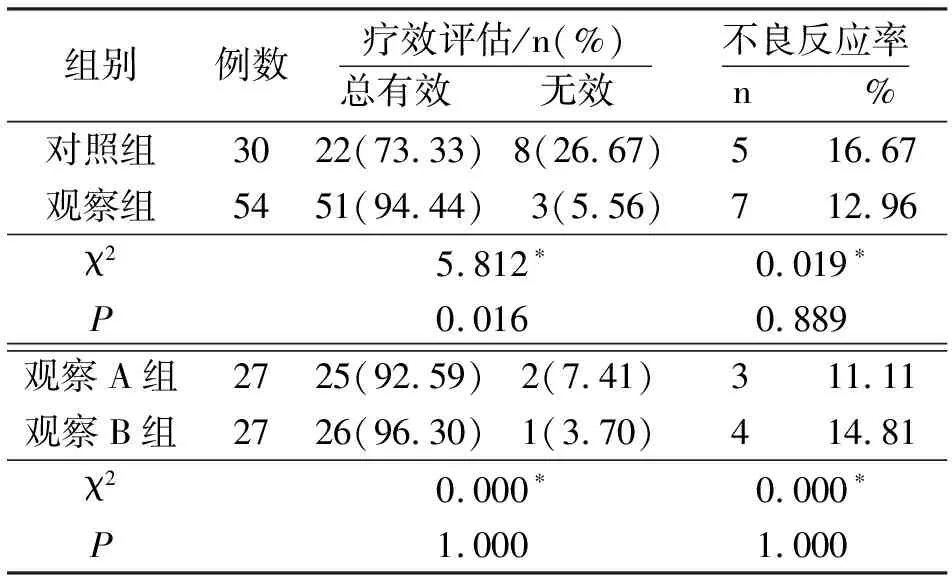
表2 不同组间患儿临床总有效率和不良反应率比较
注:*表示不满足卡方检验前提,改用校正卡方检验计算。
3 讨 论
小儿病毒性肺炎确诊后,尽快清除病毒和缓解症状体征是临床治疗的关键。阿昔洛韦和利巴韦林均是常规抗病毒药物,对清除患儿体内病毒、消除体内T细胞抑制和提高CD3、CD4、CD4/CD8水平效果较好,但小儿体质娇嫩,上皮细胞比较脆弱,对药物的耐受性较差,临床治疗不良反应较多,比如皮疹、荨麻疹、关节疼痛甚至溶血性贫血等,因此应用比较谨慎,目前临床已较少使用[5]。IFN具有抗病毒、调节机体免疫功能等生物活性的广谱抗病毒药物,其抗病毒作用机制是通过细胞表面受体作用使细胞产生抗病毒蛋白,抑制病毒的复制,改善免疫抑制和降低机体炎症反应,进而快速改善患儿症状体征,实验室检查可见血清CD3+T细胞(%)、CD4+T细胞(%)明显升高,CD8+T(%)细胞显著下降。有报道[6]指出IFN治疗小儿呼吸道感染效果显著,可缩短发热、咳嗽等症状缓解时间,降低白介素-18(IL-18)、肿瘤坏死因子-α(TNF-α)等炎性因子水平,促进病情康复。
IFNα1b目前在儿科临床应用的价值受到重视,尤其适用于小儿病毒性肺炎、病毒性肝炎、疱疹性咽峡炎和手足口病等疾病,具有疗效明显和安全性高等优点[7]。从基因来源深入评价,IFNα作为人体天然免疫的关键成员,是机体抗病毒感染的第一道防线,IFNα1是IFNα的重要成员,包括α1a、α1b、α1c 3个主要等位基因型,其中以α1b的基因同源性最高,代表性最强,因此从基因来源角度而言,决定了IFNα1b的天然优势。从抗病毒作用机制评价,小儿病毒性肺炎的免疫功能发育欠充分,需要补充外源IFN,IFNα1b通过与细胞膜上的IFN受体IFN R1/R2相结合等途径,激活转录STAT1和STAT2的信号转导通路,同时与IRF9结合形成IFN刺激因子复合物,诱导蛋白激酶等多种抗病毒蛋白的合成,能减轻细胞的病毒感染状态和抑制感染病毒的复制,激活细胞免疫和清除感染病毒[8-9]。随着IFNα1b基因学、分子结构学和免疫学等多个角度作用机制研究的不断深入,IFNα1b的病毒性传染病的防治价值愈发凸显,但同时关于其雾化吸入的最佳给药剂量尚无明确定论,已有报道[10]仅显示IFNα1b耐受性研究显示安全剂量为0.3~2.0 μg·kg-1,由于小儿未能高效的配合雾化,因此临床应用剂量多为1.0~2.0 μg·kg-1。本研究显示,观察组患儿发热、咳嗽和肺部湿啰音消失时间较对照组明显缩短,临床总有效率明显升高,验证了IFNα1b治疗小儿病毒性肺炎的显著作用。但不同剂量IFNα1b亚组比较显示,观察A、B组的疗效和不良反应率并无明显差异,和文献报道[11-12]结论相吻合,提示IFNα1b剂量和临床疗效可能不存在量效关系,相比小剂量雾化吸入IFNα1b,增加给药剂量并不能让患儿获益。
综上所述,IFNα1b治疗小儿病毒性肺炎疗效肯定,但临床疗效方面并不存在IFNα1b剂量效应,临床实际中根据患儿个体情况和病情缓解需要,建议给予小剂量IFNα1b治疗。
