BDNF/TrkB信号通路与神经病理性疼痛的关系研究
2020-03-20薛梦,黄诚
薛 梦,黄 诚
(赣南医学院 1.2017级硕士研究生;2.基础医学院;3.疼痛医学研究所,江西 赣州 341000)
自从德国神经生物学家Barde及其同事在猪脑中提取到脑源性神经营养因子(Brain-derived neurotrophic factor, BDNF)后,在这之后的数十年里,科学家们陆续发现与BDNF相关受体,以及通过激活其上下游信号分子参与神经元的发育、分化、凋亡和增殖等生理学过程,这证明了BDNF在医学上有着极其重要的调控作用[1]。此外,一些学者也发现BDNF与其相关受体在神经系统疾病,比如癫痫、抑郁、脑缺血、阿尔兹海默症以及帕金森综合征中发挥着至关重要的作用。同时,对BDNF在脑肿瘤、视网膜病变以及神经肌肉病变的作用也进行了较深入研究[2-4]。近年来,BDNF/TrkB信号通路参与慢性疼痛的调控作用也越来越受到更多的关注。诸多证据表明,神经病理性疼痛(Neuropathic pain, NP)是影响患者生存质量的一个全球性问题,它是由躯体感觉神经系统的损伤和疾病所引发的一种慢性病理性疼痛。有实验显示BDNF可影响突触可塑性以及轴突生长,提示其对神经病理性疼痛有着重要的作用。在脊髓水平,BDNF/TrkB信号通路可通过N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor, NMDAR)诱导脊髓背角神经元的过度兴奋以及去γ-氨基丁酸(γ-aminobutyric acid,GABA) 的抑制效应,进而引发慢性疼痛[5-6]。缘由神经病理性疼痛的病理生理机制极其复杂,有证据表明,疼痛的情绪和记忆可引起患者的抑郁、焦虑和睡眠障碍等功能变化,并且在与这些情绪和记忆相关的脑区,研究发现BDNF/TrkB信号分子的表达有着明显的改变,这进一步揭示了BDNF/TrkB与高级神经中枢有着密切关系[7-8]。随后的实验发现,BDNF在大脑和脊髓水平的表达有着截然不同的情况,这也强烈提示BDNF/TrkB信号通路在神经病理性疼痛发生发展中的重要性和复杂性。
1 BDNF/TrkB信号通路的生物学特性
BDNF是神经营养因子家族的重要一员,此外,还有神经生长因子NGF、NT-3和NT-4/5等[9]。如图1所示,神经营养因子多与原肌球蛋白受体激酶(tropomyosin receptor kinase, Trk)家族结合,其中研究最广泛的NGF主要与TrkA受体结合,而NT-4/5与TrkB受体结合,NT-3主要与TrkC受体结合,也可与TrkA受体结合,而BDNF主要与高亲和力受体TrkB结合,并且通过激活下游的磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinases, PI3K)/蛋白质丝氨酸苏氨酸激酶(protein-serine-threonine kinase, AKT), Ras-Raf-MEK-ERK和磷脂酶C-γ(phospholipase C-γ, PLC-γ)信号通路对神经元存活、分化和突触可塑性产生影响[1]。已有实验证明,BDNF有两种蛋白水解形式,分为前体BDNF(proBDNF)和成熟BDNF(mBDNF),分子量约30 kD的前体BDNF在纤溶酶等作用下可裂解成分子量约13 kD的成熟BDNF[10]。而前体BDNF与成熟BDNF在神经系统中有着不同的生理学作用。前体BDNF能与低亲和力受体p75结合诱导神经元的死亡,而成熟BDNF与TrkB受体结合可诱导神经元的存活[1,10]。近年来,BDNF基因在一些神经系统疾病领域的研究也得到了长足的发展。BDNF基因主要位于人类11号染色体11p13,且拥有多个基因多态性位点,而其中Val66Met基因多态性引起了众多关注。比如,Val66Met多态性在焦虑、抑郁、老年痴呆症和三叉神经痛等神经系统疾病中有着重要的作用[8,11-13]。随后有学者发现,BDNF基因启动子的去甲基化可通过背根神经节(Dorsal root ganglion,DRG)参与调节大鼠痛敏行为的变化[14],这提示在表观遗传学上BDNF基因与疼痛有着密切关系。
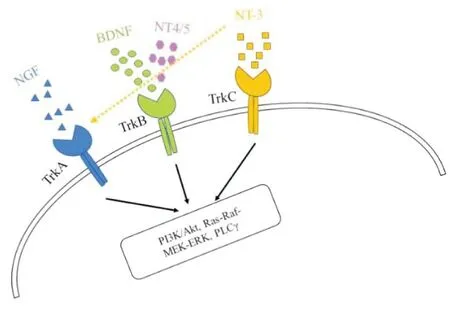
图1 神经生长因子及其受体
2 BDNF/TrkB信号通路与神经病理性疼痛
关于BDNF/TrkB信号通路是如何参与神经病理性疼痛的调制作用?有研究表明,外周神经损伤后背根神经节的BDNF通过释放进入脊髓背角浅层,与脊髓背角中散在的TrkB受体结合,进而激活Glu2B-NMDAR介导的脊髓背角神经元的过度兴奋[15-16]。同时,脊髓背角中的三磷酸腺苷(ATP)介导的P2X4受体(P2X4 receptor, P2X4R)通过激活小胶质细胞,导致小胶质细胞内BDNF的释放,进而参与NDMA受体介导的中枢敏化作用。在此过程中,BDNF的释放与脊髓背角Ⅰ层神经元上的TrkB受体结合,活化的TrkB受体通过下调氯化钾共转运蛋白KCC2,致使细胞内Cl-增加,减弱GABA能神经元的抑制作用, 形成GABA受体的去抑制作用,从而进一步加强了伤害性信息的反应[6,15-16]。在神经病理性疼痛的外周机制中,目前认为神经损伤后,在中小直径的背根神经节中合成的BDNF被顺行地转运到脊髓背角的中央末端,并在神经元被激活后释放出来[17],但有关背根神经节中BDNF的表达与神经病理性疼痛的关系还有待进一步探索。由于受损神经的周围出现的神经修复和髓鞘再生与神经病理性疼痛密切相关[18],其发生机制是什么?前期研究发现,神经损伤后雪旺细胞的P2X4受体过表达,进而经过BDNF/TrkB信号通路来促进运动和感觉功能的恢复以及髓鞘再生[19]。同时,其他学者也进一步论证了BDNF在受损伤神经的背根神经节中可促进神经的再生[20-22]。
近年来,Claire E等[23]的实验证明BDNF的 Val66Met基因多态性也具有促进周围神经损伤的轴突再生能力,而且有关BDNF的Val66Met基因在周围神经损伤的活动性依赖治疗以及再生能力的研究也得到了广泛关注[24-25]。有证据表明,背根神经节的BDNF可通过全长的TrkB受体来抑制BDNF依赖性的神经元髓鞘生成,与低亲和力受体p75结合发挥神经保护作用[26]。有实验显示,给培养的DRG神经元增加BDNF浓度后,可明显增强NMDA电流幅度,并且诱导脊髓背角小胶质细胞的激活。但是,由于在背根神经节神经元上的全长的TrkB表达很少,因而主要是通过截短的TrkB来发挥作用[27]。这说明BDNF在背根神经节的生理学活动可能与背根神经节上不同受体相结合有关。此外,Uchida等[17]从表观遗传学机制中发现,神经病理性疼痛的维持与背根神经节BDNF外显子I的转录产物上调有关。也有研究[28]表明,在选择性脊神经损伤(Spared Nerve Injury, SNI)模型中,不同脊髓节段的背根神经节的BDNF表达虽然不同,但均与神经病理性疼痛密切相关,比如,L3背根神经节的BDNF蛋白表达增加,而L4背根神经节的BDNF蛋白表达无明显变化,L5背根神经节的BDNF蛋白则表达减少,这些可能与SNI模型截断的胫神经、腓总神经以及腓肠神经传入的背根神经节的节段不同有关,导致受损神经的DRG神经元的BDNF上调,而未受损神经的DRG神经元的BDNF下调,最终共同参与神经病理性疼痛的发生发展[28]。在脊髓水平,神经损伤后,由ATP激活的P2X4受体介导了小胶质细胞BDNF的释放[15,29]。BDNF与脊髓背角神经元的TrkB受体结合后,介导了神经损伤后NMDA受体所诱导的脊髓背角神经元的过度兴奋[5-6,30],进而引起中枢敏化并参与神经病理性疼痛的形成。同时,BDNF/TrkB 信号通路可下调氯化钾共转运蛋白KCC2, 引起去抑制作用[6]。有结果表明,BDNF/TrkB信号通路介导的NMDA受体可通过Fyn激酶介导的GluN2B参与BDNF所诱导的脊髓长时程增强(Long-term potentiation,LTP)和正常大鼠的疼痛超敏反应[5-6]。进一步的研究发现,BDNF/TrkB信号通路具有介导酪氨酸1472处GluN2B亚基的磷酸化(pGluN2BY1472)发挥脊髓长时程增强的作用[5]。
有实验报道小胶质细胞活化后,BDNF/TrkB信号通路在脊髓背角的作用得到增强,作为中枢敏化的标志性产物p-ERK的表达也上调,因此,抑制BDNF-TrkB-ERK信号传导有利于缓解神经病理性疼痛[31]。Lin等[32]也发现,背根神经节的致炎细胞因子TNF-α可上调BDNF/TrkB信号通路,进而促进痛觉过敏。然而,基于靶向NDMA受体的镇痛疗法在临床上还存在严重影响中枢神经系统的副作用,因此,进一步的实验发现,BDNF/TrkB信号通路通过PI3K/Akt来增强酸敏感离子通道1a(acid-sensing ion channel 1a, ASIC1a)活性,从而达到缓解疼痛的作用[33]。而在脑水平,BDNF/TrkB信号通路具有更为复杂的作用机制,且与多种刺激因素相关,比如恐惧、应激和抑郁等各种情绪反应[34-35]。有研究证明,BDNF信号系统在与应激情绪相关的脑区如下丘脑和前额叶皮层中高度表达,并且疼痛的程度会随着应激反应的改变而变化[34,36]。Ge等[35]的研究发现,在糖尿病型神经病理性疼痛合并抑郁症的大鼠模型中,BDNF/TrkB信号通路在大鼠海马上的表达明显减弱。而且BDNF/TrkB信号通路在前扣带回皮层的前喙部(rACC)参与了神经病理性疼痛的厌恶状态[37-38]。随后的实验显示,在前扣带回皮层的前喙部中,BDNF/TrkB信号通路极有可能是通过激活ERK或者mTOR信号分子参与疼痛的厌恶情绪[38-39]。由于BDNF/TrkB信号通路在不同脑区参与疼痛的表现形式极其复杂,而且与多种刺激因素有关,因此,有关这一方面的机制还有待进一步实验加以阐明。
总之,神经损伤后,背根神经节神经元释放的BDNF与脊髓背角的TrkB受体结合,介导NMDA受体诱导的脊髓背角神经元的过度兴奋。与此同时激活KCC2,引起细胞内Cl-增多,从而阻断GABA的抑制作用。而且因为神经损伤可导致脊髓ATP的释放,进而与小胶质细胞P2X4受体结合诱导BDNF的释放。这些因素共同参与了BDNF/TrkB信号通路对神经病理性疼痛的调控作用(图2)。
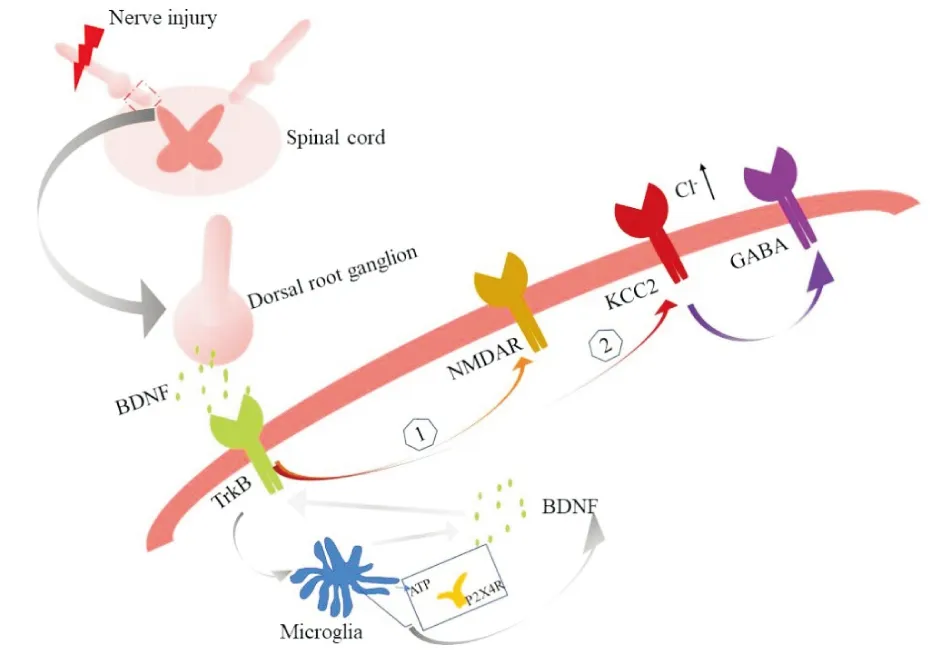
图2 BDNF/TrkB信号通路参与神经病理性疼痛的脊髓机制
3 BDNF/TrkB信号通路介导电针干预神经病理性疼痛的作用
众所周知,电针具有优良的镇痛效果,且因为不良反应少,在临床上有着广泛的应用。目前有关电针镇痛的作用机制,主要是通过阿片受体、神经递质以及一些信号通路或者离子通道、胶质细胞的激活来发挥作用。
有关BDNF/TrkB信号通路在电针治疗神经病理性疼痛的作用愈来愈受关注。比如,Xing等[40]发现2Hz电针对突触可塑性具有调控作用,并介导了神经病理性疼痛的长时程抑制作用。Xue等的实验表明,经电针治疗后,脊神经结扎(Spinal nerve ligation, SNL)模型大鼠的轴突脱髓鞘明显减少[41],这些证据提示电针可通过调节突触可塑性以及促进神经修复来缓解神经病理性疼痛。基于BDNF/TrkB信号通路具有影响突触可塑性、神经生长和修复的作用,因此,电针可能是通过调控BDNF/TrkB信号通路,进而影响突触可塑性和促进神经修复来发挥治疗神经病理性疼痛的作用。
由于神经胶质细胞在神经病理性疼痛发生发展中的重要地位,BDNF/TrkB信号通路通过激活胶质细胞参与神经病理性疼痛的形成得到特别关注。有实验显示,电针可通过抑制脊髓背角小胶质细胞的活化来缓解神经病理性疼痛,这可能与BDNF的表达下调有关[42]。最近有研究发现,电针通过抑制脊髓背角小胶质细胞激活所释放的BDNF,进而阻断BDNF/TrkB信号通路来缓解疼痛[43]。给予反复电针治疗慢性坐骨神经缩窄损伤(Chronic constriction injury of the sciatic nerve, CCI)模型大鼠后,脊髓背角星形胶质细胞的BDNF表达显著减少,这说明星形胶质细胞的BDNF亦参与电针对神经病理性疼痛的调控作用[44]。
综上所述,神经病理性疼痛与神经修复、神经胶质细胞的激活之间有着不可分割的关系,而BDNF/TrkB信号通路在其中起着关键的作用。迄今为止,电针治疗神经病理性疼痛的机制还未完全阐明清楚。由于在神经损伤所诱导的神经病理性疼痛中,电针可通过影响神经可塑性、促进神经修复和抑制神经胶质细胞的激活,进而达到缓解疼痛的作用。据此,进一步探讨电针治疗神经病理性疼痛与BDNF/TrkB信号通路的关系,有助于阐明电针镇痛的作用机制。
4 小 结
缘于神经病理性疼痛及其复杂的发病机制,且当下的临床治疗一直没有很好的效果。因此,神经病理性疼痛仍然是目前困扰全世界的一个临床难题。针灸是祖国传统医学,因其在临床应用上具有不良反应少等特点,愈来愈得到了众多学者的关注和认可。由针灸发展而来的电针治疗神经病理性疼痛的机制是什么?实验证明电针镇痛主要与神经修复、突触可塑性、神经胶质细胞激活以及神经免疫调控等密切相关,而诸多证据提示BDNF/TrkB信号通路有可能是电针干预神经病理性疼痛的潜在靶点,这有待于进一步的研究加以验证。
