1.25(OH)2D3对实验性自身免疫性神经炎的治疗作用研究
2020-03-20李卓含孙俊杰
年 娣,李卓含,孙俊杰,时 鹏
(1.蚌埠医学院检验医学系核医学教研室;2.蚌埠医学院第一附属医院神经内科,安徽 蚌埠 233000)
吉兰-巴雷综合症(Guillain-Barré syndrome,GBS)又称为急性炎症性脱髓鞘型多发性神经病,是一种以周围神经和神经根脱髓鞘及小血管炎细胞浸润为特点的自身免疫性疾病。由于病因不明,主要采用对症支持治疗和特异性免疫治疗如血浆置换、免疫球蛋白静脉注射治疗,但两种治疗手段效果均不能令人满意,目前没有任何措施可阻断疾病进展。EAN是GBS的经典动物模型,具有外周神经脱髓鞘和炎细胞浸润的病理学改变特点,临床表现、神经电生理改变与人GBS非常相似,被广泛用于GBS发病机制及治疗的基础研究。1.25(OH)2D3是维生素D的活性形式,与维生素D受体(Vitamin D Receptor, VDR)结合后与维甲类X受体(retinoid X receptor, RXR)形成二聚体,并结合下游基因DNA序列上维生素D反应元件(Vitamin D Response elements, VDRE),进而控制下游基因转录,发挥功能。一直以来人们认为维生素D主要在钙磷代谢、骨骼新陈代谢中发挥作用。但VDR在人体几乎所有组织类型中均有表达,包括免疫细胞[1]。近年研究显示,维生素D通过调节T淋巴细胞、B淋巴细胞、巨噬细胞等细胞的活化进而在固有免疫和特异性免疫中发挥作用。流行病学研究结果显示,维生素D缺乏与多种自身免疫性疾病相关[2-5]。Spanier等[6]发现补充维生素D3可降低EAE的发病率和严重程度。但Meehan等[7]提出1.25(OH)2D3引发的高钙血症可以改善实验性自身免疫性脑脊髓炎(EAE),而非1.25(OH)2D3本身的治疗作用。但维生素D对EAN的作用目前还不清楚。因此,本研究建立EAN大鼠模型,观察1.25(OH)2D3治疗后EAN大鼠行为学表现、病理改变和炎症因子的变化,综合评估1.25(OH)2D3对EAN的影响及其作用机制。
1 材料与方法
1.1材料
1.1.1实验动物健康雄性Lewis大鼠,6~8 w,体重160~180 g,购于北京维通利华实验动物有限公司。
1.1.2主要试剂周围神经髓鞘抗原P0180-199购自上海吉尔生化有限公司;不完全弗氏佐剂和活性维生素D3购自美国Sigma公司;结核杆菌H37Ra购于Difco公司;Trizol购自Invitrogen 公司;IL-17、IL-10、TGF-β、IFN-γ ELISA试剂盒均购自ABclonal。
1.2方法
1.2.1EAN模型建立及1.25(OH)2D3治疗25只Lewis大鼠随机分正常对照组(Control)、模型组(EAN)、低(VDl)、中(VDm)、高剂量(VDh)维生素D组,每组5只。250 μg P0180-199乳化于等量的完全弗氏佐剂(含10 mg·mL-1结核分枝杆菌H37Ra)作为致敏剂。模型组和维生素D处理组大鼠均予以后肢双足底、多点注射致敏剂共100 μL/鼠。VDl、VDm、VDh组自免疫后第5天开始给予1.25(OH)2D30.25 μg·kg-1、1 μg·kg-1、4 μg·kg-1灌胃,每天一次,连续灌胃7天。Control和EAN组每天灌胃花生油0.2 mL,连续7天。
1.2.2神经系统体征临床评分自免疫第0日起,由两位实验员于每天同一时间称重、观察发病情况并评分。评分标准如下所示:0分:正常;1分:鼠尾肌张力降低,尾尖上翘;2分:尾瘫,翻正反射部分缺失;3分:翻正反射缺失;4分:步态失调,姿态异常;5分:后肢轻瘫;6分:后肢中度瘫痪;7分:后肢严重瘫痪;8分:四肢瘫痪;9分:濒临死亡;10分:死亡。
1.2.3坐骨神经动作电位评价采用生物信号记录仪对大鼠坐骨神经动作电位传导速度、潜伏期进行测定,方法如下:发病高峰期,大鼠经10%水合氯醛麻醉状态下俯卧于恒温手术台,剃净左腿鼠毛,常规消毒后剪开左侧臀部皮肤,沿筋膜剪开钝性分离,游离并暴露坐骨神经,放入刺激电极、记录电极,神经刺激指数设置:1 Hz,5 mA,0.1 ms,诱发负荷肌肉动作电位(compound muscle action potential, CAMP)。四通道生物信号采集器检测并记录CAMP波幅、潜伏期和运动神经传导速度(motor nerve conduction velocity, MNCV)。每只大鼠神经传导记录3次,测量过程中用台式液保持神经干湿润。
1.2.4坐骨神经形态学评价大鼠免疫后第15天10%水合氯醛麻醉状态下,立即分离坐骨神经,置于4%多聚甲醛固定,梯度酒精脱水,二甲苯透明后进行石蜡包埋、切片、HE染色光镜下观察坐骨神经束间、小血管周围淋巴细胞和巨噬细胞浸润情况。
1.2.5坐骨神经超微结构观察大鼠免疫后第15天经10%水合氯醛麻醉,立即分离坐骨神经投入0.2 mol·L-1戊二醛中固定。常规脱水、包埋、超薄切片、染色,透射电镜观察坐骨神经轴突脱髓鞘情况。
1.2.6ELISA检测IL-17、IL-10、TGF-β、IFN-γ水平大鼠免疫后第15天经眼眶后静脉丛采血,3 000 rpm·min-1离心5 min,留取上清液。按照说明书要求在酶标板检测孔加入标准品或待测样本100 μL,37 ℃孵育2 h。洗板后每孔加抗体100 μL,37 ℃孵育1 h。洗板后分别加酶结合底物100 μL,37 ℃孵育30 min。弃去孔内液体,洗板后加TMB 100 μL,15 min后加终止液100 μL,设波长450 nm,空白孔调零,立即酶标仪测定OD值。根据标准曲线计算血清中IL-17、IL-10、TGF-β、IFN-γ的浓度。
1.2.7RT-PCR检测IL-17、IFN-γ、RORrt、FoxP3mRNA水平大鼠免疫后第15天经10%水合氯醛麻醉,常规消毒,无菌环境下取出脾脏。Trizol在液氮中研磨脾脏并提取总RNA,紫外分光光度计测定RNA浓度后逆转录成cDNA进行RT-PCR检测IL-17、IFN-γ、RORrt、FoxP3 mRNA水平变化。引物设计如下: FoxP3 F:5' CCT ACC CAC TGC TGG CAA ACG 3', R:5' ACT TCT CTC TGG AGG AGG CAC TG 3';RORrt F:5' AGG TAT GAC CGA TGC TCT TA 3',R:5' TAT TTT CGG ATA AGT CTA GG 3';IL-17 F:5' TGG ACT CTG AGC CGC ATT GA 3', R:5' GAC GCA TGG CGG ACA ATA GA 3'; IFN-γ F:5' AAA GAC AAC CAG GCC ATC AG 3', R:5' CTT TTC CGC TTC CTT AGG CT 3'; GAPDH F:5' TCG TGG AGT CTA CTG GCG TCT T 3',R:5' CAT TGC TGA CAA TCT TGA GGG AG 3。
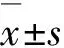
2 结 果
2.1大鼠体重变化和临床评分EAN组大鼠在免疫后第5天开始出现症状,第15天达发病高峰期。发病高峰期临床评分VDl组(6.6±0.23)、VDm(5.2±0.28)、VDh组(6.2±0.33)较EAN组(7.1±0.35)均有减低,其中VDm组效果更加明显,但组间差异均无统计学意义(P>0.05)。EAN组大鼠自出现临床症状开始体重增加速度减低,在第13~15天发病高峰期体重迅速降低,而1.25(OH)2D3干预各组大鼠自出现临床症状开始体重增加速度减低,但无明显体重丢失。发病高峰期VDl、VDm、VDh组体重减轻程度均低于EAN组,但与EAN组相比,差异均无统计学意义(P>0.05)。见图1。
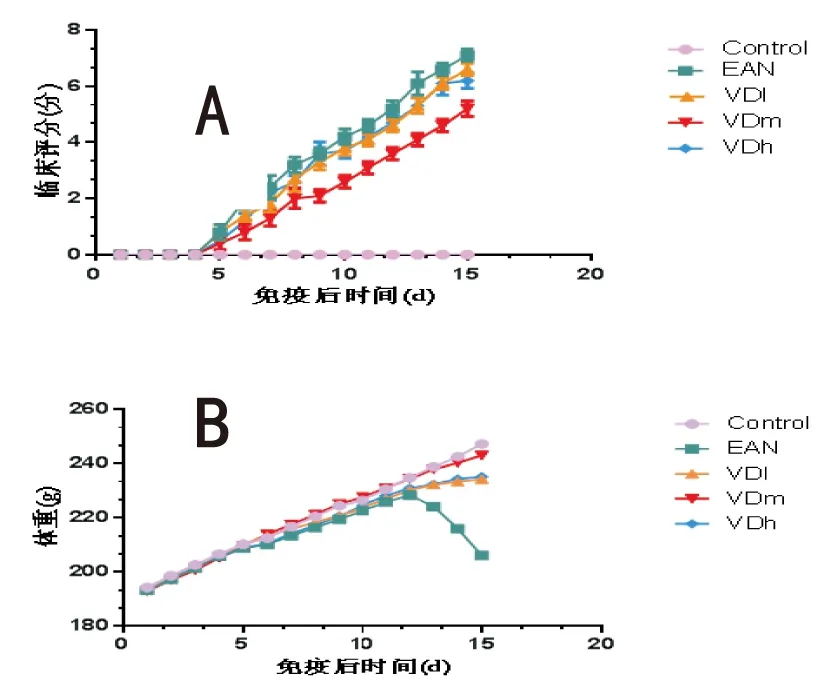
图1 1.25(OH)2D3处理对EAN大鼠临床评分(A)
2.2EAN大鼠神经电生理变化EAN组坐骨神经传导速度为(57.7±0.78) m·s-1,低于Control组 (133.3±0.28) m·s-1,差异具有统计学意义(P<0.05); VDl组、VDm、VDh组坐骨神经传导速度分别为(66.7±0.45) m·s-1、(71.8±0.56) m·s-1、(66.4±1.15) m·s-1,较EAN组均有明显改善,其中VDm组效果最明显 (P<0.05)。EAN组坐骨神经动作电位振幅为(7.49±0.13) m·s-1,低于Control组 (17.8±0.44) m·s-1,差异具有统计学意义(P<0.05); VDl组、VDm、VDh组坐骨神经动作电位振幅分别为(13.3±0.36) m·s-1、(14.8±0.31) m·s-1、(13.6±0.47) m·s-1,较EAN组均有明显升高。综上,1.25(OH)2D3处理减轻了EAN大鼠外周神经损伤,以VDm组效果最好。见图2。
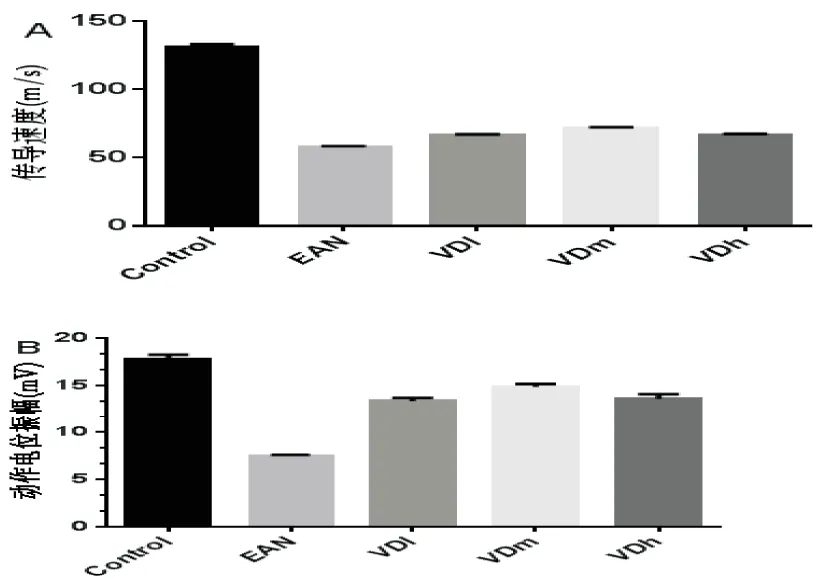
图2 1.25(OH)2D3处理对EAN大鼠坐骨神经传导
2.3EAN大鼠坐骨神经炎细胞浸润和髓鞘脱失情况在发病高峰取坐骨神经分别行HE、透射电镜检查。HE染色结果显示,与Control相比,EAN组大鼠坐骨神经小血管周围大量炎性细胞浸润,而VDm组血管周围炎细胞浸润有明显减轻(图3 HE-A、B、C)。透射电镜结果显示Control组有髓神经纤维轴索结构正常,髓鞘板层层状围绕圆心规则排列。而EAN组可见髓鞘板层肿胀、蜂窝状改变及髓鞘内层与轴索剥离等表现,经1.25(OH)2D3处理后VDm组髓鞘肿胀、空洞形成等改变均较EAN组减轻(图3 TEM-A、B、C)。
2.4ELISA检测大鼠血清IL-17、IL-10、TGF-β、IFN-γ水平现有理论认为炎性因子是加重EAN病情的因素之一,因此我们采用ELISA方法对各组大鼠外周血IL-17、IL-10、TGF-β、IFN-γ水平进行检测。结果显示,与Control组相比,EAN组大鼠血清炎性细胞因子IL-17、IFN-γ水平均明显增加,而IL-10、TGF-β水平显著下降,差异有统计学意义(P<0.05)。与EAN组相比,1.25(OH)2D3处理后VDl、VDm、VDh组大鼠血清IL-17、IFN-γ水平显著降低, IL-10、TGF-β水平明显增加(P<0.05)。 各处理组间两两相比VDl vs VDm,VDm vs VDh差异均有统计学意义(P<0.05),但VDl vs VDh组差异不明显(P>0.05)。见图4。
图3 HE染色和透射电镜检测坐骨神经炎性细胞浸润和脱髓鞘情况
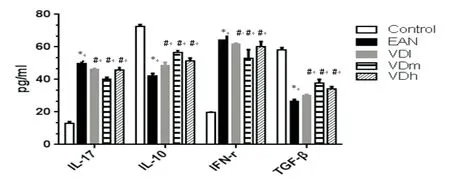
图4 外周血炎性细胞因子水平
2.5RT-PCR检测大鼠脾脏炎性细胞因子mRNA表达水平发病高峰期对各组大鼠脾脏中炎性细胞因子mRNA进行RT-PCR检测,结果显示,与Control组相比,EAN组IL-17、IFN-γ、RORrt mRNA表达水平显著升高, Foxp3 mRNA水平降低,差异均有统计学意义(P<0.05)。与EAN组相比,VDm组IL-17、IFN-γ、RORrt mRNA表达水平显著降低,同时Foxp3 mRNA水平明显增加,差异有统计学意义(P<0.05)。 VDh组与EAN组相比只有IFN-γ明显降低,VDm组IL-17降低水平与VDl组相比更加明显(P<0.05)。上述实验结果表明,1.25(OH)2D3干预治疗后,炎症相关细胞因子表达水平降低,中等剂量的1.25(OH)2D3治疗效果明显优于低、高剂量组。见图5。
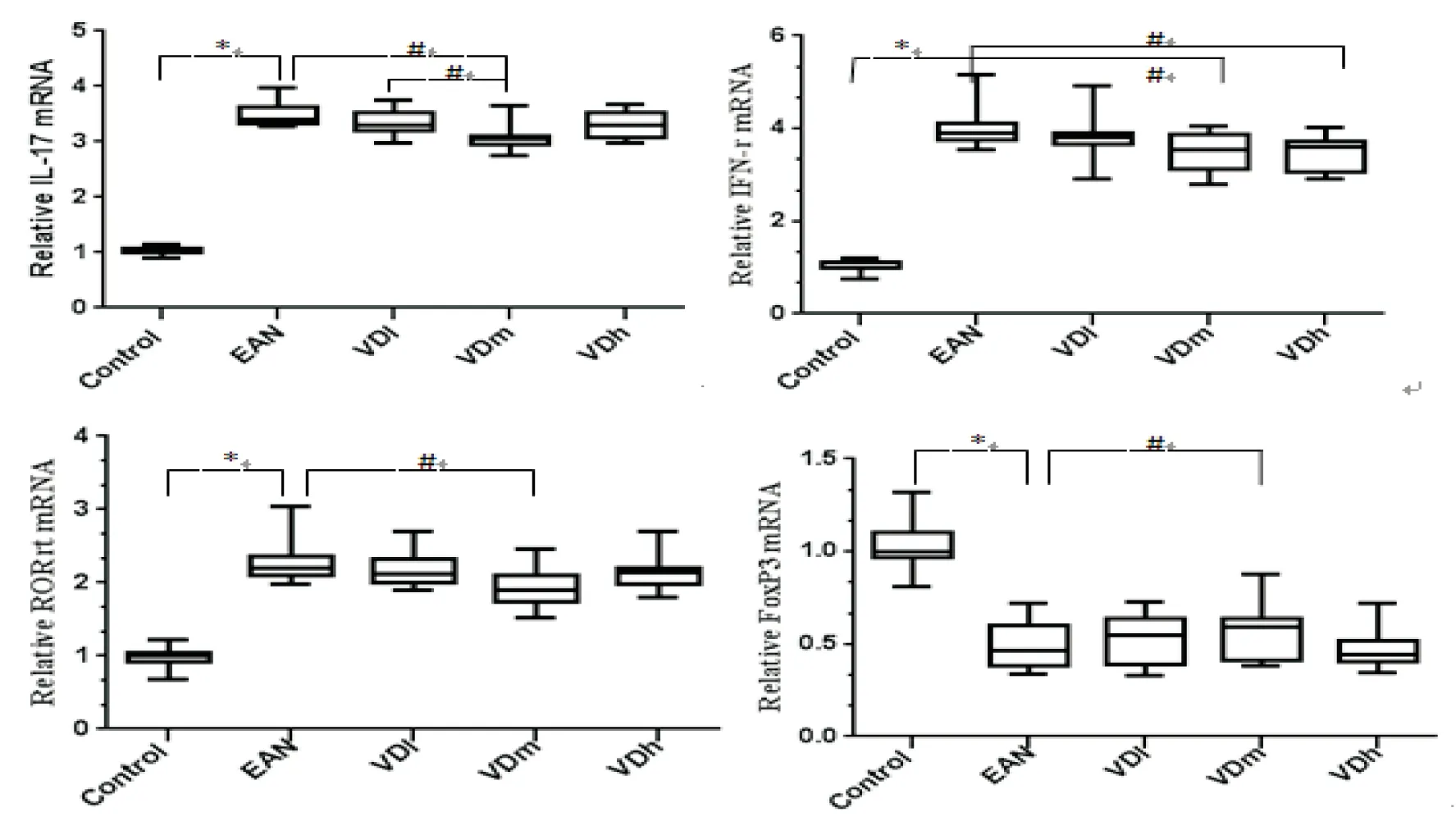
图5 脾脏炎性细胞因子和T淋巴细胞mRNA的表达水平
3 讨 论
目前认为GBS是由T细胞介导的自身免疫性疾病,临床以肢体无力、四肢对称性迟缓性瘫痪为主要症状,周围神经、神经根脱髓鞘和小血管炎细胞浸润是主要病理特点。EAN是GBS的经典动物模型在病理学改变、临床表现、神经电生理改变与GBS非常相似,被广泛用于GBS发病机制及治疗的研究[8]。许多研究表明机体免疫稳态的破坏是GBS的发病基础,Th17、Treg细胞及其效应因子构成复杂的网络参与了GBS的发生、发展和转归。生理稳态情况下,Th1/Th2、Th17/Treg细胞处于动态平衡[9-10]。Th17细胞分泌的特征性细胞因子IL-17通过诱导靶器官炎症级联反应参与自身免疫性疾病发生。高表达转录因子Foxp3的Treg细胞通过直接接触发挥抑制Th细胞功能、分泌抑制性炎性细胞因子抑制自身免疫应答,维持机体免疫稳态。当机体受到病原体刺激后,Th1、Th17细胞被激活产生炎症反应对抗病原菌,若此过程调节失衡,可能导致自身免疫性疾病的发生。在EAN发病初期,外周血IFN-γ、IL-17水平显著增加;疾病进入恢复期后,IFN-γ、IL-17水平逐渐降低[11]。EAE小鼠模型淋巴细胞IL-17A含量显著增加[12],GBS患者外周血Th1细胞显著升高,Treg细胞明显降低。我们前期研究发现GBS患者外周血Th1/Th2、Th17/Treg表达失衡,ENA小鼠胃肠灌注婴儿双歧杆菌可以改善Th17/Treg失衡,改善自身免疫性炎症反应[13-14]。
维生素D自身无生物活性,转化为活性形式1.25(OH)2D3并与VDR结合后发挥作用,VDR广泛存在于在免疫细胞和中枢神经系统如下丘脑、海马、皮层神经元。近年研究显示,维生素D通过调节T淋巴细胞等在固有免疫和特异性免疫中发挥作用;同时有研究表明维生素D不仅影响T细胞增殖、成熟,还可减少IL-17的表达,促进Treg细胞的增殖并增强其免疫耐受功能[15-16]。Kevin等[17-19]检测出VDR调控的下游基因与系统性红斑狼疮、多发性硬化等有关。Jeffery等[20-21]的研究显示1.25(OH)2D3在类风湿性关节炎、银屑病中等疾病中的治疗作用与IL-17A有关。
本研究采用0.25 μg·kg-1、1 μg·kg-1、4 μg·kg-13种剂量的1.25(OH)2D3灌胃治疗EAN大鼠,结果显示,相比于P0肽诱导的EAN模型组,1.25(OH)2D3减轻了EAN大鼠的临床症状,不同程度降低了临床评分,减轻了体重丢失情况;显著改善了坐骨神经传导速度;形态学上有效减轻了坐骨神经炎细胞浸润和髓鞘脱失程度,其中以1 μg·kg-1的VDm组效果最优。Mohammadi等[22]的研究显示维生素D减少炎细胞向中枢神经系统的浸润和脱髓鞘,这与我们的研究结果一致。
发病高峰期对EAN大鼠外周血中的炎性因子进行检测,结果显示,1.25(OH)2D3降低了EAN大鼠外周血促炎性细胞因子IL-17、IFN-γ的表达,同时增加了抑炎性细胞因子IL-10、TGF-β的表达,中等剂量治疗组(VDm)的效果较低、高浓度组更好。IFN-γ等一方面通过激活巨噬细胞产生NO、活性氧中间体介导髓鞘损伤,促使EAN发病,另一方面通过抑制IL-23途径的Th17细胞扩增而下调IL-17,在EAN中发挥双向作用。Speck等[23]证实,高表达的TGF-β、IL-10与EAE的病情恢复缓解有关,中和或抑制TGF-β、IL-10可加剧EAE病情的严重程度,但Treg过继转移可降低TGF-β、IL-10、IL-4的水平进而缓解EAE。本研究结果提示1.25(OH)2D3改变了EAN大鼠模型中促炎性细胞因子和抑炎性细胞因子的平衡,减轻EAN临床症状,且治疗效果与剂量有关。进一步对发病高峰期EAN大鼠脾脏中Th17、Treg细胞转录因子进行检测,结果显示,与Control相比,EAN大鼠IL-17、IFN-γ、RORrt mRNA表达水平升高, Foxp3 mRNA水平降低。1.25(OH)2D3降低了EAN大鼠IL-17、IFN-γ、RORrt mRNA表达水平,同时上调Foxp3 mRNA水平。重组IL-17加重EAN大鼠急性期坐骨神经炎性细胞浸润和脱髓鞘病变。体外扩增的Treg细胞回输治疗可减轻EAN大鼠外周神经受损后的神经痛和周围神经炎性脱髓鞘改变[24]。本研究中1.25(OH)2D3治疗后与Foxp3上调伴随Th17等转录因子下调,说明EAN大鼠体内Th17/Treg细胞及炎性因子的分布发生了变化,Th17/Treg失衡状态得以纠正,1.25(OH)2D3的治疗作用可能与Th17/Treg再平衡有关。Ahangar-Parvin等[25-26]发现维生素D3可预防EAE发病,改变EAE中Th1、Th17、Th2、Treg细胞比例,与我们的研究结果一致。
VDR作为1.25(OH)2D3的核受体可通过与下游基因启动子区域的VDRE序列结合发挥调控基因的转录表达的作用。Tone等[27]在小鼠Foxp3基因高度保守的非编码序列中发现VDRE序列。1.25(OH)2D3刺激人和小鼠CD4+CD25-T细胞中Foxp3的表达[26]。Foxp3具有直接抑制IL-17和IFN-γ的能力,Foxp3、RORrt及Runxl相互作用抑制IL-17的产生,VDR可以阻断Runxl的表达而抑制RORrt转录活性[28-29]。这些研究表明1.25(OH)2D3可能通过直接结合Foxp3基因内含子中VDRE序列促进Foxp3基因启动子活性而刺激Foxp3的表达,进而调控RORrt的表达,抑制自身免疫过程中促炎性Th17反应而减轻EAN炎症反应。
综上所述,1.25(OH)2D3可能通过影响T细胞的数量和功能,诱导Treg细胞的分化,减少促炎性细胞因子的产生、增加抑炎性细胞因子表达而介导对EAN的保护作用。因此补充1.25(OH)2D3有可能成为GBS治疗的一种辅助治疗手段,但EAN大鼠模型病情发展具有自限性,在EAN模型有限的治疗期间1.25(OH)2D3的免疫调节作用能否在GBS患者身上重现,有待于进一步的研究。本研究结果为1.25(OH)2D3治疗EAN阐明了部分机制,为其将来用于GBS防治提供了实验依据。
