RBL-2H3细胞不适合用于类过敏模型的建立
2020-03-20张小雨齐睿娟李西蒙韩宜芯费巧玲蔡润兰
张小雨,齐睿娟,李西蒙,韩宜芯,费巧玲,蔡润兰,齐 云,高 源
(中国医学科学院北京协和医学院药用植物研究所,北京 100193)
近十余年,速发型超敏反应性疾病的患病率迅速增高,已成为当今社会的流行病,这与环境因素和生活方式的改变有关。速发型超敏反应主要分为免疫介导型和非免疫介导型两大类。免疫介导型中最为常见的是由IgE-FcεRI介导的I型速发型超敏反应,也就是常说的过敏反应。其发生是由于过敏原初次进入机体诱导B细胞产生IgE抗体,抗体以Fc段与靶细胞表面FcεRI结合,使机体处于致敏状态。当同一过敏原再次进入机体,与致敏靶细胞表面IgE抗体结合,使FcεRI交联活化,诱导靶细胞脱颗粒,释放活性介质。而非免疫型超敏反应,国内学者常称之为类过敏反应,其诱发机制主要有两类:一是通过直接方式刺激效应细胞(主要是肥大细胞),例如基础分泌素(P物质、Compound 48/80和黄蜂毒素等)可直接结合肥大细胞表面的Mas相关的G蛋白偶联受体(Mas-related G protein coupled receptor,Mrgpr),致使细胞活化引起脱颗粒,同时释放生物活性介质[1];二是通过间接的方式刺激肥大细胞释放生物活性介质,如双黄连注射剂可通过活化补体毒素C5最终引起速发型超敏反应[2]。
大鼠嗜碱性粒细胞性白血病细胞(RBL-2H3)因易在培养基中大量生长,对IgE-FcεRI介导的信号反应好,且基因能被改造,广泛被用于IgE-FcεRI介导的肥大细胞脱颗粒模型研究[3],但对直接刺激引起的脱颗粒响应情况并不十分清楚。国外有研究报道称RBL-2H3细胞对Compound 48/80没有应答[4],但国内使用Compound 48/80刺激RBL-2H3细胞作为类过敏模型或用Compound 48/80作为阳性药评价中药注射液致RBL-2H3细胞脱颗粒情况的现象却相当普遍[5]。
肥大细胞脱颗粒释放出活性介质,包括组胺、β-己糖胺酶、类蛋白酶等,其中,β-己糖胺酶测定方法稳定可靠、简单便捷,因此常作为评价脱颗粒程度的重要指标之一。由于目前理想的肥大细胞株难以通过商业化途径获得,而嗜碱性粒细胞因在IgE-FcεRI介导的脱颗粒反应上响应度与肥大细胞相当而被广泛使用[6]。但在类过敏反应模型上,嗜碱性粒细胞是否也能像在免疫介导型反应上替代肥大细胞还没有明确的结论。本文通过考察RBL-2H3细胞上MrgprB2受体的表达情况,测定不同浓度Compound 48/80对RBL-2H3细胞活力和β-己糖胺酶释放量的作用,以及对比RBL-2H3细胞、人肥大细胞系LAD2和大鼠腹腔肥大细胞(Rat peritoneal mast cells,RPMCs)对Compound 48/80的响应性的差异来全面系统地评价RBL-2H3细胞是否适用于建立类过敏反应模型。
1 材料与方法
1.1 材料
1.1.1细胞 RBL-2H3购自中国科学院上海生科院细胞资源中心。RPMCs从SD大鼠中提取分离。人肥大细胞系LAD2 (Michael D. Gershon, MD, Columbia University, USA)受赠于孙仁山教授(第三军医大学,重庆,中国)。
1.1.2动物 SPF级成年♂SD大鼠1只,体质量220 g;SPF级成年♂BALB/c小鼠10只,体质量(18~20) g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。相关动物实验符合中国医学科学院药用植物研究所伦理委员会标准。实验前适应性饲养一周,正常饮食,循环光照。
1.1.3试剂 铝佐剂、胰酶和DMEM培养基(批号:2004655)均购自美国Thermo Fisher Scientific公司;4-Methylumbelliferyl N-acetyl-β-D-glucosaminide(批号:BCBX5480)和Compound 48/80(批号:102M4086V)均购自美国Sigma公司;3-(4,5-dimethylthiazol-2-yl 5-(3-carb oxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium(MTS,批号:0000177650)购自美国Promega公司;吩嗪硫酸二甲酯(PMS,批号:11607085)购自美国Honeywell公司;TRIzol试剂和M-MuLV第一链cDNA合成试剂盒(批号:B532435-0010)均购自上海生工生物工程股份有限公司;StarLighter SYBR Green qPCR Mix购自北京启衡星生物科技有限公司,其它试剂均为国产分析级试剂。
1.1.4仪器 恒温金属浴(北京金银杏生物科技有限公司,H2O3-PRO型),低温高速离心机(美国Sigma公司,2-16PK型),Multiskan Ascent酶标仪(美国Thermo Electron公司,Type354型),冷冻干燥机(北京博医康实验仪器有限公司,FD-1B-50型),荧光定量聚合酶链反应(Real-time Quantitative Polymerase Chain Reaction, RT-qPCR)系统仪(杭州博日科技有限公司,FQD-96A型),紫外-可见分光光度计(美国Thermo Fisher Scientific公司,NANODROP 2000型),电动玻璃匀浆机(宁波新芝生物科技股份有限公司,Dy89-Ⅱ型),倒置显微镜(重庆广电仪器公司,XDS-1B型)。
1.2 实验方法
1.2.1虾总蛋白(shrimp total protein, ST)的提取和纯化 按Capobianco等[7]利用等电点沉淀为原理的方法,从刀额新对虾(Metapenaeusensis)提取并纯化得ST。
1.2.2抗ST血清的制备 按照本课题组之前建立的方法[8]制备抗血清。
1.2.3大鼠腹腔肥大细胞的提取 异氟烷麻醉健康大鼠,股动脉放血致死。腹腔注射20 mL预冷的Hank’s平衡缓冲盐溶液,轻柔按摩腹部3 min后,剪开腹部皮肤,沿腹白线剖开腹部,将腹腔内容物推向一侧,以滴管将腹腔液收集于离心管中,放入冰浴内冷却,600×g离心10 min,弃上清得肥大细胞沉淀物,用Hank’s平衡缓冲盐溶液重悬得肥大细胞混悬液。
1.2.4β-己糖胺酶的测定 对于免疫介导的脱颗粒研究,将RBL-2H3按2.5×105个细胞/孔的密度接种于96孔细胞培养板,加入质量分数为1%的抗ST血清敏化过夜。次日,用Hank’s平衡缓冲盐溶液冲洗细胞一次,加入20 μg·L-1的ST孵育1.5 h。
对于非免疫介导途径的脱颗粒研究,将细胞接种于96孔细胞培养板(RBL-2H3为2.5×105个细胞/孔;LAD2为1.6×104个细胞/孔;RPMCs为6.7×104个细胞/孔)。实验孔给予不同浓度的Compound 48/80(终浓度为5、10、20、40、80 mg·L-1,DMEM培养基配制),空白对照孔加入等体积的DMEM培养基。置培养箱中37 ℃、体积分数为5%的CO2条件下培养1.5 h。
1.5 h后,取上清20 μL加入96孔全黑酶标板,加入0.57 g·L-1β-己糖胺酶底物4-methylumbelliferyl-N-acetyl-β-D-glucosaminide(枸橼酸钠缓冲液配置,133 mmol·L-1枸橼酸钠,133 mmol·L-1氯化钠,调至pH4.3)50 μL,25 ℃避光反应2 h,加入180 μL终止液(50 mmol·L-1甘氨酸,5 mmol·L-1EDTA-Na2,调至pH10.5)终止反应,于Ex: 355 nm,Em: 460 nm处测定其荧光值。
1.2.5总RNA提取和实时荧光定量PCR 按照说明书方案用Trizol试剂提取总 RNA。用M-MuLV第一链cDNA合成试剂盒进行逆转录。用SYBR qPCR kit试剂盒进行RT-qPCR,循环条件为: 95 ℃(20 s),然后进行40 个循环的95 ℃(15 s)和62 ℃(20 s)。我们考察了RBL-2H3细胞的β-actin和MrgprB2的mRNA水平,引物序列为: β-actin的正引物为5′-TACAACTCCTTGCAGCTCC-3′,反引物为5′-ATCTTCATGAGGTAGTCAGTC-3′。MrgprB2的正引物为5′-AGCGGATACTGACCAGACTG-3′,反引物为5′-CCATTGGATGAGCCAGGAGATTCC-3′。
1.2.6细胞活力测定 采用MTS方法测定细胞活力。在Compound 48/80刺激RBL-2H3细胞1.5 h之后弃去上清,用预温的DMEM培养基洗细胞两次,加入100 μL DMEM培养基,按MTS(2 g·L-1)与PMS(0.92 g·L-1)20 ∶1的比例配置MTS混合溶液,每孔20 μL ,37 ℃孵育2 h,于492 nm测定OD值。
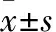
2 结果
2.1 RBL-2H3细胞对IgE-FcεRI信号通路响应灵敏如Fig 1所示,与空白对照组相比,单独给予终浓度为1%的ST抗血清或ST(20 μg·L-1)时,RBL-2H3细胞释放β-己糖胺酶水平没有显著变化;而用1%的ST抗血清致敏后的RBL-2H3细胞再受到ST(20 μg·L-1)攻击后发生脱颗粒,细胞上清中β-己糖胺酶水平显著升高,是空白对照组的13.24倍(P<0.01)。
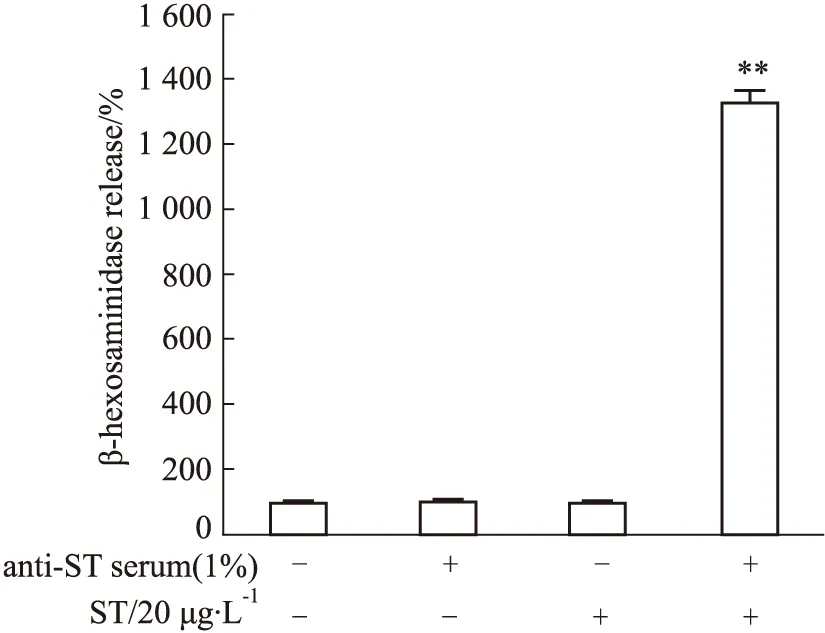
Fig 1 RBL-2H3 cell degranulation
**P<0.01vscontrol.
2.2 RBL-2H3细胞可表达MrgprB2受体通过RT-qPCR考察了RBL-2H3细胞的内参基因β-actin和目标基因MrgprB2的mRNA的表达水平。循环阈值(CT值,Cycle threshold)为样品的荧光信号到达设定阈值时所经历的循环数。扩增结果显示(Fig 2A、B),在RBL-2H3细胞中,内参基因β-actin的 CT值为11.38,目标基因MrgprB2的CT值为26.84,表明RBL-2H3细胞上有MrgprB2受体表达。
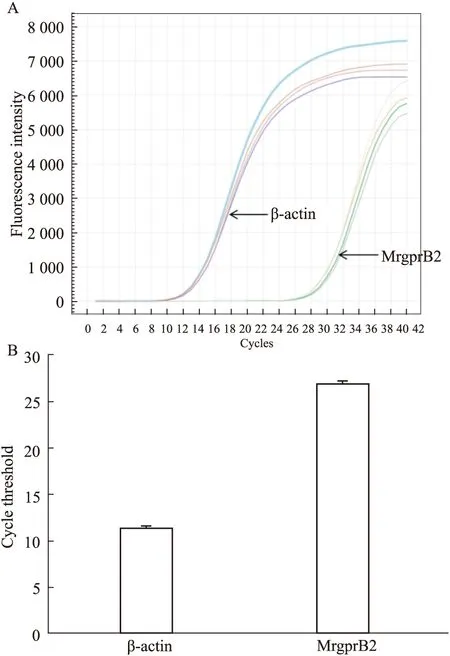
Fig 2 Expression of MrgprB2 receptor in
A: The amplification curve of reference gene β-actin and target gene MrgprB2 in RBL-2H3 cells assayed by RT-qPCR; B: The cycle threshold of β-actin and MrgprB2 in RBL-2H3 cells.
2.3 基础分泌素Compound 48/80能剂量依赖性地诱导RBL-2H3细胞释放β-己糖胺酶除了IgE-FcεRI介导的RBL-2H3细胞经典脱颗粒途径外,基础分泌素还可以通过与MrgprB2受体结合直接诱导RBL-2H3细胞脱颗粒。我们测定了最常用的基础分泌素Compound 48/80在不同剂量下对RBL-2H3细胞释放β-己糖胺酶的作用。如Fig 3所示,当Compound 48/80剂量达到10 mg·L-1时,即可显著诱导RBL-2H3细胞释放β-己糖胺酶,且随着Compound 48/80剂量升高,β-己糖胺酶释放量也相应升高。但总体来说,RBL-2H3细胞对Compound 48/80并不敏感,剂量高至80 mg·L-1时,释放率也仅为空白对照组的3.47倍。
Fig 3 Relative level of β-hexosaminidase released from RBL-2H3 induced by different concentrations of
*P<0.05,**P<0.01vscontrol.
2.4 基础分泌素Compound 48/80在高剂量时促RBL-2H3细胞释放β-己糖胺酶是由于其细胞毒作用我们在光学显微镜(×200)下观察了不同剂量的Compound 48/80刺激RBL-2H3细胞1.5 h后细胞的形态(Fig 4A),发现空白对照组细胞呈梭形,形态完整,边缘光滑,立体感强,有光泽。Compound 48/80达到10 mg·L-1时,细胞开始肿胀变形,表面出现大小不均的颗粒状物质,但细胞形态仍然完整。当Compound 48/80增加到40 mg·L-1时,可明显观察到细胞形态开始不完整,无光泽,释放出大量颗粒物质。而80 mg·L-1Compound 48/80刺激RBL-2H3细胞1.5 h则导致RBL-2H3细胞形态严重破坏,在视野范围内可观察到大量的细胞碎片。我们又用MTS法测定了不同剂量的Compound 48/80对RBL-2H3细胞活力的影响(Fig 4B)。结果显示,20 mg·L-1Compound 48/80刺激RBL-2H3细胞1.5 h存活率为82.1%,已经表现出对细胞活力的抑制趋势(尽管没有统计学差异)。而40 mg·L-1及其以上剂量Compound 48/80对 RBL-2H3细胞存活率有显著影响(P<0.05),40 mg·L-1和80 mg·L-1Compound 48/80刺激RBL-2H3细胞存活率分别为73.0%和63.4%,与光学显微镜下观察细胞形态结果一致,说明40 mg·L-1及以上的Compound 48/80对RBL-2H3细胞会造成显著毒性。随之,我们同时测定了与测MTS同孔细胞上清中β-己糖胺酶水平,结果显示(Fig 4C),在Compound 48/80剂量≥ 10 mg·L-1时,即可显著促进细胞释放β-己糖胺酶(P<0.05),且呈剂量依赖关系。但结合MTS的结果(Fig 4B)可知,在20 mg·L-1以上剂量时所出现的致脱颗粒作用,已经不能完全归咎于Compound 48/80与膜表面的Mrgpr受体的特异性反应。
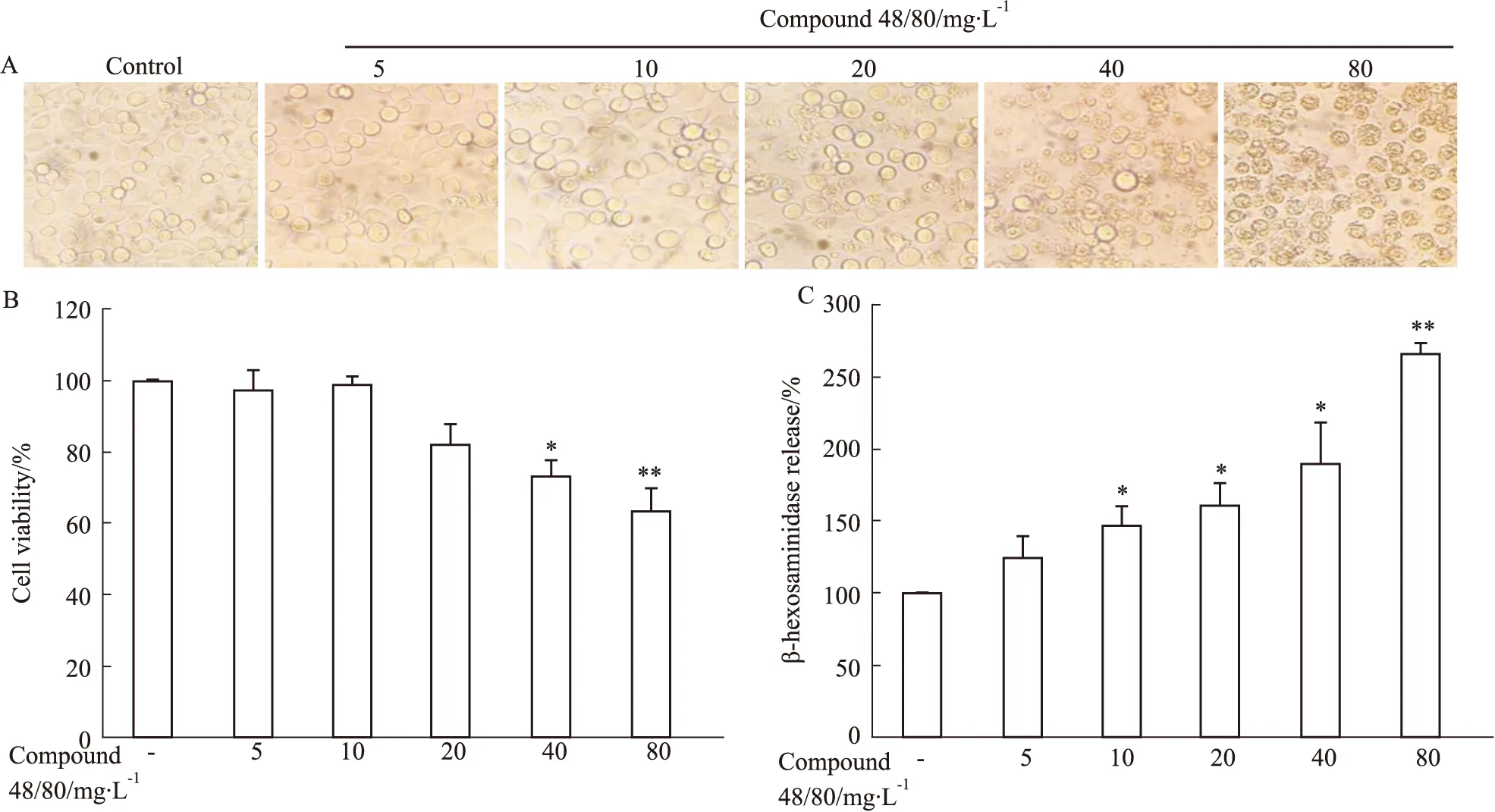
Fig 4 Cytotoxicity of different concentrations of Compound 48/80 on RBL-2H3 cells n=3)
A: The morphology of RBL-2H3 cells induced by different concentrations of Compound 48/80 (×200); B: Effect of Compound 48/80 on the viability of RBL-2H3 cells; C: The level of β-hexosaminidase released from RBL-2H3 induced by Compound 48/80 at the indicated concentrations.*P<0.05,**P<0.01vscontrol.
2.5 RBL-2H3细胞不适用于类过敏模型的建立我们选用确定的无毒剂量10 mg·L-1Compound 48/80刺激RBL-2H3细胞、LAD2细胞和RPMCs细胞,1.5 h后,测定3种细胞上清中β-己糖胺酶水平。结果表明 (Fig 5),10 mg·L-1Compound 48/80刺激RBL-2H3细胞的β-己糖胺酶释放量只有空白对照组的2.35倍,而同样剂量的Compound 48/80刺激LAD2和RPMCs的β-己糖胺酶释放量分别为空白对照组的15.02倍和16.05倍,说明RBL-2H3细胞对Compound 48/80的响应性远不如LAD2或RPMCs强。
3 讨论
RBL-2H3细胞是Eccleston团队1973年在一只用致癌物处理过的大鼠中获得的RBL-1细胞经单克隆分离出来的亚系,被称为大鼠嗜碱性粒细胞性白血病细胞[9]。因其生长迅速、可操作性强、存活率高、同质性好等优点近年来被广泛研究。RBL-2H3细胞具有肥大细胞的一些特性,如表面表达有IgE的高亲和力受体FcεRI,在IgE激活时脱颗粒,因而常被用于IgE与FcεRI结合后下游通路的机制研究。除此之外,还用于建立IgE-FcεRI介导的脱颗粒模型[10]。但是有学者认为RBL-2H3细胞不能用于建立一个准确的肥大细胞介质释放的模型,RBL-2H3细胞与肥大细胞之间仍存在诸多差异,比如RBL-2H3细胞对基础分泌素没有响应;尽管表面表达TLR4受体但LPS无法激活该细胞;肥大细胞稳定剂酮替芬和色甘酸二钠并不能在RBL-2H3细胞上表现出细胞膜稳定效果等[11]。
本研究结果表明,RBL-2H3细胞对IgE-FcεRI信号通路响应非常灵敏(Fig 1),与之相比,其对Compound 48/80的反应性却相当差(Fig 3),这与Senyshyn等[4]报道RBL-2H3细胞可能由于缺乏G蛋白偶联受体的亚蛋白Gi-3而对基础分泌素Compound 48/80没有应答结论一致,因为Compound 48/80是通过激活肥大细胞细胞膜上Mrgpr受体家族向下游传导信号引起脱颗粒的。
有学者通过生物信息学分析,在小鼠、大鼠和人类中鉴定出大约50个Mrgpr基因:MrgprA,B,C,D,E,F,G,H和一个人类特有的MrgprX。有趣的是,不同的亚科由不同物种中的多个重复基因组成。人类有多个MrgprX基因,而啮齿类动物有多个MrgprA、B和C基因,甚至不同的啮齿动物物种每个亚科的基因数量也不同[12]。肥大细胞表面Mrgpr受体家族间存在着巨大的物种特异性。2015年McNeil等[5]首次证实MrgprX2受体是在人肥大细胞上能够被基础分泌素特异性触发类过敏反应的G蛋白偶联受体,配体主要包括P物质、黄蜂毒素、Compound 48/80等[1]。而在大鼠中,腹腔肥大细胞表面可以检测到MrgprB1、B2、 B3、 B6、 B8和B9的表达,但没有MrgprA和MrgprC表达[12]。根据RBL-2H3细胞对基础分泌素Compound 48/80的响应性不佳的特点(Fig 3),我们最初推测RBL-2H3细胞根本不表达或几乎不表达Mrgpr受体家族相关基因。但是RT-qPCR结果却显示(Fig 2),RBL-2H3细胞是有MrgprB2基因表达的。而无论是同为大鼠来源的RPMCs,还是人肥大细胞株LAD2,均对安全剂量的Compound 48/80响应性良好(Fig 5)。这些结果提示嗜碱性粒细胞和肥大细胞可能在Mrgpr受体家族的表达量上存在较大差异,RBL-2H3对除Compound 48/80之外的基础分泌素响应性也不佳可能也与之相关[13],并且,有研究报道RBL-2H3细胞上不表达补体的受体,对补体介导的非免疫型超敏反应也没有响应[14],故RBL-2H3细胞并不适合用于类过敏模型的建立。
**P<0.01vscontrol.
我们也发现,国内有不少学者用Compound 48/80刺激RBL-2H3细胞作为类过敏模型[15],或在评价中药注射剂类过敏反应时将Compound 48/80作为阳性药使用[5]。但这些研究中Compound 48/80使用剂量普遍偏大,甚至超过了安全剂量,因此不能排除因Compound 48/80剂量过大导致细胞破裂的原因,而非基础分泌素与Mrgpr受体之间的特异性反应而致脱颗粒。同理,在注射剂过敏性评价时,可能也存在着由于注射剂剂量超过安全剂量引起的“假脱颗粒”现象。
在本研究中,我们通过三种细胞对于基础分泌素Compound 48/80响应性的对比 (Fig 5),发现安全无毒剂量Compound 48/80(10 mg·L-1)刺激RBL-2H3细胞的β-己糖胺酶释放量仅为空白对照组的2.35倍,而在同样条件下的LAD2和RPMCs的β-己糖胺酶释放量分别为空白对照组的15.02倍和16.05倍(Fig 5)。其实早在2009年,已经有学者发现RBL-2H3细胞只适合研究IgE介导的脱颗粒,而认为它在其它方面并不具有代表性[10]。尽管当时Mrgpr作为基础分泌素受体的功能属性尚未被发现,但RBL-2H3细胞与真正的肥大细胞的区别却早就被认知,今天我们的研究结果也只是丰富了这个结论。
