秀丽隐杆线虫模型在阿尔茨海默病研究中的应用
2020-03-20唐晓丽
唐晓丽,杨 依,刘 悦,方 芳
(北京中医药大学中药学院中药药理系,北京 102488)
阿尔茨海默病(Alzheimer's disease,AD)是一种与衰老相关的神经退行性疾病。随着人口老龄化,AD已被认为是65岁以上老人的健康杀手。流行病学显示,2001年全球老年痴呆症的患者高达2 430万人,预计到2040年增加到8 110 万人[1],AD则是老年痴呆症的主要构成因素。AD的主要病理学特征为细胞外β-淀粉样蛋白沉积,细胞内神经纤维缠结和选择性神经元死亡。AD病人临床表现为记忆力减退,认知障碍以及人格改变。在AD病人的脑中均存在富含β-淀粉样蛋白的老年斑和微管相关蛋白Tau高度磷酸化形成的神经元纤维缠结,β-淀粉样蛋白寡聚体和高度磷酸化的Tau蛋白均有神经毒性,可能参与AD的发病机制。科学家们经过不断的探索,依然未能找到逆转AD确有疗效的药物,主要原因是AD为一种由多因素导致的疾病,其确切的病理机制还未阐明。稳定的病理模型有利于阐明AD的病因、分子机制及治疗药物评价。近年来,秀丽隐杆线虫因神经系统结构简单、遗传信息清晰、生命周期短等优点作为一种模型生物,在神经退行性疾病、肌肉萎缩症[2]、抗感染[3]等领域的药物研究中得到广泛的应用。本文结合AD的主要病理特征,对近几年秀丽隐杆线虫在AD研究中的应用作简要总结。
1 秀丽隐杆线虫简介
1.1 生物学特征秀丽隐杆线虫(Caenorhabditiselegans,C.elegans)属于动物界、线形动物门、小杆亚纲(Rhabditia)、小杆目(Rhabditidia)、小杆总科(Rhabditoidea),它以细菌为食,在土壤中营自由生活,成虫体长为1.0~1.5 mm,体直径约为70.0 μm。有雌雄同体虫和雄虫两种虫体(Fig 1),自然界中大多为雌雄同体虫。雌雄同体虫一生可产卵约300个,卵发育成成虫后的雌雄同体虫体细胞有959个,雄虫有1 031个。线虫从卵发育至成虫大约为3 d,一生经历卵、幼虫期(L1-L4期)和成虫期3个时期。在幼虫时期出现食物短缺或比较拥挤的情况时,线虫便进入生长停滞状态(Dauer时期),该时期的线虫有如特异的冀膜等独特的形态学特征,运动减少且寿命延长[4]。
1.2 秀丽隐杆线虫作为模式生物的优势首先,线虫具有简单的神经系统结构,只有1~2个不分叉的突起,形成或接受突触连接,但其基本功能与哺乳动物相似,具有主要的神经递质(乙酰胆碱、五羟色胺、多巴胺、谷氨酰胺等),并且线虫的神经系统含有高等动物神经系统的大多数分子成分,可利用全基因组序列提供的信息和同源克隆等方法,分离高等动物神经系统基因[5]。这些都为研究神经系统相关功能及神经环路提供了条件。其次,线虫身体透明,在显微镜下易于观察。用不同的探针染色时在激发光下激发能产生相应的荧光,便于进行定性分析,如将绿色荧光蛋白定向导入线虫体内可观测某个基因表达量的变化。第三,遗传信息清晰。线虫基因组大小为9.7×107个碱基,大约是人类的1/30,其中基因组序列40%与人类同源,与人类疾病相关的基因同源的基因有533个,在已发现的信号通路中与人类同源的有12条[6]。利用线虫基因组与人类基因的保守性,RNAi技术也被广泛应用,从而为观察单个基因在线虫中的作用研究提供可靠的条件。第四,生命周期短,后代数目多。线虫发育至成虫期即开始产卵,产卵周期约为3 d,在短期内可获得大量可用的模型线虫。这些优点使得线虫作为模型生物用于研究衰老相关的各种疾病(包括AD等神经退行性疾病)的病理机制和候选药物筛选成为可能。
2 AD相关的秀丽隐杆线虫模型
2.1 Aβ转基因线虫模型Aβ是一段由38或40个氨基酸组成的肽,由一种跨膜蛋白——淀粉样前体蛋白(amyloid precursor protein,APP)经β-分泌酶和γ-分泌酶剪切而形成,具有自聚集的倾向。Aβ寡聚体异常沉积不但会阻止神经递质从突触前到突触后的传递,从而导致突触功能障碍和神经元丢失,而且还会在AD病人的脑中异常堆积形成老年斑,对神经系统造成严重的伤害。在线虫中存在与哺乳动物APP同源的基因apl-1,其过表达对寿命呈现组织特异性影响。apl-1在神经元中过表达会导致寿命减少,但是在皮下组织中过表达则能通过抑制异时转录因子LIN-14的功能,以及通过DAF-16、HSF-1和DAF-12发出信号来延长寿命[7]。线虫中虽然存在APP同源的基因apl-1,但因缺少β-分泌酶而无法产生Aβ,因此转基因线虫AD模型主要通过转入人源Aβ基因,使其在特定神经元或肌肉细胞中表达,这些转基因线虫主要表达Aβ1-40或Aβ1-42基因,从而来模拟Aβ对AD病人造成的神经损伤。Link等[8]在1995年首先建成第一个转入Aβ1-42的线虫模型CL2006,在该模型中检测到了Aβ在线虫体壁肌细胞中的细胞毒性,通过肌肉特异性启动子unc-54在线虫肌肉中渐进性地表达Aβ基因,使线虫呈现渐近性瘫痪的表型。Aβ导致的瘫痪效应与年龄有关且依赖胰岛素信号途径,将Aβ表达在特定神经元如谷氨酸神经元中,线虫出现年龄依赖性的谷氨酸神经元退化变性[9]。这些Aβ转基因线虫体内的基因、蛋白分子及信号通路变化与AD病人脑内的变化有很多相似之处,对于药物筛选特别是有关Aβ解聚作用的药物研究具有重要的意义。Tab 1是秀丽隐杆线虫的Aβ 转基因模型[10]。

Fig 1 C.elegans pattern
2.2 Tau转基因线虫模型Tau蛋白过度磷酸化是AD的主要发病机制之一,Tau蛋白是一种微管结合蛋白,其过度磷酸化会降低与微管之间的亲和力,过度磷酸化的Tau蛋白聚集会引起神经元纤维缠结(AD主要病理学特征之一),最终导致细胞骨架的降解[11]。研究Tau蛋白的聚集、高度磷酸化及转录后调控是近年来AD研究的热点之一。Tau转基因线虫模型着重于tau基因的表达变化,通过其在线虫体内特异性表达来模拟AD病人由Tau异常所造成的神经损伤。在线虫中存在一种ptl-1的基因来负责维持细胞结构稳定性,这种基因虽与tau基因具有直向同源性,但只在一小部分神经元中表达,Tau转基因线虫模型用表达人Tau蛋白突变体的线虫,可以避免内源性Tau的干扰。Kraemer等[12]在线虫中建立了Tau转基因模型P301L和V337M,这两种模型能够在触觉神经元细胞中分别特异性地过表达人的野生型和突变型tau基因,并且都会出现运动不协调的表型,当模型线虫中的触觉神经元失去其功能时,由于tau基因的过表达使得神经炎症增强,后期微管损失加重,大部分退化神经元在细胞体和神经元中产生Tau积累。Miyasaka1等[13]利用RNAi技术开发出在泛神经元中以不同水平表达人类Tau的转基因线虫,这种线虫以Tau蛋白表达依赖的方式表现出行为异常,用这些模型进一步实验发现,微管蛋白特异性伴侣或微管蛋白子集的敲低导致Tau毒性增强,即使在表达无异常行为的低表达Tau转基因线虫中也是如此。Tab 2是秀丽隐杆线虫的Tau转基因模型[14]。
2.3 Aβ和Tau双转基因线虫模型Wang等[15]将转Aβ1-42基因的线虫CL2355和Tau转基因线虫BR5270通过遗传杂交技术建立了双转基因的线虫模型UM001,与单转基因(Aβ1-42/Tau)线虫比较,能明显缩短线虫寿命,与野生型线虫N2比较,UM001后代的存活率下降以及产卵数目减少。五羟色胺作为中枢神经系统的神经递质能够调节多种生理功能,其含量及功能异常与AD等多种神经系统疾病的发病有关。通过遗传杂交获得的双转基因线虫神经系统功能减弱,趋化性联想学习记忆能力降低,五羟色胺能受到损伤,同时多巴胺能信号降低,进而丢失多巴胺能神经元。双转基因线虫中的Aβ1-42影响五羟色胺能神经功能,而Tau影响五羟色胺能和多巴胺能神经功能。此外,在基因异常表达方面,对双转基因线虫进行基因测序分析,有8个基因(ptch1、tbc1d16、wdfy3、arfgef2、ebf1、dao、grm1、p4ha2)与AD病人脑中的基因表达变化重合,这进一步表明双转基因线虫模型更接近AD病人神经病变的生物学特征,体现Aβ1-42和Tau呈现相互促进作用,加重毒性。
3 药物通过不同途径保护AD模型线虫
3.1 减少Aβ转基因线虫体内氧化应激水平氧化应激是指生物体细胞产生活性氧(reactive oxygen species,ROS)的不平衡,以及生物体在面对某些内源性或外源性刺激时抵消ROS这种不平衡的能力。Aβ诱导的氧化应激和毒性则是AD的主要危险因素,目前已研究出很多药物以抗氧化剂的形式减少Aβ诱导的氧化应激。如红曲素(monascin,MS)是一种来源于食用菌的次生代谢产物,是具有抗氧化作用的新型化合物。研究显示,MS能使CL2006和CL4176线虫的Aβ聚集量和瘫痪水平下降,在胡桃醌(250 μmol·L-1)诱导的氧化应激条件下,MS增加了线虫的存活率,减弱了线虫内源性ROS水平[16]。进一步用实时荧光定量PCR检测到MS增加了CL4176线虫中daf-16基因和抗氧化基因sod-1,sod-2,sod-3,hsp16.2的mRNA水平。在CL2006和CL4176线虫中进行daf-16 RNAi,发现MS未能使瘫痪水平降低,说明MS可能依赖DAF-16而发挥降低氧化应激和Aβ毒性的作用。

Tab 1 Aβ transgenic model of C.elegans
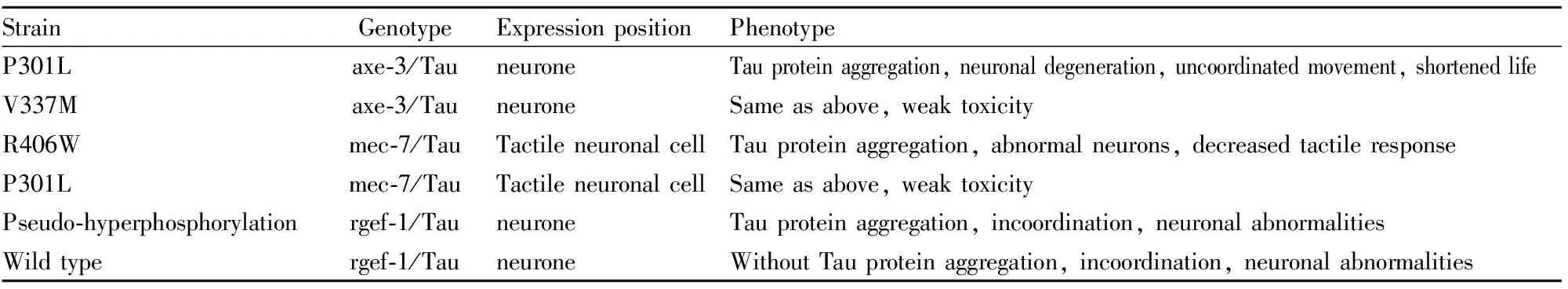
Tab 2 Tau transgenic model of C.elegans
三基数旱地菊水醇提取物(carqueja hydroalcoholic extract,CHE)和氧代异丙肾上腺素生物碱衍生物8-1也能增强氧化压力抗性,在氧化应激状态下通过不同的方式对线虫起到保护的作用。CHE既在氧化应激条件下通过提高野生型线虫的存活率并降低ROS水平来改善氧化压力抗性,而这种作用不依赖于转录因子(SKN-1和DAF-16)以及应激相关的信号通路(p38, JNK和ERK)。CHE还能增加蛋白酶体活性和两种热休克蛋白基因hsp-16.2、hsp-4的表达,进而提高CL4176线虫对Aβ毒性的防御能力[17]。氧代异丙肾上腺素生物碱衍生物8-1能够延迟GMC101线虫的麻痹表型,在H2O2诱导的急性氧化应激和百草枯诱导的慢性氧化应激条件下均可提高GMC101线虫的存活率,同时还能增强GMC101线虫中自噬起始基因bec-1的表达水平[18]。
3.2 抑制Aβ转基因线虫体内Aβ聚集从而降低毒性Aβ转基因线虫模型的主要特征是在线虫的特定神经元或肌肉细胞中存在Aβ基因的渐近性表达,使线虫表现出渐近性地瘫痪。一些天然产物和药物成分能够抑制CL4176、GMC101等模型线虫中的Aβ聚集,从而来降低Aβ诱导的毒性损伤。有研究显示,一种新型卟啉肽DhHP-6具有微过氧化物酶活性和细胞渗透性,能够有效抑制Aβ聚集并降低Aβ的β-折叠率[19]。DhHP-6 100 μmol·L-1能显著延长CL4176线虫的寿命,降低瘫痪表型,抑制Aβ 斑块形成从而降低Aβ诱导的神经毒性。此外,8-羟基喹啉(8-hydroxyquinolines,8-HQ)能以1~10 μmol·L-1的亲和力结合Aβ并抑制大寡聚体(>30 kDa)的形成,通过稳定小二聚体无毒Aβ构象异构体来中和具有神经毒性的Aβ寡聚体形成,用8-HQ处理也降低了GMC101线虫体内可溶性Aβ寡聚体的水平[20]。
3.3 维持蛋白质稳态改善Aβ转基因线虫的病理变化泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)负责控制细胞内许多关键过程相关蛋白质的降解,包括细胞周期和转录,以及蛋白质质量控制。蛋白酶体是UPS的重要组成成分之一,也是细胞蛋白水解网络的组成部分,通过对正常和异常蛋白的蛋白水解作用的调节来维持蛋白质稳态[21]。基于蛋白酶体在维持蛋白质稳态中的重要作用,科学家们从蛋白酶体出发进行了一系列的研究。
不同药物或活性成分能通过增加蛋白酶体活化特性或以DAF-16依赖的方式等多种途径来改善蛋白质稳态。研究显示,18α-甘草次酸(18a-glycyrrhetinic acid,18α-GA)具有蛋白酶体活化特性,可作为多细胞生物体中延长寿命和抗凝聚的因子[21]。18α-GA喂养线虫导致蛋白酶体活性增加,随着蛋白酶体活性的升高对Aβ模型线虫产生了一定的影响,如CL4176和CL2006的瘫痪率降低,CL2331和CL4176中的Aβ聚集减少等。线虫中的skn-1基因与人类Nrf基因具有同源性,能够维持UPS的表达和活性。当蛋白酶体基因表达和活性被阻断时,SKN-1能够发挥激活多类蛋白酶体亚基基因的作用,在一定条件下SKN-1会参与线虫中的蛋白酶体活化[22],18α-GA还能以SKN-1和蛋白酶体活化依赖性的方式延长线虫的寿命。有研究表明,饮食干预可以促进健康并有助于预防AD,蜂王浆及酶处理的蜂王浆补充剂均能延缓CL2006线虫的麻痹,发挥作用依赖于DAF-16和胰岛素/胰岛素样生长因子信号通路而不需要HSF-1和SKN-1[23]。蛋白质溶解度是蛋白质稳态的标志,蜂王浆及酶处理的蜂王浆补充剂以DAF-16依赖的方式改善了蛋白质稳态。
3.4 对抗Tau过度磷酸化减轻Tau转基因线虫的病理变化能量代谢受损是AD发病进展的重要标志,抑制能量代谢有关的线粒体酶——二氢硫辛酰胺脱氢酶(dihydrolipoamide dehydrogenase,DLD),可导致Tau转基因线虫VH255全身葡萄糖水平升高以及Tau磷酸化增加。此过程通过RNAi技术抑制dld-1基因或直接用抑制剂2-甲氧基吲哚-2-羧酸抑制DLD酶,最终诱导了线虫的高血糖和Tau磷酸化。钙离子载体A23187可以减少由DLD的化学或遗传抑制诱导的Tau磷酸化起到对线虫的保护作用,但它不能减少由高血糖诱导的Tau磷酸化[24]。
Tau模型线虫V337M表现出寿命缩短,运动不协调和磷酸化不溶性Tau积累的特征。Gamir-Morralla等[25]研究具有蛋白质抗聚集性的硫磺素T(thioflavin T,Th T)和一种具有高选择性的糖原合酶激酶-3抑制剂NP103对V337M线虫的影响,分别从寿命和运动表型方面进行检测。结果显示,Th T的不同浓度10、25、50 μmol·L-1均延长了V337M线虫的寿命,NP103浓度为100 μmol·L-1时改善了V337M线虫的麻痹表型,但对寿命没有显著影响。
4 结语
AD是一种严重威胁人类健康的疾病,目前尚无确切的治疗方法,使用一种经济高效的动物模型对AD的药物研究及筛选至关重要。线虫作为模型生物具备神经系统简单、正向遗传、容易进行RNAi、构建转基因体系等优点,与大鼠、小鼠等模型相比用药方便,饲养简单,成为能够研究AD等神经退行性疾病的重要手段。通过不同的技术手段建立的Aβ转基因及Tau转基因线虫模型较多,目前应用Tau转基因线虫研究Tau蛋白的损伤机制及AD药物的筛选与利用Aβ转基因线虫进行的研究相比较少,利用Tau模型线虫还有着很大的研究空间。因此,利用线虫进行抗AD等神经退行性疾病药物的毒性评价及药物筛选具有广阔的应用前景。
