紫花地丁止痒复方对RBL-2H3细胞脱颗粒的影响
2020-03-20贾婷婷高雅茹曾海荣
张 蝶,王 玮,贾婷婷,袁 夏,高雅茹,袁 易,曾海荣
(上海中医药大学附属普陀医院药学部,上海 200062)
过敏性皮炎是机体与环境中过敏原接触引起免疫系统失调而导致的过敏性皮肤病[1-2],是一个慢性、易复发的炎症性皮肤疾病。过敏性皮炎的发生是由一系列过敏原致敏、肥大细胞激活、免疫细胞应答的复杂过程[3]。肥大细胞是过敏反应的效应细胞,通常存在于抗原介导的过敏反应中,在过敏性皮肤病以及炎症过程中发挥重要作用[4]。B细胞产生的特异性IgE抗原,与肥大细胞表面高亲和力的IgE抗体结合,导致Ca2+内流,引起肥大细胞脱颗粒,释放生物活性物质,渗透到组织间引起皮炎症状的发生[5]。本研究以类肥大细胞RBL-2H3为研究对象,考察紫花地丁止痒复方(Violayedoensismakino antiitching compound, VYAC)对过敏性皮炎中肥大细胞脱颗粒的影响及机制。
1 材料
1.1 细胞株与试剂大鼠嗜碱性白血病细胞株RBL-2H3,购于中科院细胞库。紫花地丁(批号:141118-201411)、苦参(批号:141006-201410)、白鲜皮(批号:140821-201408),购于上海康桥中药饮片有限公司,经上海中医药大学教学实验中心高级实验员李俊松鉴定合格,其拉丁名分别为紫花地丁(ViolayedoensisMakino)、苦参(SophoraflavescensAiton)、白鲜皮(DictamnusdasycarpusTurcz);DMEM购于美国Gibco公司;胎牛血清(FBS)购于美国HyClone公司;牛血清白蛋白(BSA)、Fluo-3AM,购于北京Solaibo公司;Immobilon ECL发光液、BCA蛋白测定试剂盒,购于美国Thermo Scientific公司;抗体Syk、p-Syk、PI3K、Akt、p-Akt、β-acitn,均购于美国Cell Signaling Technology公司;CCK-8试剂盒,购于南京建成生物科技有限公司;C48/80、4-硝基苯基-N-乙酰-β-D-氨基半乳糖苷,购于美国Sigma公司;组胺ELISA试剂盒,购于德国Nordhorn公司;台盼蓝染液,购于美国Invitrogen公司。
1.2 仪器Delta series生物安全柜(美国Labconco公司);HEPA CLASS100 CO2培养箱、多功能酶标仪(美国Thermo公司);Countes II FL全自动细胞计数仪(美国Life Technologies公司);倒置式生物显微镜TS100-F(日本尼康公司);凝胶成像分析系统(美国BIO-RAD公司);Centrifuge5810 R低温高速离心机(德国Eppendorf公司)。
2 方法
2.1 VYAC提取物制备VYAC为上海中医药大学附属曙光医院张伟荣教授的临床验方,经临床长期验证其安全有效。该方具有清热解毒、祛风止痒等功效,主要用于湿疹、荨麻疹和皮肤瘙痒等症。主要由紫花地丁、苦参、白鲜皮组成。紫花地丁30 g、苦参15 g、白鲜皮15 g加10倍量水,浸泡30 min,减压回流提取2次,每次1 h,合并滤液,浓缩,真空冷冻干燥待用,具体的提取工艺及质量标准参见已发表的文章[6-7]。
2.2 细胞培养RBL-2H3细胞用含有10%胎牛血清、1%双抗的DMEM培养基,置于37 ℃、5% CO2恒温细胞培养箱中培养,取对数生长期的细胞,调整细胞数进行传代及后续实验。
2.3 CCK-8检测VYAC对RBL-2H3细胞存活率的影响取对数期生长期的RBL-2H3细胞,用0.25%胰酶消化,DMEM完全培养基稀释成单细胞悬液,调整细胞浓度为8×107·L-1细胞悬液,100 μL每孔接种于96孔板,每组3个复孔,外围一圈边缘孔用等量无菌PBS填充。细胞过夜贴壁后,将孔内的培养基换成100 μL含终浓度为6.25、12.5、25、50、100、200、400、800、1 000 mg·L-1的VYAC培养液,正常对照及空白组加入等量无药培养液。培养箱培养24 h,每孔加上10 μL CCK-8溶液,继续培养2 h,于酶标仪450 nm波长测定吸光度,计算细胞存活率,细胞存活率/%=(A加药-A空白)/(A对照-A空白)×100%。
2.4 C48/80刺激RBL-2H3细胞脱颗粒取对数生长期细胞,以2×108·L-1细胞悬液1 mL接种于24孔板,37 ℃培养箱过夜,1 mL PBS洗涤2次,加入200 μL终浓度为5、10、50、100、150、200、250、300 mg·L-1的C48/80培养液,同时设置不加C48/80的空白对照组,2个复孔。37 ℃培养箱继续培养1 h,冰浴10 min终止反应,检查细胞脱颗粒情况。
2.4.1细胞形态学分析 终止反应后,于倒置显微镜下观察细胞的形态变化,并拍照分析。
2.4.2台盼蓝染色 终止反应后,吸去培养液,加入终浓度为40 g·L-1的台盼蓝染液,室温染色3 min,倒置显微镜下观察,并计数200个细胞中染色的细胞数,计数细胞的脱颗粒率,脱颗粒率/%=染色细胞数/200个细胞数×100%
2.4.3β-氨基己糖胺酶释放率检测 终止反应后,吸取培养液,离心取上清50 μL于96孔板中,同时用0.1% TritonX-100裂解空白对照组细胞,收集裂解液,离心取上清50 μL作为总酶上清液于96孔板中。加入1 mmol·L-1的底物(0.1 mol·L-1,pH 5的柠檬酸钠缓冲溶液配制)50 μL,同时设置空白对照孔,37 ℃培养箱孵育1 h。加入150 μL 0.1 mol·L-1的Na2CO3/NaHCO3(pH 10.5)缓冲液终止反应,于酶标仪405 nm测吸光度值,计算β-氨基己糖胺酶稀释率,β-氨基己糖胺酶释放率/%=(A实验组上清-A空白组上清)/(A总酶孔上清-A空白组上清)×100%
2.5 VYAC对C48/80刺激的RBL-2H3细胞脱颗粒的影响取对数生长期细胞,以2×108·L-1细胞悬液1 mL接种于24孔板,37 ℃培养箱过夜,1 mL PBS洗涤2次,加入1 mL终浓度为6.25、12.5、25、50、100、200、400、800 mg·L-1的VYAC培养液培养12 h,同时设置不加药对照孔,然后加入终浓度为100 mg·L-1的C48/80继续孵育1 h,对照孔加入等量的PBS,冰浴10 min终止反应,离心取上清。台盼蓝染色,计算细胞脱颗粒率;检测上清中β-氨基己糖胺酶含量,计算稀释率;检测上清中组胺含量,根据组胺ELISA试剂盒操作手册检测上清中的组胺含量。
2.6 VYAC对C48/80刺激的RBL-2H3细胞内Ca2+浓度的影响取对数生长期细胞,以2×108·L-1细胞悬液2 mL接种于6孔板,37 ℃培养箱过夜,分别加入终浓度为25、50、100 mg·L-1的VYAC培养液培养12 h,然后加入终浓度为100 mg·L-1的C48/80继续孵育1 h。消化细胞,用无钙的D-Hanks缓冲液洗2遍,加入100 μL 的Fluo-3AM (终浓度为5 μmol·L-1) 避光孵育30 min,离心去上清,用无钙的D-Hanks缓冲液洗2遍,去除残留的Fluo-3AM,加入200 μL无钙的D-Hanks缓冲液继续孵育30 min,确保Fluo-3AM在细胞内完全酯化,倒置荧光显微镜观察荧光强弱并拍照。
2.7 VYAC对C48/80刺激的RBL-2H3细胞相关蛋白表达的影响取对数生长期细胞,以2×108·L-1细胞悬液2 mL接种于6孔板,37 ℃培养箱过夜,分别加入终浓度为25、100 mg·L-1的VYAC培养液培养12 h,然后加入终浓度为100 mg·L-1的C48/80继续孵育1 h。RIPA裂解液提取蛋白,蛋白定量变性后。SDS-PAGE凝胶电泳分离,上样量30 μg,电转至PVDF膜,5%脱脂奶粉封闭,一抗4 ℃孵育过夜,二抗室温孵育1 h,采用凝胶成像系统拍照,并用灰度分析软件对所得条带进行定量分析,β-actin作为内参。
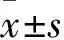
3 结果
3.1 VYAC不影响RBL-2H3细胞存活Fig 1的CCK-8结果显示,VYAC在剂量800 mg·L-1以下时对细胞的存活率无明显影响,差异无统计意义(P>0.05),只有在1 000 mg·L-1的剂量时才显示一定的抑制作用(P<0.01)。

Fig 1 Effect of VYAC on survival rate of
**P<0.01vscontrol (0 mg·L-1)
3.2 C48/80刺激RBL-2H3细胞脱颗粒RBL-2H3细胞加入C48/80(5、10、50、100、150、200、250、300 mg·L-1)培养液孵育1 h,从形态学可以看出,不加C48/80的细胞呈梭形,10 mg·L-1的C48/80少数细胞变圆,50 mg·L-1的C48/80大多数细胞变圆、膨胀,≥100 mg·L-1的C48/80细胞基本变圆,膨胀(Fig 2A)。台盼蓝染色结果显示(Fig 2B),不加C48/48细胞形态正常,未染色,加不同浓度的C48/80细胞不同程度的染色,但C48/48浓度为100 mg·L-1时,细胞大部分染色,且细胞脱颗粒达74%(Fig 2D)。由β-氨基己糖胺酶释放结果知(Fig 2C),在一定范围内,随着C48/80浓度增加,细胞培养上清液中β-氨基己糖胺酶释放也增加,但C48/48浓度≥100 mg·L-1时,β-氨基己糖胺酶释放达最大值,且变化不大。由以上结果得出,C48/80浓度为100 mg·L-1时,RBL-2H3细胞脱颗粒效果最明显,后续实验以此浓度来刺激细胞脱颗粒。
3.3 VYAC抑制C48/80诱导的RBL-2H3细胞脱颗粒100 mg·L-1的C48/80刺激RBL-2H3脱颗粒,不同终浓度的VYAC(6.25、12.5、25、50、100、200、400、800 mg·L-1)培养液作用下,与对照组相比,VYAC明显抑制β-氨基己糖胺酶和组胺的释放(P<0.05),且呈剂量依赖(Fig 3A、3B)。台盼蓝染色结果(Fig 3C、3D)示,C48/80刺激后,细胞大部分染色,脱颗粒率达77%,紫花地丁止痒复方(25、50、100 mg·L-1)作用后,细胞染色情况逐渐减少,脱颗粒率也减少,差异具有显著性(P<0.05)。
3.4 VYAC降低C48/80刺激的RBL-2H3细胞内Ca2+浓度荧光显微镜观察细胞内游离Ca2+浓度,100 mg·L-1的C48/80刺激RBL-2H3细胞后,细胞内荧光强度明显增强,表明细胞内游离Ca2+明显增多,VYAC(25、50、100 mg·L-1)作用于细胞后,细胞内荧光强度逐渐减弱,表明VYAC能够有效抑制C48/80刺激的RBL-2H3细胞脱颗粒(Fig 4)。
3.5 VYAC调控C48/80刺激的RBL-2H3细胞相关蛋白表达Fig 5的Western blot结果显示,100 mg·L-1的C48/80刺激RBL-2H3细胞后相关蛋白明显发生变化,与对照组相比,C48/80刺激使Syk蛋白发生磷酸化,是正常对照组的2.31倍,PI3K的表达升高至3.32倍,Akt蛋白发生磷酸化,是正常对照组的2.90倍,差异有统计学意义(P<0.05),但是Syk和Akt的表达变化不明显。VYAC作用后明显抑制这种变化,相比模型组,VYAC(25 mg·L-1)分别使p-Syk降低了46.69%,PI3K的表达降低了6.16%,p-Akt降低了25.67%;VYAC(100 mg·L-1)分别使p-Syk降低了86.68%,PI3K的表达降低了77.23%,p-Akt降低了46.24%,差异就有统计意义(P<0.05),但是对Syk和Akt的表达变化不明显。
4 讨论
肥大细胞的激活引起细胞脱颗粒是过敏反应的主要特征,其释放出的活性介质(组胺、β-氨基己糖胺酶、白三烯、前列腺素等)及促炎细胞因子(IL-4、TNF-α、IL-1β等),是促进过敏性皮炎发生发展的主要因素。肥大细胞膜表面具有丰富的高亲和力的IgE受体(FcεR1),当机体再再次接触过敏原时,Th2细胞迅速将特异性IgE抗原呈递到肥大细胞表面,与高亲和力的IgE受体(FcεR1)结合,激活肥大细胞发生脱颗粒[5]。大量的研究显示,脾酪氨酸激酶(Syk)是FcεR1介导的肥大细胞脱颗粒的一个很关键的调节因子[8],抑制Syk磷酸化可以阻断肥大细胞脱颗粒现象[9]。抗原特异性的 IgE与高亲和力的IgE受体(FcεR1)结合,使Syk磷酸化,并且激活下游的信号分子PLC-γ及PI3K,使Akt磷酸化,Ca2+内流,造成细胞脱颗粒,释放活性介质[10]。同时,细胞内高浓度的Ca2+激活PKC及NF-κB信号通路,释放炎症相关因子,引起炎症反应[11-12],促进过敏性皮炎的发生发展。
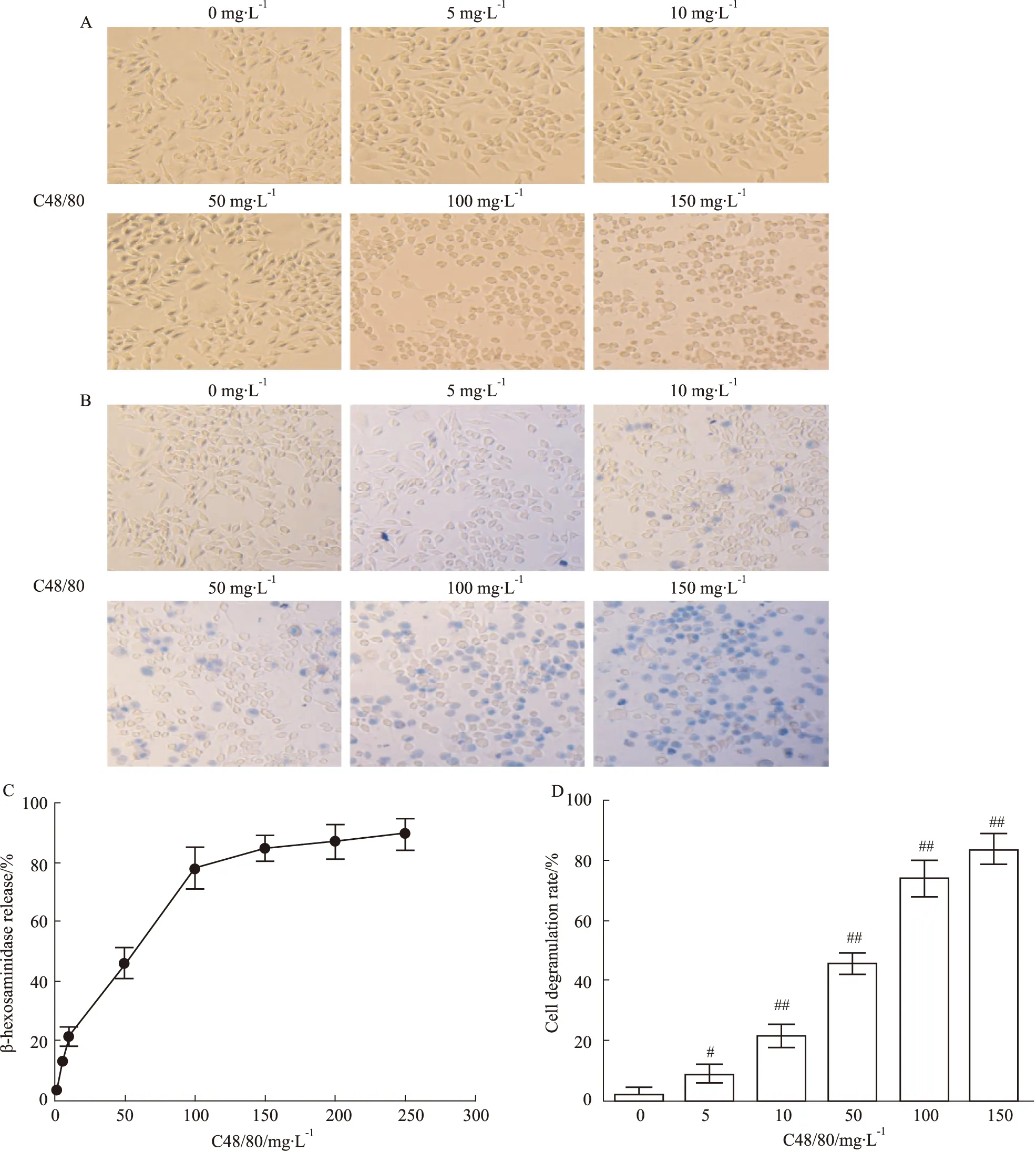
Fig 2 Effects of C48/80 on degranulation of RBL-2H3 cells n=3)
A: Cell morphological change induced by different mass concentrations of C48/80; B: Trypan blue staining after treated with C48/80; C: β-hexosaminidase release of cells induced by different mass concentrations of C48/80; D: Cell degranulation rate induced by different mass concentrations of C48/80.#P<0.05,##P<0.01vscontrol group (0 mg·L-1).
VYAC是根据临床经验所得出的治疗外科许多疾病所表现出的瘙痒症状的方剂,由紫花地丁、苦参、白鲜皮组成。因《内经》中病机理论有云:“诸痛疮疡,皆属于心”,而方中紫花地丁苦寒,又归心、肝经,功善清热解毒、消痈散结,是以在本方中为君药[13]。臣以苦参,因其性味苦寒,且入心、肝、胃、大肠及膀胱经,善祛风、杀虫止痒为诸多皮肤顽疾所常用[14-15]。而白鲜皮性味苦寒,功善清热燥湿、解毒、祛风止痒,为治疗皮肤湿疹、湿疮、疥藓的常用药。与苦参配伍煎汤外用有良好的祛风止痒作用。纵观全方以清热燥湿和祛风药为主,虽然只有紫花地丁等三味药组成,但三味药都针对现在临床所见的引起瘙痒的主要病因即湿热毒邪和风邪进行治疗。
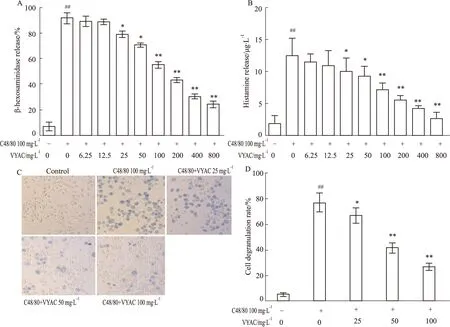
Fig 3 Effects of VYAC on degranulation of RBL-2H3 cells stimulated by C48/80 n=3).
A: The β-hexosaminidase release after treated with VYAC; B: The histamine release after treated with VYAC; C: Trypan blue staining after treated with VYAC; D: Cell degranulation rate after treated with VYAC.##P<0.01vscontrol group;*P<0.05,**P<0.01vsC48/80 group.

Fig 4 Effects of VYAC on intracellular concentration of Ca2+ in RBL-2H3 cells stimulated by C48/80
综上,VYAC对RBL-2H3显示很小的毒性;而且对C48/80诱导的RBL-2H3细胞脱颗粒有明显的抑制作用;对组胺、β-氨基己糖胺酶的释放呈剂量依赖的抑制;能够明显抑制致敏肥大细胞Ca2+内流,降低细胞内Ca2+浓度;而且能够抑制Syk、AKT磷酸化,降低PI3K蛋白表达。VYAC抑制RBL-2H3细胞脱颗粒机制可能通过Syk/PI3K/Akt通路,从而抑制Ca2+内流,抑制脱颗粒。
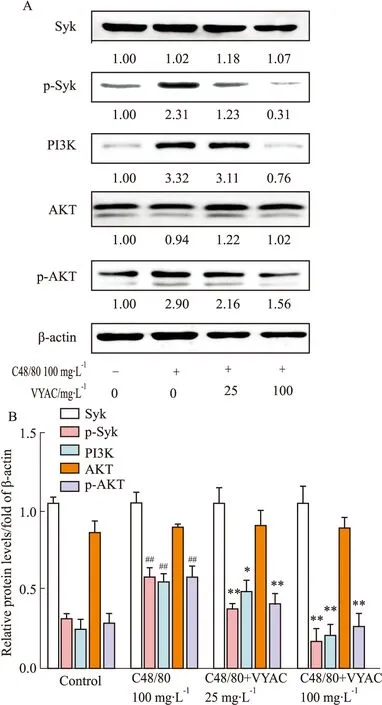
Fig 5 Effects of VYAC on expression of related proteins in RBL-2H3 cells stimulated by C48/80 n=3)
##P<0.01vscontrol group;*P<0.05,**P<0.01vsC48/80 group.
(致谢:本实验在上海中医药大学附属普陀医院中心实验室完成,在此感谢王冰老师在实验中给予的帮助与支持。)
