辐射表达载体Egr1-survivin shRNA联合放疗对食管鳞癌ECA109细胞放疗敏感性的影响
2020-03-20王海峰阿曼姑丽艾合买提陆艳荣张瑾熔
王海峰,阿曼姑丽·艾合买提,陆艳荣,吕 茵,张瑾熔
食管癌是常见的消化系统恶性肿瘤,2018年全球食管癌新发病例57.20万例,占全球恶性肿瘤发病率第7位;死亡病例50.86万例,占全球恶性肿瘤死亡率第6位[1]。我国是食管癌高发地区,据中国国家癌症中心统计的数据,2015年我国食管癌新发24.6万例,死亡18.8万例,分别占恶性肿瘤发病及死亡率的第6位及第4位[2],我国的食管癌的新发病例数及死亡人数几乎占世界的一半。放射治疗是不能手术的中晚期食管癌最主要的治疗手段[3],但放射治疗的效果并不令人满意。张安度等[4]报道,尽管采用三维适形放疗技术,食管癌放疗的5年生存率也只有24.5%。孔雁等[5]发现,局部未控或复发仍然是放疗失败的首要原因。
survivin是凋亡抑制蛋白(inhibitor of apoptosis proreins,IAPs)家族最小的成员,其可与多种内源性及外源性途径的凋亡调控因子相互作用,明显地抑制凋亡的发生[6],是食管癌细胞放射抵抗的重要原因之一,可作为增加食管鳞癌放疗敏感性的治疗靶点[7, 8]。Egr1基因属于即刻早期基因家族(immediate early genes,IEGs)的成员,其启动子含有辐射感应组件,使其能被放射线所诱导而表达增高。有学者提出了将Egr1基因的启动子序列与需要表达的基因序列连接,用电离辐射驱动Egr1基因的启动子带动目的基因高表达的基因-放射治疗理论。其研究结果表明,电离辐射可明显诱导重组质粒中位于Egr1启动子下游的目的基因表达增强,其抑瘤效应明显优于单纯放疗和单纯基因治疗[9, 10]。基于以上研究,本研究以survivin作为治疗靶点,利用Egr1基因启动子,构建Egr1-survivin shRNA质粒,转染食管鳞癌细胞,来证实此种方法是否会进一步促进食管癌细胞凋亡,增加食管癌细胞的放射敏感性。
1 材料与方法
1.1 材料 细胞株:ECA109细胞购自中国典型培养物保藏中心。pAAV-EGR1 promoter-survivin shRNA质粒由武汉维诺赛生物技术有限公司合成。细胞培养于RPMI-1640+10%胎牛血清+1%双抗中。Lipofectamine2000转染试剂(invitrogen),Trizol(Aidlab),HiScript Reverse Transcriptase (RNase H)、50×ROX Reference Dye 2、SYBR Green Master Mix(VAZYME),Taq Plus DNA Polymerase(TIANGEN),RIPA裂解液、BCA蛋白浓度测定试剂盒(碧云天),兔多抗GAPDH(杭州贤至生物),兔多抗survivin(武汉三鹰生物),HRP标记羊抗小鼠二抗(武汉博士德生物),ECL底物液(Thermo),X光胶片(柯达),显影定影试剂盒(天津市汉中摄影材料厂),细胞周期检测试剂盒(南京凯基生物公司),APC/7-AAD细胞凋亡试剂盒(三箭生物)。
1.2 细胞分组处理 食管癌ECA109细胞按照处理方式分为:(1)空白对照组,不加任何处理+放疗;(2)空载体对照组,转染空载体质粒+放疗;(3)Egr1-survivin shRNA组,转染pAAV-EGR1 promoter-survivin shRNA质粒+放疗;(4)YM155组,YM155处理+放疗。每组设置3个复孔。转染用LipofectamineTM2000脂质体转染法,具体操作步骤依照转染试剂盒说明书。测定食管癌ECA109细胞YM155的IC50值为5 nM。向加入细胞培养后的6孔板加入YM155溶液,调节YM155的终浓度5 nM。转染及YM155处理48 h后进行细胞照射,照射方法为:6 MV-X 射线进行室温垂直照射,剂量率200 cGy/min,10 cm×10 cm照射野,100 cm源皮距,照射剂量单次4 Gy,照射后24 h收获细胞进行各项检测。
1.3 qPCR检测各处理组ECA109细胞survivin mRNA水平 利用Trizol法提取细胞总RNA,测定RNA的纯度和浓度后,取1 μg按逆转录试剂盒说明书合成cDNA。合成的cDNA做10倍稀释,进行qPCR检测。qPCR反应体系:cDNA4 μl,Forward Primer (10 μM) 0.4 μl,Reverse Primer (10 μM)0.4 μl,SYBR Green Master Mix10 μl,50×ROX Reference Dye20.4 μl,ddH2O 4.8 μl;反应条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 30 sec ,60 ℃ 30 s,40 cycles。绘制溶解曲线,最终数据以2-ΔΔCt进行分析。survivin引物序列:F: 5′-CCCTTTCTCAAGGACCACCGCATCT-3′,R: 5′-CTCGTTCTCAGTGGGGCAGTGGATG-3′。GAPDH引物序列:F: 5′-AAGCCGTTCTTGACAAATGG-3′,R: 5′-ATTGGTGTTGGCCTTCAGAC-3′。
1.4 Western-Blot检测各处理组ECA109细胞survivin蛋白水平 向按分组处理好的细胞加入RIPA裂解液,于冰上充分裂解后收集上清至预冷EP管中,于4 ℃下12 000 r/min离心5 min。取上清用BCA法测定蛋白浓度。后将提取的蛋白充分变性,调整每个样品蛋白上样量为40 μg,进行SPS-PAGE电泳,电泳结束后在0 ℃恒流条件下电转膜,转膜条件:survivin 200 mA 50 min,GAPDH 200 mA 90 min,将蛋白转移至PVDF膜上后用含5%脱脂奶粉的TBST封闭、洗膜后,进行抗体杂交,经一抗、二抗孵育后X光显影,扫描胶片,用BandScan分析胶片灰度值进行分析。
1.5 流式细胞仪检测各处理组细胞周期和凋亡 将按不同分组处理后细胞于培养箱培养48 h后,0.25%胰酶消化细胞,1200 r/min,5 min离心,分别收集各处理组细胞。细胞周期检测:加PBS洗涤一次,加入100 μl PBS重悬细胞后,缓慢加入700 μl预冷的80%乙醇,4 ℃固定4 h以上,预冷PBS洗涤2次,加入400 μl PI(50 μg/ml),4 ℃避光染色30 min,后用流式细胞仪检测细胞周期。细胞凋亡检测:加PBS洗涤2次,按照APC/7-AAD细胞凋亡检测试剂盒操作说明进行:(1)加入500 μl Binding Buffer,重悬细胞;(2)5 μl 7-AAD混匀后加入5 μl APC,混匀;(3)室温避光反应5~15 min,流式细胞仪上机检测细胞凋亡。
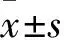
2 结 果
2.1 各处理组ECA109细胞survivin mRNA及蛋白的表达结果 从表1、图1的qPCR及Western-Blot检测结果可见,Egr1-survivin shRNA+放疗组ECA109细胞survivin mRNA及蛋白的相对表达量明显低于单纯放疗的空白对照组和空载体对照组,各组间差异均有统计学意义(P<0.01);mRNA水平Egr1-survivin shRNA组低于YM155+放疗组(P<0.01),但在蛋白水平其差异无统计学意义(P<0.102)。YM155+放疗组survivin mRNA及蛋白的相对表达量也明显低于空白对照组和空载体对照组(P<0.01)。


组别survivin mRNAsurvivin蛋白空白对照组1.050±0.109①0.838±0.035①空载体对照组1.026±0.169①0.869±0.059①Egr1-survivin shRNA组0.497±0.1120.447±0.064YM155组0.747±0.092①0.544±0.088
注:与Egr1-survivin shRNA组比较, ①P<0.01

图1 食管鳞癌ECA109细胞各处理组 survivin 蛋白表达结果
1.空白对照组; 2.空载体对照组; 3.Egr1-survivin shRNA组; 4.YM155组
2.2 流式细胞仪检测ECA109细胞各处理组细胞周期的结果 从表2、图2细胞周期检测结果可见,经Egr1-survivin shRNA+放疗及YM155+放疗处理后,ECA109细胞的细胞周期分布发生明显变化,G2期与S期细胞比例明显增加。Egr1-survivin shRNA组G2,S期细胞比例明显高于空白对照组和空载体对照组,Egr1-survivin shRNA组与这两组的G2,S期差异均有统计学意义(P<0.01)。Egr1-survivin shRNA组与YM155组相比,G2期Egr1-survivin shRNA组高于YM155组,S期低于YM155组,差异均有统计学意义(P<0.01)。


组别G1G2S空白对照组83.02±1.345.22±0.17①11.76±1.26①空载体对照组82.51±0.146.01±0.42①11.47±0.30①Egr1-survivin shRNA组55.24±0.5819.07±0.4025.69±0.19YM155组50.68±0.2513.10±0.43①36.22±0.29①
注:与Egr1-survivin shRNA组相比,①P<0.01
2.3 流式细胞仪检测 ECA109细胞各处理组凋亡的结果 ECA109细胞凋亡百分率:空白对照组1.56±0.59;空载体对照组1.91±0.30;Egr1-survivin shRNA组15.39±0.49;YM155组11.55±1.31。Egr1-survivin shRNA组及YM155组凋亡率均明显高于空白对照组和空载体对照组,Egr1-survivin shRNA组与YM155组相比凋亡率也明显增高,Egr1-survivin shRNA组与其他三组的细胞凋亡率差异均有统计学意义,(P<0.01)。经Egr1-survivin shRNA+放疗及YM155+放疗处理后,ECA109细胞的凋亡明显增加(图3)。

图2 食管鳞癌ECA109细胞各处理组细胞周期检测结果
1.空白对照组; 2.空载体对照组; 3.Egr1-survivin shRNA组; 4.YM155组

图3 食管鳞癌ECA109细胞各处理组凋亡检测结果
1.空白对照组; 2.空载体对照组; 3.Egr1-survivin shRNA组; 4.YM155组
3 讨 论
食管癌是我国常见的消化系统肿瘤,放疗是颈段及局部进展期胸段食管癌的主要根治手段,但放疗的疗效并不令人满意。张安度等[4]对1349例食管癌进行的三维适形放疗疗效分析,全组患者1、3、5年局控率分别为75.2%、54.5%、50.1%;1、3、5 年生存率分别为68.6%、36.2%、24.5%,中位生存期21个月。说明虽然随着放疗技术进入三维时代,食管癌放疗疗效仍有待于进一步提高。即便是近期完成的NEOCRTEC5010研究,其结果显示对于潜在可切除的胸段食管鳞癌,术前同步放化疗组的pCR率为43.2%,OS为100.1个月,较以前的治疗模式有明显提高[11],但与其他常见恶性肿瘤的疗效相比,食管癌放疗的生存期仍不能令人满意,急需探索新的治疗靶点和治疗理念。
survivin蛋白与食管癌的发生及进展密切相关,Dabrowski等[12]研究显示,survivin在食管鳞癌标本中表达明显升高,其阳性率可达83.33%,而且文献[7]显示其过表达与患者较差的预后相关。Egr1基因启动子区含有CArG盒/CC(A+T-rich)GG区的特殊结构,使Egr1基因能被放射线所诱导而表达增高。利用这一特点,我们以survivin作为治疗的靶点,利用可被电离辐射诱导的Egr1基因启动子,构建Egr1-survivin shRNA质粒,转染食管鳞癌ECA109细胞后用X射线照射,测定细胞内survivin的mRNA表达和蛋白水平的变化情况,并观察Egr1-survivin shRNA下调survivin基因后对ECA109细胞周期及凋亡的影响,以确定这种干预否会进一步增加食管癌细胞的放射敏感性,促进食管癌细胞死亡。
本研究结果显示,Egr1-survivin shRNA+放疗处理后,ECA109细胞survivin mRNA及蛋白的表达水平均较对照组明显下调,证实Egr1-survivin shRNA质粒合成是成功的,经X射线照射诱导,Egr1启动子确实带动了位于其下游合成质粒中的survivin shRNA表达增加,并进而降低了survivin mRNA及蛋白的表达,与文献[8]报道的通过survivin-shRNA转染可下调survivin的表达相一致。用以做阳性对照的是YM155+放疗处理,YM155是一种靶向survivin的小分子药物,其可与survivin基因的启动子区结合,从而选择性地抑制其表达[13]。文献[14]报道其可通过降低survivin表达而发挥放疗增敏作用,本研究也显示YM155+放疗处理后,ECA109细胞survivin mRNA及蛋白的表达水平较空白对照组及空载体组均明显下调,证实其所具有survivin基因的表达抑制作用。
本研究发现,Egr1-survivin shRNA+放疗处理后,ECA109细胞survivin mRNA及蛋白的表达水平均较三个对照组下调。伴随着survivin表达下调,G2期与S期细胞比例明显增加,发生了明显的G2期与S期阻滞,且细胞凋亡率明显增高,表明Egr1-survivin shRNA转染+放疗可明显增加食管癌细胞的放射敏感性。本研究与文献[10, 15-17 ]报道的结论类似,利用Egr1基因启动子,通过辐射诱导,带动不同的靶基因表达上调,其抑瘤效应明显优于单纯放疗和单纯基因治疗。
本研究结果显示,Egr1-survivin shRNA+放疗对于survivin表达的抑制在所有处理组中是最强的,相较于单纯放疗、YM155处理+放疗,可更大程度地降低survivin的表达。且经Egr1-survivin shRNA转染降低survivin后联合放疗,其促凋亡作用也强于YM155+放疗处理,证实此种方法相比于YM155处理,对于食管鳞癌细胞具有更强的放射增敏作用。由此可得出:Egr1-survivin shRNA联合放疗可进一步增加食管鳞癌细胞放疗敏感性,是一种有前景的食管癌治疗基因-放疗思路,有进一步研究价值。因本实验为细胞学研究,其得出的结论还有待于动物实验及人体的临床试验进一步证实。
