凡纳滨对虾养殖池塘硝化细菌的分离鉴定及脱氮效果研究
2020-03-20张达娟张树林王泽斌毕相东
张达娟,张树林,戴 伟,孔 欣,王泽斌,毕相东
( 1.天津农学院 水产学院,天津 300384; 2.天津市水产生态及养殖重点实验室,天津 300384 )
随着我国水产养殖集约化、高密度养殖模式的日益扩张,打破了池塘原有的生态平衡,长期养殖方式不当造成水体老化,因残饵、生物排泄物以及动植物尸体的分解,消耗氧气的同时产生大量有害物质,使养殖池塘生态环境遭到了严重的破坏[1-2]。养殖水体中氮的污染以氨氮和亚硝态氮的污染最为严重,易造成水质恶化,养殖生态遭到严重破坏,进而危害养殖动物,导致病害频发、水产品质量下降。有研究表明,养殖水体中高含量氨氮及亚硝态氮是鱼、虾发病的直接或间接因素[3-4]。广大水产养殖工作者一直致力于养殖水质的生物修复及改善养殖环境,开发出了水生植物修复、浮床植物修复以及微生物修复等技术[5],其中微生物修复技术因具有无污染、无残留、绿色安全可靠的特点而被广泛使用[6-9]。
养殖水体中氮循环需要经过氨化作用、亚硝化作用、硝化作用和反硝化作用来完成[5,10],这一系列反应中,微生物起着至关重要的驱动作用。研究表明,光合细菌、芽孢杆菌(Bacillus)、硝化细菌、乳酸杆菌(Lactobacillus)等在养殖水体氨氮和亚硝态氮去除中应用十分广泛,而且也是最为经济生态环保的方法。在养殖池塘中投放一定量的光合细菌、硝化细菌等有益菌,能显著去除水体中氨氮、亚硝态氮和有机物,增加水中溶解氧,稳定水体pH,弧菌(Vibrio)和气单胞菌(Aeromonas)等致病菌所占比例明显降低[11-13]。此外,由于益生菌的大量繁殖,在池内形成优势种群,提高了水体的微生物多样性,抑制了病原微生物的繁殖,减少疾病的发生[14]。根据水产养殖可持续发展的观点,建立洁净养殖模式,合理利用复合微生物制剂有效地控制养殖动物病害的发生是保持水产养殖业健康、稳定发展的重要方式。
自第一株好氧反硝化细菌被分离后,国内外已有诸多相关研究,旨在有效去除水体的氨氮和亚硝酸态氮,改善水产养殖条件。本研究通过对凡纳滨对虾(Litopenaeusvannamei)养殖池塘水体和底泥中细菌进行分离、纯化、鉴定,并对自然水体的净化作用的模拟试验,旨在筛选有益菌,为其应用于水产养殖、调节水质提供理论依据。
1 材料与方法
1.1 样品来源
在天津宁河区凡纳滨对虾养殖池塘采集泥样和水样,带回实验室后立即进行分离培养。
1.2 菌种分离及纯化
按配方[7]配制异养硝化培养基。细菌分离方法[15]:取水样和泥样悬浊液各1 mL,进行梯度稀释,得到10-1~10-5的稀释液,吸取10-3、10-4、10-5不同稀释倍数的水样和泥样菌悬液各0.1 mL涂布在固体培养基上,30 ℃,恒温培养2~3 d。再将培养得到的不同形态特点的细菌分别进行划线分离,直至得到单一的菌落为止。
1.3 细菌形态学鉴定
将分离得到的菌株进行革兰氏染色,并在显微镜下观察、记录菌落形态特点[16-17]。
1.4 16S rDNA序列测定及同源性比较
将分离菌株送往上海生工生物测序公司,测定菌株的16S rDNA序列,将结果与美国国立生物技术信息中心数据库中的模式菌株16S rDNA基因序列做同源性比较。
1.5 分离细菌对模拟养殖水体的净化效果测定
取养殖用水,抽滤后,分装到15个锥形瓶中,每瓶250 mL,向各水样瓶中分别接入5株分离得到的菌株(每株菌设3个平行),每个水样瓶中菌株的最终密度为2×107cfu/mL。接种后,将水样置于30 ℃、120 r/min培养箱中培养48 h,每8 h取50 mL水样测定水体硝态氮、亚硝态氮及氨氮的质量浓度,测定方法参照《水和废水监测分析方法》[18]进行。
1.6 数据分析
细菌对模拟养殖水体的净化效果试验数据以平均值±标准差表示,在统计软件SPSS 19.0中利用单因素方差分析对数据进行分析比较,P<0.05具有显著差异,P<0.01具有极显著差异。
2 结果与分析
2.1 分离细菌形态及染色
分离出形态不同的细菌5株,编号分别为A1、A2、A3、A5、A6,除A6为革兰氏阳性菌外,其他菌株均为革兰氏阴性菌。主要形态学特点见表1。
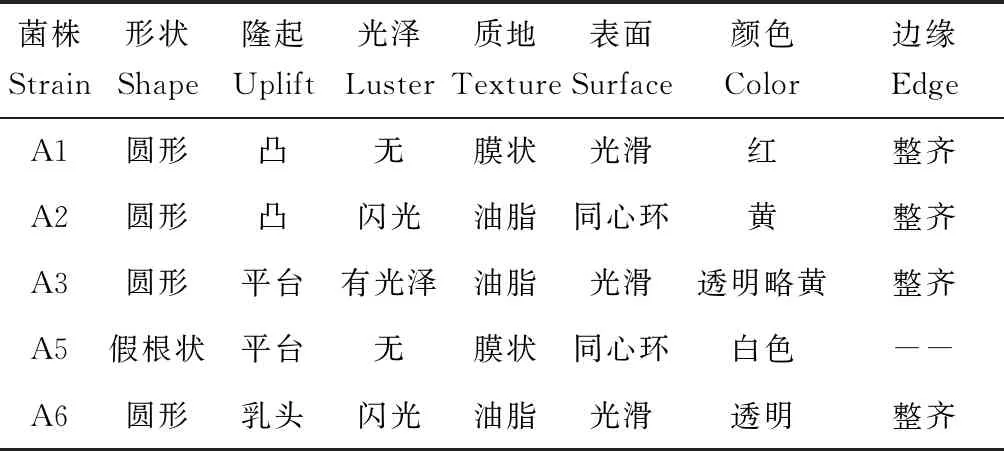
表1 菌株的菌落形态特征Tab.1 The morphological characteristics of strain colonies
2.2 细菌分子生物学的初步鉴定
各株细菌的16S rDNA序列测定发现,菌株A1、A2、A3、A5、A6分别与门多萨假单胞菌(Pseudomonasmendocina)、嗜氨甲基杆菌(Methylobacteriumaminovorans)、放射根瘤菌(Rhizobiumradiobacter)、施氏假单胞菌(Pseudomonasstutzeri)和氧化微杆菌(Microbacteriumoxydans)的同源性最高,根据其生物学分析初步鉴定结果见表2。
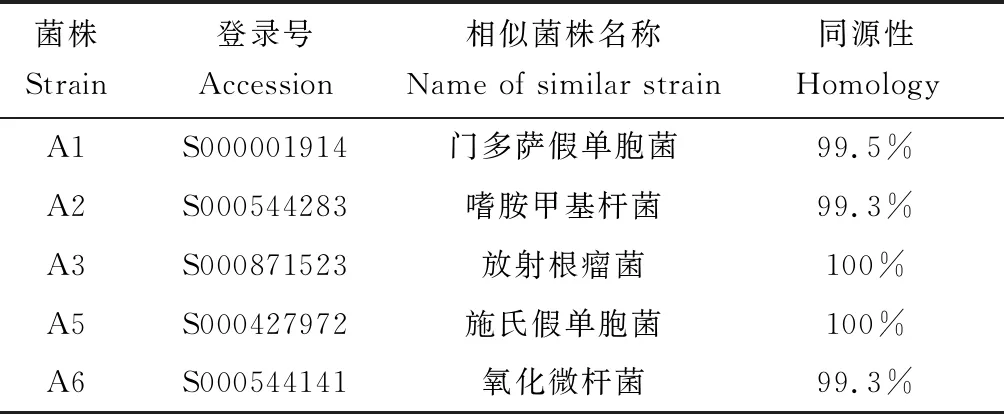
表2 菌株的16S rDNA同源性比较Tab.2 Homological comparison of 16S rDNA sequence in different strains
2.3 不同菌株对养殖水体的净化能力
分离鉴定出的5株菌对养殖水体的氨氮均有一定的去除作用(图1、图2)。培养开始时,水体的氨氮含量约为0.08 mg/L,在8 h时,施氏假单胞菌处理组中氨氮质量浓度为0.038 mg/L,降低了0.042 mg/L,显著低于其他处理组(P<0.05)。随着培养时间的延长,施氏假单胞菌对氨氮的去除率始终维持在较高水平;接入菌株40 h后,除放射根瘤菌和氧化微杆菌处理组外,其他组中氨氮含量均显著降低(P<0.05),门多萨假单胞菌、嗜胺甲基杆菌及施氏假单胞菌对氨氮的去除率均高于80.0%,显著高于放射根瘤菌和氧化微杆菌(P<0.05)。
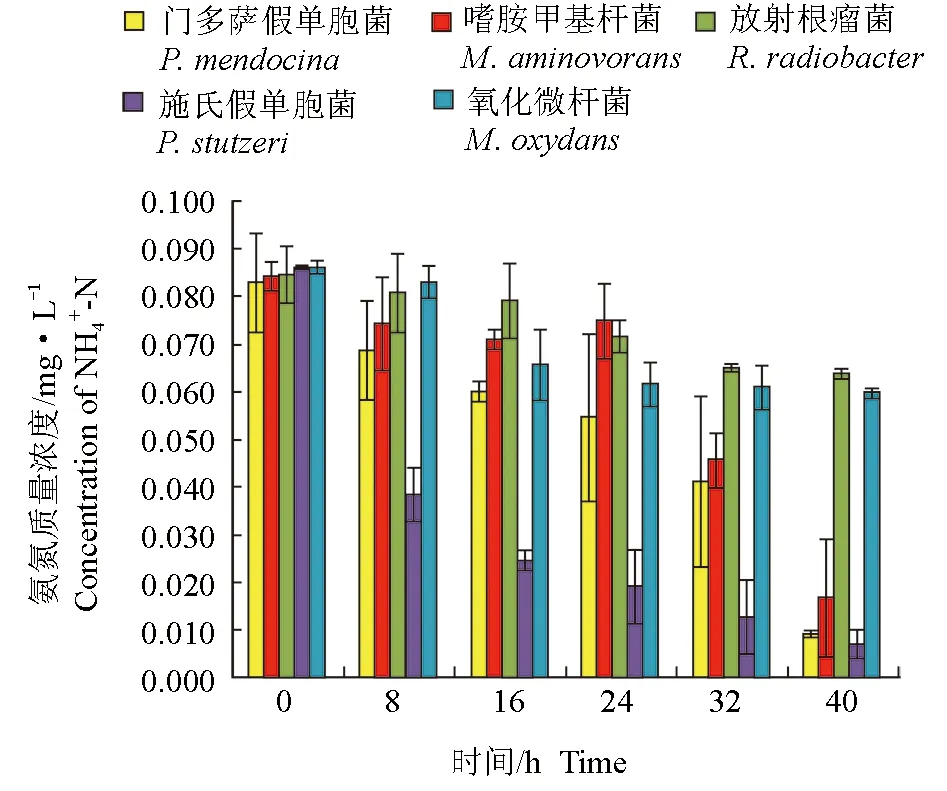
图1 接入菌株后不同时间养殖水体中氨氮含量变化Fig.1 The content of NH4+-N in cultured water after inoculation of bacterial strains in different time
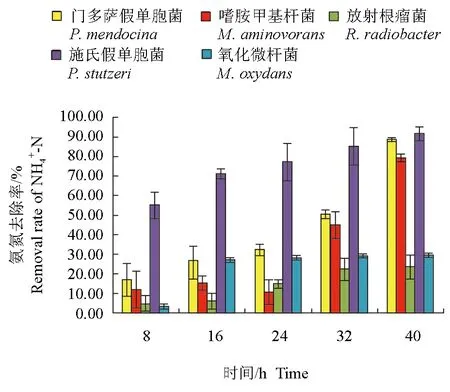
图2 不同时间各菌株对养殖水体中氨氮的去除率Fig.2 The NH4+-N removal rates of each strain in culture water in different time
分离纯化的5株细菌对亚硝态氮均有一定的去除作用(图3、图4)。培养开始时,养殖水体的亚硝态氮含量约为0.15 mg/L,培养8 h后,接种嗜胺甲基杆菌的自然水体中亚硝态氮含量最低,为0.051 mg/L,嗜胺甲基杆菌对亚硝态氮的去除率达84.90%,显著高于其他菌株(P<0.05)。试验结束时,接种的门多萨假单胞菌、嗜胺甲基杆菌和施氏假单胞菌养殖水体中亚硝态氮含量均显著低于其他菌种,分别为0.007、0.022 mg/L和0.004 mg/L,3株细菌对亚硝态氮的去除率分别达95.08%、95.02%和97.39%,显著高于其他菌株(P<0.05)。
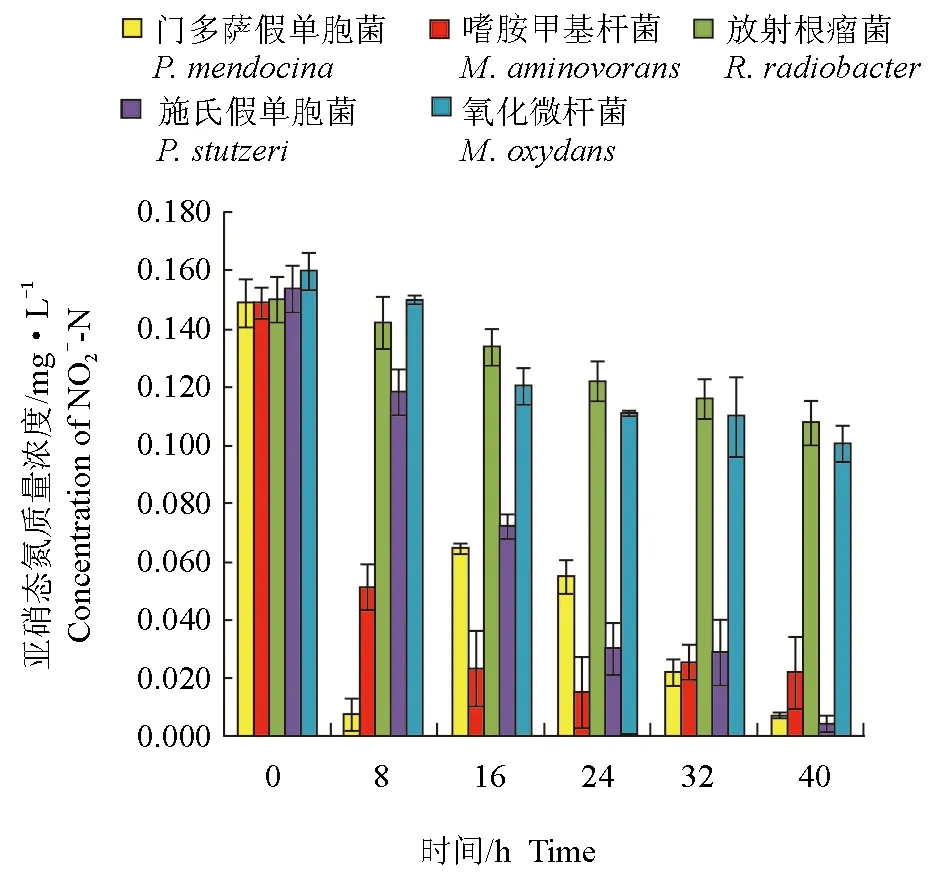
图3 接入菌株后不同时间养殖水体亚硝态氮含量变化Fig.3 The content of NO2--N after inoculated strains in culture water in different times
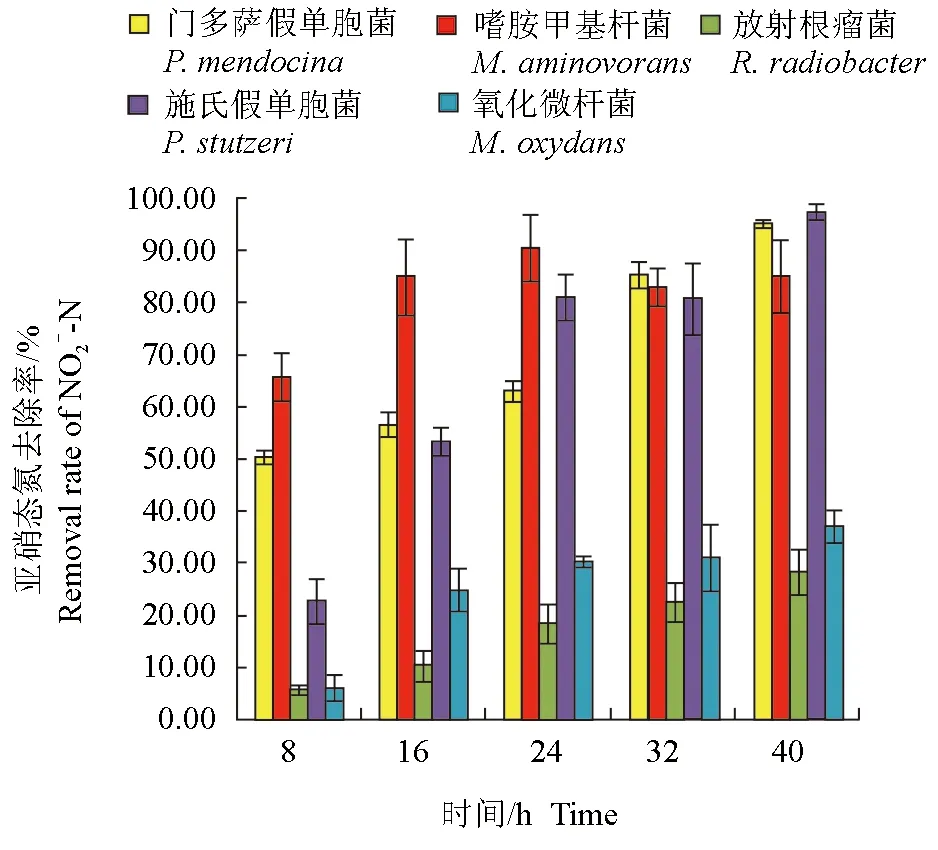
图4 不同时间各菌株对养殖水体中亚硝态氮的去除率Fig.4 The NO2--N removal rates of each strain in culture water in different times
养殖水体的硝态氮含量为0.30 mg/L,培养8 h后,接种门多萨假单胞菌的养殖水体中硝态氮含量最低,为0.1506 mg/L,门多萨假单胞菌对硝态氮的去除率达51.03%,显著高于其他菌株(P<0.05)。培养16 h后,接种放射根瘤菌的自然水体中硝态氮含量最高,为0.2790 mg/L,对硝态氮的去除率仅为8.88%,显著低于其他菌株(P<0.05)。试验结束时,接种门多萨假单胞菌和施氏假单胞菌的自然水体中硝态氮含量显著低于其他菌种(P<0.05),分别为0.0283 mg/L和0.0274 mg/L,两株细菌对氨氮的去除率分别为90.49%和91.22%,显著高于其他菌株(P<0.05)(图5、图6)。

图5 接入菌株后不同时间养殖水体硝态氮含量变化Fig.5 The content of NO3--N after inoculated strains in culture water in different times
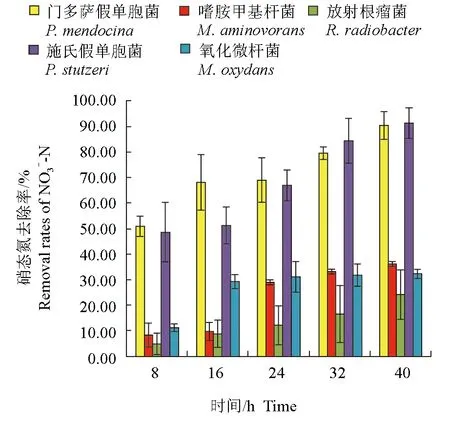
图6 不同时间各菌种对水样中硝态氮的去除率Fig.6 The NO3--N removal rates of each strain in culture water in different time
3 讨 论
3.1 假单胞菌对水质的净化作用
生物脱氮指微生物在适宜条件下,将水体中的有机氮和无机氮转化为气态氮,从而排出水体的过程[5],以此为基础衍生的生物脱氮技术因其无污染、绿色安全、脱氮彻底等优点而被认为是最经济有效、可行的水体除氮方法[19]。迄今已有利用地衣芽孢杆菌(B.licheniformis)[20]、硝化细菌[21]、反硝化细菌[22]、不动杆菌(Acinetobacter)[23]、假单胞菌(Pseudomonas)[8,24]等细菌进行生物脱氮的报道,但在其产物和脱氮能力上存在差异。
本试验的门多萨假单胞菌和施氏假单胞菌均为重要脱氮细菌,也是重要的反硝化细菌[25]。传统的生物脱氮理论认为,反硝化在有氧的条件下不能进行,氧气的存在阻止了亚硝态氮和硝态氮接受电子,后有研究发现亚硝态氮、硝态氮和氧气均可作为电子受体进行反硝化作用[26],而施氏假单胞菌就能在极高的氧气条件下进行反硝化作用[27]。池塘水体和底泥是反硝化细菌存在和生长的重要场所,其种类和数量直接影响着池塘的氮循环。林娜等[28]在池塘水体和底泥中分别筛选出6株和8株好氧反硝化细菌,且以假单胞菌为主,其中一株菌Ochrobactrumsp.在2 d内的脱氮率超过80%。杨俊忠等[29]利用富集分离的方法,在鱼池中分离到假单胞菌HSN-62等22株反硝化细菌,且假单胞菌在12 h内对硝酸盐的去除率高达96%。本试验中,门多萨假单胞菌和施氏假单胞菌在16 h内对硝酸盐的去除率分别为68.15%和51.20%,显著高于其他菌株(P<0.05),而16 h对于亚硝态氮的去除率分别为53.36%和56.29%,亦显著高于其他菌株(P<0.05),但低于杨俊忠等[29]的试验结果,这可能是菌株之间的差异性所致。施氏假单胞菌可显著降低亚硝态氮和硝态氮含量,是因为它能将二者作为唯一氮源进行脱氮,尤其是亚硝态氮的存在可以显著促进施氏假单胞菌的nirS和nosZ基因表达,而这两个基因是控制假单胞菌亚硝态氮还原酶以及一氧化二氮还原酶的重要基因[26]。
3.2 分离的其他菌株在水质净化中的作用
氧化微杆菌为嗜碱性微生物,可在pH 5~12内生长[30],常用于降解污染物[31]和生物脱硫[32]等。王亚南等[33]在海水养虾场底泥中分离出微杆菌属细菌,本试验也分离出一株氧化微杆菌,表明这类细菌能够在养虾池底泥中分布。对虾投放的饵料成分中含有有机硫化合物和硫酸盐,残饵及生物排泄物等沉积在池塘底部,造成硫化物的积累,氧化微杆菌可以利用硫化物代谢产生H2S,但对氮素利用率却较低,这类细菌虽然在养殖池塘菌群中所占比例较少,但具有较强的适应性和稳定性。此外,本试验分离出1株放射根瘤菌,属于根瘤菌属种类,是生活在土壤中的革兰氏阴性菌,具有生物固氮作用[34],对盐渍[35]、重金属[36]、多氯联苯和多环芳烃[37]等污染土壤有修复作用,但对氮素的清除作用较小。嗜胺甲基杆菌通常分离于污泥、河水中,它可以实现工业化处理甲醇或重污染废水,使废水达到排放指标[38]。马立周等[39]在甲醇污染的土壤中分离纯化到该细菌,并对其培养条件进行初步优化。本研究首次在养殖池塘中分离出该菌株。
在水产养殖中,以复合有益菌为代表的微生态制剂是从天然环境中筛选分离出的菌种,经过培养后制成的活菌菌剂。本试验中分离的假单胞菌、氧化微杆菌是常用的微生态制剂种类。从微生态平衡看,有益微生物和病原菌之间存在对营养、能量和空间的争夺,可在一定程度上抑制病原菌;有益菌可通过自身分泌的代谢物质调整微生态平衡;同时还具有改善水质、提高机体免疫力的作用。相对其他抗病途径而言,微生态制剂因具有绿色、环保、安全等特点,仍是抗生素最有潜力的替代品,但由于一些菌体稳定性差、活性难维持、对突发病作用甚微、使用技术较难掌握等弱点,微生态制剂组成菌株和组合方式仍需进一步研究。
通过对凡纳滨对虾养殖池塘水质和底泥中细菌进行分离纯化后得到5株菌,分别为门多萨假单胞菌、嗜胺甲基杆菌、放射根瘤菌、施氏假单胞菌和氧化微杆菌。门多萨假单胞菌和施氏假单胞菌对氨氮的去除率分别为88.83%和91.73%;对亚硝态氮的去除率分别为95.08%和97.39%;对硝态氮的去除率分别为90.49%和91.22%,表现出较好的去除效果,在净化养殖水体水质中有显著效果,可作为潜在的益生菌株进一步考察应用。
