准东煤灰提取氧化铝和白炭黑技术研究
2020-03-19杨海瑞刘汉辉孙健伟
王 敏,王 辉,杨海瑞,刘汉辉,孙健伟
(1. 哈尔滨工业大学 能源科学与工程学院,黑龙江 哈尔滨 150001;2. 清华大学 能源与动力工程系,北京 100084)
0 引 言
目前煤炭仍是我国主体能源,煤粉经高温燃烧后产生大量煤灰,若不正确处理会给生态环境带来很大压力。从煤灰中提取氧化铝和白炭黑能实现固废再利用,缓解铝、硅资源紧缺及环境污染问题。从煤灰中提取氧化铝的方法主要有酸浸法、烧结法以及其他特殊方法。酸浸法是以硫酸或盐酸为酸浸介质,粉煤灰浸取得到可溶性铝盐,而不溶于酸的含硅化合物等以提铝渣的形式沉淀,经过滤实现硅铝分离。该方法的特点是不考虑对某种特定金属进行选择提取,最大限度使所有粉煤灰变为各种产品(针对粉煤灰物相多为莫来石和硅铝玻璃体)[1]。该方法铝的提取率不足50%,Nayak等[2]用1.5 ~18 mol/L的H2SO4在150~200 ℃下直接浸取粉煤灰中氧化铝,铝提取率较低,最高只达到41.30%。为了进一步提高浸出率,可采用充分研磨、加入焙烧助剂、微波加热等预处理方法。酸浸法提铝的工艺相比烧结法等较为简单,但这种工艺对装置的耐酸碱腐蚀性要求高,酸消耗量大,工业难度高,易对环境造成威胁。烧结法可分为石灰石烧结法、硫酸铵焙烧法、碱石灰烧结法。烧结法普遍存在消耗能量大、工艺过程难以控制等缺陷。其他特殊方法很多,如Li等[3]提出混合碱水热法制备氧化铝的方法,Shemi等[4]釆用气相萃取法。郭强[5]报道了神华集团开发的循环流化床高铝粉煤灰提铝工艺——一步酸溶法,该工艺是在酸碱联合法基础上改进而来,将酸碱联合法中的碱法去除,同时酸法中加入除杂系统,其流程缩短,能耗降低。李晓光等[6]分析了不同粉煤灰提取Al2O3工艺的特点、不足及工业化发展现状,指出粉煤灰提铝工艺均存在一定不足和局限性,大多数工艺仍处于实验室阶段或商业化试运行阶段,需进一步完善。笔者认为基于硫酸铵与煤灰焙烧法的提取技术,是最简单、最经济的方法,能够实现绿色化生产。
从煤灰中提取白炭黑的方法主要有气相法、溶胶-凝胶法、沉淀法。气相法是通过粉煤灰、氟化钙和硫酸三者之间发生化学反应生成气态SiF4,再经过水解生成白炭黑[7]。气相法能制得纯度高、粒度小的白炭黑产品,生产质量很好,但生产工艺复杂,反应原料不易获得,能耗和成本较高。溶胶-凝胶法是指金属有机物或无机化合物经过溶胶-凝胶化和热处理形成氧化物或其他固体化合物[8],该方法能够制得纯度很高的白炭黑,但工艺过程要求高,条件很难控制,无法实现连续稳定生产。沉淀法的原理是用湿法或干法使得碱性物质与煤灰发生化学反应,通过调节pH值得到沉淀产品[9]。沉淀法工艺简单且生产成本低,但白炭黑产品性能如比表面积、纯度等都较为逊色,在加入表面活性剂或沉淀前预处理将会在一定程度上改善不足。班卫静等[10]采用浓碱熔出法短流程从粉煤灰中提取纯度≥98%的SiO2,通过乙醇、正庚烷和KH550对白炭黑进行改性制备出纳米级白炭黑,通过测定表面羟基个数,验证了纳米SiO2改性效果。
准东地区煤炭资源丰富,准东煤灰分低、挥发分高、着火特性和燃尽特性良好[11],是未来优质的动力煤,其燃烧后煤灰中含有较大比例的铝和硅元素。目前学者针对准东煤的研究主要集中在灰熔融特性、碱金属元素赋存及迁移规律以及准东煤积灰和结渣特性[12-15],尚无仅针对准东煤灰来制取氧化铝和白炭黑的情况,因此本文采用准东煤在高温燃烧气氛下的煤灰作为研究对象,通过优化实验室制取氧化铝、白炭黑的制备条件和工艺方案,为准东煤的梯级利用提供技术支持。
1 试 验
1.1 样品制备与分析
本文采用准东煤——将军庙,用马弗炉模拟煤粉炉静态燃烧方式制取灰样,具体步骤:① 破碎。利用破碎机将原煤破碎成小块充分粉碎。② 筛分。用磨煤机煤块进一步破碎成粉状,经过筛分选用300 μm以下煤粉。③ 制灰。参照GB/T 212—2008 《煤的工业分析方法》中慢灰制备方法,将盛有煤粉的瓷方舟放入5E-MF6000智能马弗炉,在500 ℃下保持30 min,之后以10 ℃/min升温速度缓慢升至815 ℃,并在此温度下充分灼烧1 h。④ 保存。制灰结束后,待灰样完全冷却,放入干净的密封袋保存。灰样的成分分析结果见表1。

表1 灰成分分析
高温煤灰样外观和物相分析如图1、2所示。可知高温煤灰样严重黏结并成块团状分布,严重影响氧化铝和白炭黑的提取速率,因此在试验前需对制取的灰样进行充分研磨,以增大比表面积。

图1 高温煤灰样外观

图2 高温煤灰样物相分析
1.2 工艺流程

图3 从准东煤灰中提取氧化铝和白炭黑的工艺流程
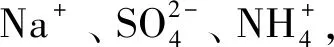
2 硫酸铵焙烧法提取氧化铝
2.1 准东煤灰与硫酸铵焙烧提铝最佳试验条件
在不同的焙烧温度、焙烧时间、焙烧配料比3个变量下分别进行试验,得出最佳试验条件。
2.1.1焙烧温度的影响
准确称取相同质量m的5组准东煤灰,按准东煤灰质量m与硫酸铵质量m′比值为1∶6在研钵中充分混合,于马弗炉中分别在400、450、500、550、600 ℃焙烧1 h。在此过程中只衡量焙烧温度对提取铝的影响,因此仅用去离子水浸泡焙烧熟料并静置后过滤,测定并计算得到不同焙烧温度下的提铝率,每组试验测试3次求平均值。提铝率随焙烧温度的大小变化如图4(a)所示。400~600 ℃,随温度升高,提铝率增大;由于浸出铝过程中未使用酸溶液,所以整体提铝率比较低,最大为50%左右。试验确定600 ℃为最佳反应焙烧温度。
2.1.2焙烧时间的影响
准确称取相同质量m的5组准东煤灰,按准东煤灰质量m与硫酸铵质量m′比值为1∶6在研钵中充分混合,在马弗炉中600 ℃下分别焙烧20、40 、60、80、100 min。用去离子水浸没焙烧熟料并静置后过滤,每组试验样品测试3次求平均值,结果如图4(b)所示。20~60 min内,随焙烧时间延长,反应程度加深,提铝率增大,焙烧时间60 min时达到最大;之后随时间延长提铝率下降,这是由于准东煤灰长时间焙烧发生煤灰烧结,铝元素很难浸出;若在浸出前充分研磨焙烧后的熟料,发现提铝率将维持在50%左右。因此确定60 min为最佳焙烧时间。
2.1.3焙烧配料比的影响
为研究配料比对提铝率的影响,选取硫酸铵质量m′与准东煤灰质量m比值为2、4、6、8、10五组配比进行试验。用去离子水浸泡焙烧熟料并静置后过滤,每组不同焙烧配料比下试验样品测试3次并求平均值,结果如图4(c)所示。m′∶m=6时提铝率最高;m′∶m=10时,焙烧熟料硬度、黏度很大,从坩埚中清理熟料难度加大,不利于试验顺利进行。因此通过不同配料比的焙烧试验,确定m∶m′=1∶6时为最佳焙烧配料比。

图4 准东煤灰与硫酸铵焙烧提铝的最佳试验条件
焙烧过程试验工况见表2,可知工况13为准东煤灰与硫酸铵焙烧过程提铝的最佳试验条件。
2.2 焙烧熟料酸浸提铝最佳试验条件
只使用去离子水不加酸浸泡提取的情况下,提铝率最大只有50%左右。改变pH值或许能增大提铝率,既要保证铝离子不发生沉淀而流失,又要尽量减少酸或碱的使用,因此使用加酸方式且溶液pH值控制在3左右。试验从酸浸温度、酸浸时间、酸浸H2SO4浓度以及酸浸液固比4个方面研究焙烧熟料酸浸提铝的最佳试验条件。
2.2.1酸浸温度的影响
考虑到此工艺实际生产中温度下限为常温,且对溶液加热不宜使之沸腾以保证生产安全,因此取焙烧温度600 ℃,焙烧时间60 min,焙烧配料比1∶6的焙烧熟料0.1 g于烧杯中,加入10 mL浓度为0.02 mol/L的H2SO4溶液,利用磁力加热搅拌器充分搅拌10 min,同时在20、40、60、80、100 ℃下水浴加热。每组试验测试3次并求平均值,结果如图5(a)所示。20~60 ℃,随温度升高提铝率不断增大,说明提高温度有利于反应进行;60~100 ℃,虽然提铝率提高但增大速率变缓,说明60 ℃左右酸浸温度对提铝率的影响基本达到极限,之后升高温度,溶液蒸发量增大,导致酸度增大等其他非温度因素的影响也会导致提铝率的变化;同时发现20 ℃时相比于同条件下不加酸时提铝率较低,这是因为铝含量的测定需在pH=4.3时进行,加酸虽能提高铝元素浸出,但滴定过程又造成了铝元素损失,因此与实际提取率有误差;通过升高酸浸温度使水解平衡增大,因测定浸出铝元素含量造成的损失就会减小。因此试验确定60 ℃为最佳酸浸温度。

表2 焙烧过程工况
2.2.2酸浸时间的影响
取焙烧温度600 ℃,焙烧时间60 min,焙烧配料比1∶6的焙烧熟料0.1 g于烧杯中,加入10 mL浓度为0.02 mol/L的H2SO4溶液,利用磁力加热搅拌器分别充分搅拌5、10、15、20、25 min,同时在60 ℃水浴加热。每组不同酸浸时间下试验测试3次并求平均值,,结果如图5(b)所示。5~20 min,随时间延长提铝率增加,20 min时达到稳定状态。因此试验确定20 min为最佳酸浸时间。
2.2.3酸浸H2SO4浓度的影响
取焙烧温度600 ℃,焙烧时间60 min,焙烧配料比1∶6的焙烧熟料0.1 g于烧杯中,加入10 mL H2SO4溶液,浓度分别为0.2、0.4、0.6、0.8、1.0 mol/L,利用磁力加热搅拌器充分搅拌20 min,同时在60 ℃下水浴加热。每组测试3次并求平均值,结果如图5(c)所示。H2SO4浓度小于0.2 mol/L时,提铝率随浓度的增大而增大;大于0.2 mol/L时提铝率增大速度减缓,基本趋于稳定。因此试验确定0.2 mol/L为最佳酸浸浓度。

图5 焙烧熟料酸浸提铝的最佳试验条件
2.2.4酸浸液固比的影响
液固比也会影响铝离子的提取效果,若液固比过小则固体不能完全浸没在液体中,提铝效果变差。取焙烧温度600 ℃,焙烧时间60 min,焙烧配料比1∶6的焙烧熟料于烧杯中,分别按浓度为0.2 mol/L H2SO4溶液质量与焙烧熟料质量比值为10、30、50、70、90混合,用磁力加热搅拌器充分搅拌20 min,同时在60 ℃下水浴加热。每组试验测试3次并求平均值,结果如图5(d)所示。液固质量比为50时提铝率达到最大值。因此试验确定酸浸液固比为50时为最佳酸浸液固比。
酸浸过程试验工况见表3。可知工况33为焙烧熟料酸浸提铝的最佳试验条件。

表3 酸浸过程工况
2.3 含铝滤液除铁及检验
焙烧熟料在最佳酸浸条件下酸浸后恒温水浴锅中保温静置30 min,保温温度为60 ℃,静置后得到明显分层的溶液与下层粗渣,抽滤得到的滤渣用于进一步提取硅元素制取白炭黑,滤液用于进一步制备氧化铝。
滤液中除Al3+含有较多的Fe3+、Ca2+金属离子,为避免杂质离子影响氧化铝纯度,需要先对滤液进行除杂。试验采取调节滤液pH值沉淀杂质金属离子的方法进行除杂。由文献[16]得:Fe3+转化为Fe(OH)3的pH=1.47~2.80,Al3+转化为Al(OH)3的pH=4.20~5.37,Ca2+转化为Ca(OH)2的pH>12。用1+1氨水调节滤液pH值至4,以保证滤液中Fe3+完全转化为Fe(OH)3沉淀而Al3+不受影响,同时Ca2+不会转化为沉淀继续存留在滤液中;充分搅拌并静置后直至滤液底层沉积橙黄色沉淀(图6(a)),抽滤将Fe(OH)3沉淀过滤。为检验经调pH值及抽滤后Fe3+的除杂率ρ(Fe3+),用磺基水杨酸法[17]检测除杂后滤液中Fe3+含量。除杂率计算公式为
(1)
式中,C(Fe3+)为溶液中原有Fe3+含量;C′(Fe3+)为溶液经除杂过滤后Fe3+含量。
经检验,在待检滤液中加入磺基水杨酸溶液后滤液没有变为深紫红色(图6(b)),可认为ρ(Fe3+)=100%。因此通过调节滤液pH使Fe3+完全转化为Fe(OH)3沉淀来除杂的方法可行且效率高。

图6 含铝滤液除铁及检验
2.4 含铝滤液除钙及检验
向除Fe3+滤液中加入过量NaOH,使滤液中的Ca2+完全转化为Ca(OH)2沉淀,而Al3+因与过量NaOH反应生成NaAlO2继续存留在滤液中。通过抽滤将Ca(OH)2沉淀除去,用EDTA法[18]对Ca2+含量进行检验,滤液中Ca2+的除杂率为ρ(Ca2+)。除杂率计算公式为
(2)
式中,C(Ca2+)为溶液中原有Ca2+含量;C′(Ca2+)为溶液经除杂过滤后Ca2+含量。
经检验,滤液中加入钙黄绿素酚酞混合指示剂后未出现黄绿素,而是直接为红色(图7),说明滤液中没有Ca2+,可认为ρ(Ca2+)=100%。

图7 钙黄绿素酚酞混合指示剂法除杂Ca2+的检验
2.5 氧化铝的制备
向除去Fe3+、Ca2+的滤液中通入过量CO2,溶液中生成Al(OH)3沉淀。过滤后获得的Al(OH)3沉淀经煅烧后可转变为不同形态的Al2O3(图8)。Al(OH)3在140~150 ℃的低温环境下脱水可制得γ-Al2O3。γ-Al2O3不溶于水,能溶于强酸或强碱溶液,将其高温加热至1 200 ℃就全部转化为α-Al2O3。


图8 制备所得氧化铝样品
3 准东煤灰中提取白炭黑研究
3.1 提铝渣分析
3.1.1提铝渣的外观及微观物相表征
准东煤灰与硫酸铵在最佳焙烧试验条件下的焙烧熟料呈现橙褐色(图9(a));焙烧熟料经过最佳酸浸试验条件下提取铝元素后的提铝渣呈红褐色(图9(b))。两者颜色存在差异是因为除去铝元素的提铝渣中铁元素含量占比上升,所以颜色加深;焙烧熟料中因含有呈现白色的氧化铝,因此颜色偏淡。

图9 焙烧熟料与提铝渣外观形貌

图10 准东煤灰与提铝渣外观形貌
3.1.2提铝渣成分及含量表征
采用X射线衍射仪对工况13和工况33下的最佳试验条件获得的提铝渣进行XRD表征分析,结果如图11所示。可知提铝渣中大部分为Ca和Si的化合物,含有少量Na、Mg、Al等元素的化合物。提铝渣中含有大量CaSO4,是因为在准东煤灰提铝过程中通过化学反应、pH调节等产生的CaSO4微溶于水,易沉淀而存留在提铝渣中。

图11 提铝渣的XRD分析
通过K值法(RIR法)分析得到提铝渣中的硅含量。基本原理为按照1∶1混合的提铝渣与刚玉(Al2O3)的最强衍射峰的积分强度比值为RIR值。通过将该样品混合物的积分强度/RIR值,可换算成Al2O3的积分强度。对于样品混合物而言,物质中所有组分都可按RIR法进行换算,最后通过归一法得到某一特定组分的质量分数。
样品混合物中的物质组分含量计算方法[19]为
(3)


(4)

(5)

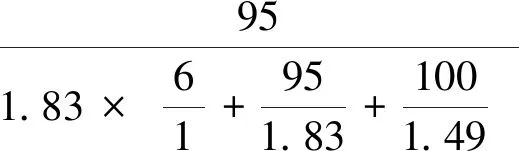
(6)
式中,WA为提铝渣与刚玉(Al2O3)组成的样品混合物中Al2O3含量;WS为样品混合物中SiO2含量;WC为样品混合物中CaSO4含量。

(7)

(8)
RIR法得出的样品中实际SiO2和CaSO4含量存在一定误差,但试验在确定物相组成时控制误差在5%内,因此计算方法及数据具有一定的说服力。对比准东煤灰与提铝渣中的Si元素和Ca元素比值,发现后者的Si∶Ca变小,说明在提铝过程中存在Si元素损失。Si元素损失率σ为
(9)
其中,mash为准东煤灰质量,g;θash为准东煤灰中Si元素含量,%;mslag为提铝渣质量,g;θslag为提铝渣Si元素含量,%。经计算,σ=7.640%。
3.2 碱浸提取二氧化硅的最佳试验条件
3.2.1碱浸温度的影响
取0.1 g提铝渣于烧杯中,加入10 mL 1 mol/L的NaOH溶液,在磁力搅拌器中充分搅拌10 min,加热温度分别为20、40、60、80、100 ℃。每组试验测试3次并求平均值,计算SiO2提取率,结果如图12(a)所示。随温度升高SiO2提取率增加;20~60 ℃,SiO2提取率增长速度较快;60~100 ℃,SiO2提取率增长速度缓慢且逐渐稳定。考虑到节约能量及其他因素的影响,试验确定60 ℃为最佳碱浸温度。

图12 碱浸提取二氧化硅的最佳试验条件
3.2.2碱浸时间的影响
取0.1 g提铝渣于烧杯中,加入10 mL 1 mol/L的NaOH溶液后在磁力搅拌器中分别充分搅拌10、30、60、90、120 min,加热温度为60 ℃。每组试验测试3次并求平均值,不同碱浸温度下SiO2提取率如图12(b)所示。随碱浸时间的延长,反应越充分;30 min前SiO2提取率保持较大的增大速率,30 min后SiO2提取率增长速度变缓且逐渐稳定。试验确定30 min为最佳碱浸时间。
3.2.3NaOH浓度的影响
经计算,与0.1 g提铝渣的硅元素反应完全的10 mL NaOH溶液最小浓度为0.4 mol/L。取0.1 g提铝渣,分别加入10 mL浓度为0.4、1.0、3.0、5.0、7.0 mol/L NaOH溶液后在磁力搅拌器中充分搅拌30 min,加热温度为60 ℃,每组试验测试3次并求平均值,结果如图12(c)所示。可知随NaOH浓度增加,SiO2提取率增加;0.4~3.0 mol/L时SiO2提取率增长明显,3~7 mol/L时SiO2提取率变化不大,说明在3 mol/L时反应物已充分反应。试验确定碱浸NaOH的浓度最佳为3 mol/L。
3.2.4碱浸液固比的影响
取0.1 g提铝渣于烧杯中,分别加入不同液固比为10、30、50、70、90的3 mol/L NaOH溶液后在磁力搅拌器中充分搅拌30 min,加热温度为60 ℃。不同碱浸温度下SiO2提取率如图12(d)所示。随着液固比的增加,SiO2提取率增加;液固比为10~70时,SiO2提取率增长速率较大;液固比为70~90时,SiO2提取率变化不大且稳定,说明在液固比为70时反应物已充分反应。因此,试验确定最佳碱浸液固比为70。
提铝渣碱浸过程工况见表4。可知工况54为提铝渣碱浸过程提取二氧化硅的最佳试验条件。
3.3 碳分法制备白炭黑的最佳试验条件
由Na2SO3溶液制得SiO2,一般采用先制得H2SiO3后,H2SiO3失水获得SiO2。H2SiO3不溶于水,但不同反应条件不一定生成H2SiO3沉淀,有可能生成H2SiO3胶体。为更清楚地研究CO2沉淀的产生条件,以纯Na2SiO3、CO2气体作为试验原料,通过控制反应溶液pH、反应温度、CO2通气速率、Na2SiO3溶液浓度等作为参照,对实际碱浸提铝渣获得的浸出液进行对比,适当调整试验条件使得H2SiO3沉淀量最大,此时试验条件即制备白炭黑的最佳试验条件。

表4 提铝渣碱浸过程工况
查阅文献[20],Na2SiO3与CO2反应直接生成H2SiO3沉淀的试验条件为:pH=9.3~11,反应温度80 ℃,CO2通气速率20~30 mL/min,Na2SiO3浓度70 g/L,同时增强搅拌可加快H2SiO3沉淀形成。
3.3.1多次碳分法制备白炭黑的工艺流程
按照H2SiO3沉淀形成试验条件,向通过碱浸过程形成的Na2SiO3溶液中通入CO2进行一次碳分时会初步形成一次碳分沉淀和一次碳分滤液。在H2SiO3沉淀形成时会卷携其他离子(主要为Ca2+、Mg2+、Al3+)或沉淀(主要为CaCO3、MgCO3)杂质;为获得更高纯度的白炭黑,将一次碳分沉淀中加入一定浓度的NaOH溶液中,H2SiO3与NaOH反应而其他成分(CaCO3、MgCO3)不反应,通过过滤将杂质沉淀去除。通入CO2进行二次碳分形成二次碳分沉淀和二次碳分滤液;再将二次碳分沉淀加入一定浓度的NaOH溶液中,过滤杂质后进行三次碳分;依次进行碳分工序,直至沉淀所产生的H2SiO3沉淀纯度满足要求。多次碳分法制备白炭黑的工艺流程如图13所示。
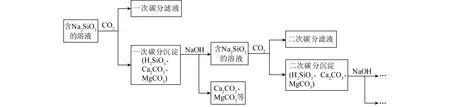
图13 多次碳分法制备白炭黑的工艺流程
3.3.2碳分pH对H2SiO3沉淀率的影响
在未通入CO2时溶液pH=11,随着CO2通入溶液pH减小。每组试验测试3次并求平均值,结果如图14(a)所示。碳分反应从pH=11开始,至pH=9.3左右结束;随着pH值的降低,H2SiO3沉淀率增大,pH=9.5时达到基本稳定状态。因此控制通入CO2量至溶液pH=9.5时获得最大H2SiO3沉淀率。

图14 多次碳分法制备白炭黑的最佳试验条件
3.3.3CO2通气速率对H2SiO3沉淀率的影响
CO2通气速率为20、22、24、26、28、30 mL/min。每组不同试验测试3次并求平均值,结果如图14(b)所示。CO2通气速率在20~24 mL/min时,随着通气速率的增大,H2SiO3沉淀率增大;从26 mL/min开始,H2SiO3沉淀率逐渐下降,这是由于H2SiO3沉淀正在逐步转变为H2SiO3胶体,H2SiO3沉淀量减少。因此试验确定最佳CO2通气速率为24 mL/min。
3.3.4碳分NaOH浓度对H2SiO3沉淀率的影响
每次取一次碳分后沉淀0.1 g,加入浓度分别为0.1、0.2、0.3、0.4、0.5 mol/L的10 mL NaOH溶液,充分搅拌待一次碳分沉淀完全溶解于溶液中,将CO2按24 mL/min的通气速率逐渐通入溶液中直至溶液pH=9.5时停止。每组不同浓度下试验测试3次并求平均值,结果如图14(c)所示。碳分NaOH浓度在0.2 ~0.5 mol/L时,H2SiO3的沉淀率基本稳定且沉淀率在90%以上;碳分NaOH浓度在0.1 mol/L时,H2SiO3的沉淀率基本为0,此时一次碳分后的沉淀在NaOH溶液中充分溶解后形成Na2SiO3胶体而不产生沉淀。为节约生产成本,试验确定碳分NaOH浓度在0.2 mol/L时为最佳碳分NaOH浓度。
3.3.5碳分液固比对H2SiO3沉淀率的影响
每次取一次碳分后沉淀0.1 g,分别加入液固比为60、70、80、90、100的0.2 mol/L NaOH溶液,充分搅拌并将CO2以24 mL/min速率通入溶液中直至溶液pH=9.5时停止。每组不同试验测试3次并求平均值,结果如图14(d)所示。碳分液固比为80~100时,H2SiO3沉淀率基本稳定且效果较好;而碳分液固比为60~70时,此时溶液为H2SiO3胶体,未能产生H2SiO3沉淀,因此H2SiO3沉淀率为0。试验确定碳分液固比为80。
多次碳分过程工况见表5,可知工况74为多次碳分法制备白炭黑最佳试验条件。

表5 多次碳分过程工况
3.3.6白炭黑的制备
在最佳制备条件下获得的H2SiO3沉淀需要加热焙烧至150 ℃以上失水发生分解才能制得白炭黑(SiO2)。为提高白炭黑的纯度,可用强酸或强碱提纯。制备所得白炭黑样品如图15所示。样品呈无定型的微粒粉末或粒状,不溶于水及普通酸,溶于苛性碱及氢氟酸。

图15 制备所得白炭黑样品
4 影响因素的相关性分析
为进一步研究已确定的最佳条件对提铝率、SiO2沉淀率的影响大小,有助于按实际情况调整生产工艺条件。先对各组试验数值进行归一化处理,使数值范围统一在[0,1]变为无量纲常数。数值归一化采用min-max标准化计算方法。
(10)
式中,x为试验数据;x*为归一化后数值;xmax为样本数据最大值;xmin为样本数据最小值。
利用统计学分析软件IBM SPSS Statistics 19进行各因素与对应数值的双变量相关性分析,相关系数为Pearson,显著性检验为双侧检验。通过双变量相关性分析得出:焙烧温度>焙烧时间>焙烧配料比;酸浸时间>酸浸温度>H2SO4浓度>酸浸液固比;碱浸液固比>碱浸温度>NaOH浓度>碱浸时间;碳分pH>碳分液固比>碳分NaOH浓度>CO2通气速率。
5 生产工艺的可行性分析
本研究设计的生产流程如图16所示。
本研究的可行性在于以下3方面。① 选址方面:本工艺的生产地最好选在火电厂附近,可以将现有火电厂配套设备与本工艺的生产环节相结合,更方便快捷地利用好锅炉烟气余热进行生产,节约成本。另外因需要大量水作反应溶剂,因此选址应靠近水源。在郊区建设生产,避免生产噪音对市民的影响,还能够有充足的空间建设仓库等。② 生产工艺所用资源方面:本研究所设计的生产工艺所用资源易获得,且成本较低、对环境污染影响程度较小。其中生产流程中能够从提铝后的滤液中重新提取(NH4)2SO4,实现了生产原料的再利用,在一定程度上能够节约生产成本。经过碳分过程后获得的Na2CO3溶液可通过加入石灰苛化方式,得到CaCO3产品和NaOH,NaOH可循环利用于提取工艺生产,避免烧碱损失。③ 附加产品方面:本研究所设计的生产工艺,除能正常生产Al2O3和白炭黑外,还能生产Na2SO4等。Na2SO4在化工、玻璃、造纸、制造洗涤剂等方面具有重要作用。因此生产的附加产品能够进一步出售。经过滤后的无用滤渣主要是含铁、钙的砂质物质,可用作建筑材料。

图16 准东煤灰中提取氧化铝和白炭黑的工艺流程
6 结 论
1)焙烧过程最佳试验条件为:焙烧温度600 ℃,焙烧时间60 min,焙烧配料比1∶6。酸浸过程最佳试验条件:酸浸温度60 ℃、酸浸时间20 min、H2SO4浓度0.2 mol/L、酸浸液固比50;提取纯度较高的铝元素,需除去滤液中杂质Fe、Ca等元素,研究采用pH调节法进行除杂,且效果较好。碱浸过程最佳试验条件为碱浸温度60 ℃、碱浸时间30 min、碱浸NaOH浓度3 mol/L、碱浸液固比70,在最佳试验下的SiO2提取率为99%。采用多次碳分法提硅能够满足不同硅含量纯度要求,最佳碳分工艺条件为碳分pH=9.5、CO2通气速率24 mL/min、碳分NaOH浓度0.2 mol/L、碳分液固比80。
2)经相关性分析,各因素对提铝率、SiO2提取率及H2SiO3沉淀率影响程度大小分别为:焙烧温度>焙烧时间>焙烧配料比,酸浸时间>酸浸温度>H2SO4浓度>酸浸液固比,碱浸液固比>碱浸温度>NaOH浓度>碱浸时间,碳分pH>碳分液固比>碳分NaOH浓度>CO2通气速率。
3)本文设计的工艺能够实现准东煤灰的绿色化综合利用且具有生产可行性。能够从提铝后的滤液中重新提取(NH4)2SO4,实现了生产原料的再利用,节约生产成本。经过碳分过程后获得的Na2CO3溶液可通过加入石灰苛化的方式,得到CaCO3产品和NaOH,NaOH可循环利用于提取工艺生产,避免烧碱损失。除能正常生产氧化铝和白炭黑外,还能获得Na2SO4等附加产品。
