盐酸氟西汀胶囊仿制药与原研药的溶出度一致性评价
2020-03-19郭燕燕丁云晖张婷金拓
郭燕燕 丁云晖 张婷 金拓
1上海交通大学药学院 (上海 200240)
2上海上药中西制药有限公司 (上海 201806)
盐酸氟西汀是全球第一个上市的选择性5-羟色胺再摄取抑制剂(SSRIs)的抗抑郁药物[1],由美国礼来公司率先研制成功,1986年底在比利时首次上市用于抑郁症的治疗,商品名为Prozac;1987年获得美国食品药品监督管理局(FDA)批准,于1988年1月进入美国市场,后于1995年4月进入中国市场。盐酸氟西汀适应症主要为抑郁症、强迫症和神经性贪食症。2016年3月,国家正式开启了仿制药质量与疗效的一致性评价工作[2];溶出度不仅是药物质量控制的体外指标,更是评价药物在体内释放和吸收的有效手段。对于仿制药来说,与原研药比较在pH为1.0~7.0范围内的溶出行为,若均一致,则体内生物不等效的概率是极低的[3]。文献资料表明,关于盐酸氟西汀胶囊溶出曲线的测定和溶出曲线方法研究的文献很少,因此,参照《中华人民共和国药典》(2015年版),建立盐酸氟西汀胶囊溶出曲线测定方法,考察在4中不同介质中的溶出行为,并与原研药进行对比,为盐酸氟西汀胶囊仿制药的一致性评价工作提供参考。
1 材料与方法
1.1 仪器与试药
SOTAX溶出试验仪、1260系列高效液相色谱仪、紫外检测器、1200型二极管阵列检测器(DAD)和色谱工作站,美国安捷伦科技公司;AL104电子天平、SevenEasy S20精密pH计,梅特勒-托利多公司。
盐酸氟西汀工作用对照品(自制,批号为GB02-014,w=99.58%);盐酸氟西汀胶囊原研药 (法国Patheon France生产,批号为 4525A,5545A);盐酸氟西汀胶囊 (自制, 批号为 T160552,T160553,T160554)。
甲醇(色谱纯),赛默飞世尔科技(中国)有限公司;磷酸(分析纯)、三乙胺(色谱纯)、四氢呋喃(色谱纯),国药集团化学试剂有限公司;纯化水,自制。
1.2 方法
1.2.1 色谱条件
色谱柱:Agilent Zorbax Eclipse Plus C8(4.6 mm×250 mm,5 μm)或效能相当的色谱柱,辛烷基硅烷键合硅胶为填充剂;流动相:三乙胺缓冲溶液(取三乙胺10 mL,加980 mL水,摇匀,用磷酸调节pH至6.0,用水稀释至1000 mL)-甲醇-四氢呋喃(体积比为 62∶8∶30);紫外检测波长:227 nm;进样量:10 μL。
1.2.2 溶液配制
1.2.2.1 对照品溶液
取盐酸氟西汀对照品适量,精密称定,分别用相应的溶出介质溶解并定量稀释,制成每1 mL中约含44滋g盐酸氟西汀的溶液,作为对照品溶液。
1.2.2.2 供试品溶液
取样品每批12粒、溶出介质500 mL,按溶出度与释放度测定法[2015年版《中华人民共和国药典》0931通则第二法(桨法)]进行溶出度试验,转速为50 r/min,温度为 37.0℃,分别于 10,15,20 及 30 min时,取溶出液10 mL过滤(及时补充相同温度、相同体积的溶出介质),取续滤液作为供试品溶液。
1.2.3 溶出介质的选择
盐酸氟西汀胶囊已被收入美国药典(USP)标准和《中华人民共和国药典标准》(2015 年版)[4],标准中溶出度测定方法均为桨法,转速为50 r/min,溶出介质为900 mL水;区别在于两国标准规定的限度不同,USP标准限度为30 min溶出不低于80%,中国药典标准为15 min溶出不低于80%。参考已有标准和相关文献[5],拟采用桨法和溶出介质体积500 mL进行溶出度试验。
盐酸氟西汀为高溶解性、高渗透性药物,属于生物药剂学分类系统(BCS)Ⅰ类,其解离常数(pKa)为9.62。 根据相关文献报道[5],选定溶出介质为水、0.1 mol/L盐酸溶液、醋酸盐缓冲液(pH=4.5)和磷酸盐缓冲液(pH=6.8)。 在(37.0±0.5)℃下,用以上 4 种介质作为溶剂,制备盐酸氟西汀饱和溶液,经高效液相色谱(HPLC)法测得准确质量浓度,计算盐酸氟西汀在4种介质中的溶解度,进而考察是否达到漏槽条件,结果见表1。
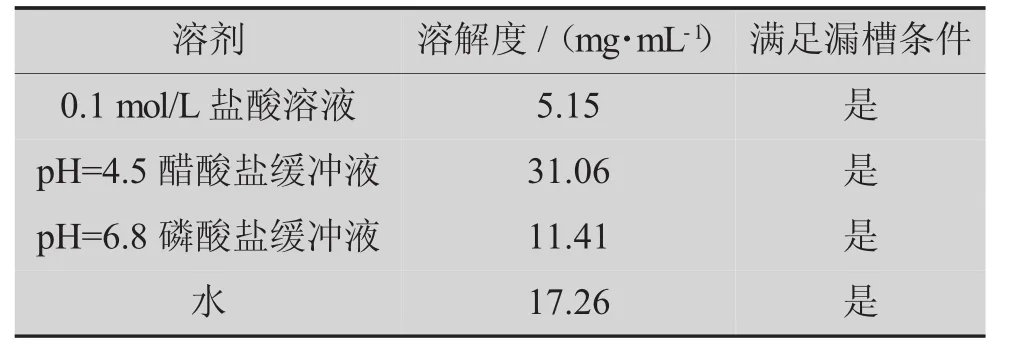
表1 盐酸氟西汀饱和溶解度
取样品原研药(批号:4525A)适量,分别采用上述4种溶出介质,依法测定,计算各时间点的累积溶出度并绘制溶出曲线,详见图1。
表1和图1表明,原研药在溶出介质水、0.1 mol/L盐酸溶液、醋酸盐缓冲液(pH=4.5)和磷酸盐缓冲液(pH=6.8)中具有较好的溶解性,均达到漏槽条件。因此,4种介质可以直接作为仿制药与原研药进行溶出比较的溶出介质。
1.2.4 转速的选择

图1 原研药在不同溶出介质中的溶出曲线
采用桨法,对75 r/min和50 r/min进行对比,在选定的水中测定溶出度,绘制溶出曲线,结果见图2。图2显示,采用75与50 r/min进行溶解的溶出曲线无明显差异,说明低转速即可达到分析要求,且药典标准为50 r/min,因此,选择低转速50 r/min即可。

图2 原研药在不同转速下的溶出曲线
2 结果与讨论
2.1 方法学考察
2.1.1 线性关系考察
精密称定盐酸氟西汀原料(批号:151001)适量,分别用水、0.1 mol/L盐酸溶液、pH=4.5的醋酸盐缓冲液、pH=6.8的磷酸盐缓冲液溶解并定量稀释制成一系列质量浓度的溶液,照“1.2.1”项下色谱条件,精密量取上述溶液各10 mL,分别注入液相色谱仪,记录色谱图。以质量浓度为横坐标,峰面积为纵坐标,进行线性回归。结果表明,在9.04~63.28滋g/mL范围内,盐酸氟西汀质量浓度与峰面积线性关系良好。具体回归方程与线性范围见表2。

表2 回归方程与线性范围
2.1.2 重复性试验
取自制样品(批号:T160554)适量,按“1.2.2”项下方法制备供试品溶液,同法操作6份。同法制备盐酸氟西汀对照品溶液。精密量取上述溶液各10 μL,分别注入液相色谱仪,记录色谱图,考察重复性。检测结果表明水、0.1 mol/L盐酸溶液、pH=4.5的醋酸盐缓冲液、pH=6.8的磷酸盐缓冲液中的相对标准偏差(RSD)分别为 1.99%,2.09%,1.08%和 1.93%,表明本方法重复性良好。
2.1.3 稳定性试验
取上述饱和供试品溶液,分别于室温下放置0,2,4,6,8,10,12,14,16,18,20,22,24 h 后测定盐酸氟西汀含量,考察溶液的稳定性。结果显示,水、0.1 mol/L盐酸溶液、pH=4.5醋酸盐缓冲液、pH=6.8磷酸盐缓冲液等4种溶出介质中的RSD分别为0.14%、0.11%、0.12%和0.07%,表明供试品溶液在4种溶出介质中室温下24 h稳定。
2.1.4 回收率试验
精密称取盐酸氟西汀原料(批号:151001)适量,各置于100 mL容量瓶中,加入空白辅料溶液,分别按盐酸氟西汀胶囊标示量 (以氟西汀计20 mg)的80%,100%,120%,加水、0.1 mol/L 盐酸溶液、pH=4.5的醋酸盐缓冲液以及pH=6.8的磷酸盐缓冲液配制一系列不同质量浓度的供试品溶液,采用HPLC法测定盐酸氟西汀的含量,并计算其回收率,结果如表3所示。

表3 回收率实验结果
2.2 溶出曲线绘制
取 3批样品 (批号分别为 T160552,T160553,T160554)和 1批原研药(批号:55445A)各 12 片,取“1.2”项下4种溶出介质适量,分别按“1.2.2”项下方法制备供试品溶液;取出上述供试品溶液和“1.2.2.1”所述对照品溶液各适量,采用HPLC法测定并计算各时间点的累积溶出度,绘制溶出曲线,如图3所示。
2.3 溶出曲线相似性评价
按照 《普通口服固体制剂溶出曲线测定与比较指导原则》,比较自制样品与原研药的溶出曲线相似性。因为自制样品与原研药在15 min内的平均溶出度均不低于85%,所以可认为自制样品与原研药在4种溶出介质中的溶出行为相似。
3 结论
经过溶出介质选择、转速选择等方法的建立以及验证,结果表明文中所述HPLC法适用于盐酸氟西汀胶囊的溶出度测定;盐酸氟西汀胶囊仿制药与原研药的体外溶出曲线具有相似性,表明其质量一致性较好。

图3 盐酸氟西汀胶囊自制样品和原研药在4种溶出介质中的溶出曲线
