黄连素对妊娠期糖尿病大鼠胰岛素抵抗的影响及机制
2020-03-19孙田歌孟凡华杨敏赵红梅于志艳张瑞臧淑妃
孙田歌,孟凡华,杨敏,赵红梅,于志艳,张瑞,臧淑妃
复旦大学附属上海市第五人民医院,上海200240
妊娠期糖尿病(GDM)是一种慢性低度炎症性疾病。多项研究显示,GDM患者IL-6、IL-8、IL-18、TNF-α、CRP等促炎因子水平升高,炎症状态的激活导致胰岛素抵抗的发生,胰岛素抵抗是妊娠期糖尿病患者的显著特征。中性粒细胞是第一个对炎症作出反应的免疫细胞[1~3],近年研究发现,中性粒细胞可以促发机体发生慢性低度炎症状态[4, 5]。中性粒细胞分泌一种促炎性蛋白酶,称为中性粒细胞弹性蛋白酶(NE)。而丝氨酸蛋白酶抑制剂α1-抗胰蛋白酶(α1-AT)是一种NE的内源性抑制剂。研究发现,黄连素可以显著改善2型糖尿病、肥胖、多囊卵巢综合征等患者的代谢紊乱。但其在GDM中的作用少有研究。2018年5月~2019年8月,我们通过高脂喂养及间断小剂量链脲佐菌素(STZ)诱导的方法建立了GDM大鼠模型,探讨黄连素对GDM大鼠肝脏组织NE的影响及其对胰岛素抵抗的改善作用。
1 材料与方法
1.1 动物与试剂 SPF级6周龄清洁级雌性SD大鼠30只,10周龄雄性大鼠15只,体质量340~380 g,购自南京动物模式研究所,许可证号:SCXK(苏)2010-0001。STZ购自美国Sigma公司;高脂高胆固醇饲料(20%蛋白质、50%碳水化合物、21%脂肪和0.21%胆固醇)购自New Brunswick公司;黄连素购自美国Sigma公司;免疫组化一抗(抗NE兔多克隆抗体)购自英国Biorbyt公司;免疫组化二抗(山羊抗兔IgG)购自麦约尔生物公司(HSA0003);ELISA试剂盒购自美国R&D公司;TRIzol购自Ambion公司;逆转录试剂盒和SYBR Green试剂盒购自Invitrigen公司;Western一抗稀释液和二抗稀释液购自碧云天公司(P0023A)。
1.2 动物分组及GDM模型构建 30只雌性大鼠适应性饲养1周后,随机分为对照组10只、GDM组8只、黄连素干预组8只。对照组用普通饲料和普通饮用水喂养4周,GDM组和黄连素干预组用高脂饲料喂养4周。4周后,将各组大鼠按雌雄比2∶1的比例合笼交配,第2天检栓及阴道涂片检查,确定为妊娠第0天(D0)。确认妊娠大鼠后,模型组大鼠在D0时腹膜内注射20 mg/kg STZ(0.1 mmol/L柠檬酸盐缓冲液pH 4.5配制)构建GDM模型。STZ诱导72 h后检测血糖水平,连续检测3次,以血糖>16.7 mmol/L确定为GDM大鼠,并再次予以腹腔内注射10 mg/kg STZ。对照组分别在D0和D3时腹腔内注射同等容量的生理盐水。造模后继续高脂饲料喂养。
1.3 干预方法 造模后,黄连素干预组予以黄连素100 mg/kg,分3次每日灌喂,共15 d。对照组、GDM组予以相同方法使用同等容量生理盐水灌喂。
1.4 检测指标
1.4.1 血糖及胰岛素抵抗指数(IR) 分别于大鼠妊娠D0、D4、D8、D12、D16和D19时予以剪尾,使用罗氏血糖仪检测监测血糖,直至大鼠分娩。于D0、D8、D16和D19时空腹采血,采用电化学发光法(罗氏 cobas e602,瑞士)检测大鼠胰岛素水平,应用稳态模型评估法计算IR=空腹血糖×空腹胰岛素/22.5。
1.4.2 血脂、肝功能指标 各组大鼠分别于D0和D19时禁食12 h,尾静脉断尾采血,分离血清,-20 ℃保存,采用全自动生化分析仪(Sysmex XN9000,日本)测定血总胆固醇(TC)、甘油三酯(TG)、丙氨酸氨基转移酶(ALT)、谷草转氨酶(AST)。
1.4.3 体质量、胎鼠体质量及胎盘体质量 于D0和D19称取大鼠体质量。各组大鼠于D19时,水合氯醛麻醉,剖腹切除子宫两侧子宫角,从子宫中取出胎鼠、胎盘并称重。
1.4.4 肝脏组织NE蛋白表达 ①免疫组化法:由肝左叶固定部位取材,一块3 mm × 3 mm放入4%甲醛固定液中,制备肝脏石蜡切片,行免疫组化染色,用400倍显微镜观察。以胞质或胞膜染色呈棕黄色为阳性细胞。以0.01 mmol/L PBS代替一抗作为空白对照。②Western blotting法:取肝脏组织,投入液氮中。肝脏组织匀浆后,提取肝脏组织总蛋白,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、封闭、抗原抗体反应、放射自显影,检测肝脏组织NE及β-actin蛋白表达量。
1.4.5 肝脏组织NE、α1-AT水平 采用ELISA法。提取各组肝脏组织,标本匀浆上清液,按照ELISA试剂盒说明书步骤完成加样后,酶标仪在450 nm波长处测量每孔OD值,根据标准曲线计算出各样品中NE和α1-AT水平。计算NE/α1-AT比值。
1.4.6 肝脏组织促炎症因子单核细胞趋化蛋白-1(MCP-1)及TNF-α mRNA表达 采用PCR法。应用TRIzol提取各组肝脏组织标本总RNA,采用超微量核酸测定仪测定RNA浓度,选取RNA OD260/OD280比值1.8~2.0的样品,严格按照RT-PCR试剂盒和SYBR Select Master Mix试剂盒说明书进行逆转录及扩增,以β-actin作为内参基因。PCR引物序列来自Pubmed,由上海生物工程技术有限公司合成,序列如下:β-actin上游5′-CTGGCTCCTAGCACCATGAA-3′,下游5′-CGCAGCTCAGTAACAGTCCG-3′;MCP-1上游5′-TCTCTCTTCCTCCACCACCAT-3′,下游5′-GCTCTCCAGCCTACTCATTGG-3′;TNF-α上游5′-AAGGGAGAGTGGTCAGGTTG-3′,下游5′-TCTGTGAGGAAGGCTGTGC-3′。用2-ΔΔCq方法计算mRNA的相对表达量。

2 结果
2.1 各组血糖、IR变化比较 D0时,各组血糖及IR差异无统计学意义(P>0.05)。D4时,GDM组血糖高于对照组(P均<0.05),黄连素干预组血糖及IR与GDM组相比差异无统计学意义(P>0.05)。D8之后各时点,黄连素干预组血糖及IR均低于GDM组(P均<0.05)。见图1。

注:A为各组血糖变化;B为各组IR变化。与对照组比较,#P<0.05;与GDM组比较,*P<0.05。
图1 各组血糖、IR变化情况
2.2 各组体质量、血脂、肝功能指标比较 D0及D19时,GDM组和黄连素干预组大鼠体质量、TC、TG、ALT、AST均高于对照组(P均 < 0.05);而D0及D19时,黄连素干预组大鼠上述指标与GDM组大鼠比较,差异均无统计学意义(P均>0.05)。见表1。

表1 各组体质量、血脂、肝功能指标比较
注:与对照组比较,*P<0.05。
2.3 各组胎鼠体质量及胎盘质量比较 D19时,GDM组胎鼠体质量及胎盘质量均高于对照组,黄连素干预组胎鼠体质量及胎盘质量均低于GDM组(P均<0.05)。见表2。
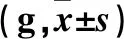
表2 各组胎鼠体质量及胎盘质量比较
注:与对照组比较,*P<0.05;与GDM组比较,△P<0.05。
2.4 各组肝脏组织NE表达比较 ①免疫组化法:对照组肝脏组织几乎没有NE显色,GDM组有较多的NE表达,黄连素干预组NE表达明显减少,见图2。②Western blotting法:分析亦显示了上述类似结果,GDM组NE表达高于对照组,黄连素干预组NE表达低于GDM组(P均<0.05),见图3。
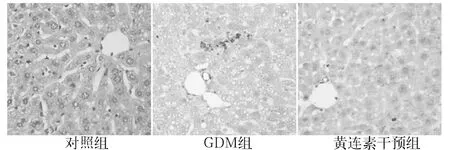
图2 各组肝脏组织NE表达情况(免疫组化法,×40)
2.5 各组肝脏组织NE、α1-AT水平及NE/α1-AT比值比较 GDM组NE水平高于对照组,α1-AT水平低于对照组,NE/α1-AT比值高于对照组(P均<0.05)。黄连素干预组NE水平低于GDM组,α1-AT水平高于GDM组,NE/α1-AT比值低于GDM组(P均< 0.05)。见图4。
注:与对照组比较,*P< 0.01;与GDM组比较,△P< 0.01。
图3各组肝脏组织NE表达情况(Western blotting法)

注:A为各组NE比较;B为各组α1-AT比较;C为各组NE/α1-AT比较。与对照组比较,*P< 0.01;与GDM组比较,△P< 0.01。
图4 各组肝脏组织NE、α1-AT水平及NE/α1-AT比值比较
2.6 各组肝脏组织MCP-1及TNF-α mRNA表达比较 GDM组MCP-1、TNF-α mRNA表达均高于对照组,黄连素干预组MCP-1、TNF-α mRNA表达均低于对照组(P均< 0.05)。见图5。

注:A为各组MCP-1比较;B为各组TNF-α mRNA表达比较。与对照组比较,*P< 0.01;与GDM组比较,△P< 0.01。
图5 各组肝脏组织MCP-1及TNF-α mRNA表达比较
3 讨论
随着人们生活水平的提高,肥胖发生率的升高,GDM的发生率也在不断的上升,妊娠期高血糖不仅会增加母儿围生期疾病危险,而且将来母儿患2型糖尿病、心血管疾病的机会明显增加。制作病理生理过程与人类相似的疾病模型对于疾病机制及治疗的研究至关重要。仅仅通过STZ诱导的动物模型通常更类似1型糖尿病,无法模拟以胰岛素抵抗为主的GDM临床特征,胎儿往往出现胎儿宫内生长受限。故本课题组首先通过高脂饲料喂养导致大鼠肥胖,形成一定的胰岛素抵抗后再予以小剂量STZ诱导,另外由于大鼠的自我修复能力较强,部分大鼠在成模后第4天出现血糖恢复的情况,我们在成模后第3天予以更小剂量STZ补充注射,使大鼠血糖维持稳定,并提高了大鼠的成模率。
胰岛素抵抗是GDM患者的显著病理生理特征。但目前针对GDM患者的治疗唯一安全有效的药物只有胰岛素,而胰岛素并不能改善GDM患者的病理生理状态。而且部分研究显示胰岛素可能增加患者体质量[6, 7]。二甲双胍可以改善胰岛素抵抗,但因其可以透过胎盘[8],有导致胎儿早产及增加后代体质量的不良影响[9]。所以亟需寻找安全有效,可以改善GDM患者病理生理紊乱的药物。
黄连素是从多年生草本植物黄连、三角叶黄连或云连的根茎,即黄连中提取到的一种有效化学成分,另有多种植物中也含有黄连素。由于其天然,毒副作用小,应用前景极其广阔,具有降血糖、降血脂和改善胰岛素抵抗的作用。既往研究显示,黄连素可以通过抑制炎症因子改善肥胖及2型糖尿病胰岛素抵抗。Jiang等[10]研究证实,黄连素可以通过使IκB-β第181位氨基酸残基磷酸化而抑制NF-κB;而Xie等[11]发现,黄连素还可以通过抑制Rho GTP酶信号通路抑制NF-κB,进而减少炎症因子的释放。此外黄连素还可以通过AMPK通路抑制巨噬细胞分泌促炎因子诱导型一氧化氮合酶、环氧合酶2[12]。黄连素已经被证实在治疗与胰岛素抵抗为主要特征的疾病时(如2型糖尿病、高脂血症、多囊卵巢综合征等)具有良好疗效。本研究旨在GDM大鼠模型中观察黄连素对其胰岛素抵抗的作用。本研究显示,GDM组体质量、TC、TG、ALT、AST及IR均高于对照组,GDM组胎鼠体质量及胎盘质量均高于对照组,表明GDM大鼠体质量、血糖、血脂均显著升高,并出现肝功能异常、严重胰岛素抵抗,导致其胎鼠出生体质量及胎盘质量均显著升高;黄连素干预组体质量、TC、TG、ALT、AST及IR均低于GDM组,胎鼠体质量及胎盘质量均低于GDM组,表明黄连素干预后对GDM大鼠具有显著改善胰岛素抵抗、降血糖和降低胎鼠体质量的作用。
慢性低度组织炎症是系统性胰岛素抵抗的重要原因,并且是肥胖和2型糖尿病患者胰岛素敏感性下降的关键因素[13, 14]。研究发现,中性粒细胞激活后将募集巨噬细胞和抗原呈递细胞产生大量TNF-α、IL-1β和IL-6等炎症因子[15~17]。MCP-1属于趋化因子CC亚族成员,其高表达可通过促进单核细胞和巨噬细胞迁移和浸润导致慢性低度炎症的发生,既往有学者研究发现其在非酒精性脂肪肝、肥胖、糖尿病等胰岛素抵抗相关性疾病中高表达[5],与本研究结果相一致。Mansuy-Aubert等[5]在高脂饲料喂养小鼠肝脏组织中发现中性粒细胞浸润,并通过分泌NE,降低胰岛素受体底物1导致胰岛素抵,而NE敲除小鼠炎症反应明显减轻,胰岛素敏感性增加。Maria等[18]的体外研究显示,GDM患者的中性粒细胞活性增加,中性粒细胞胞外陷阱和NE水平升高。所以NE可能在导致胰岛素抵抗中起着非常重要的作用。而与NE对应的α1-AT则是保护组织免受丝氨酸蛋白酶损害的的一种物质[5]。本研究发现,GDM组NE水平高于对照组,α1-AT水平低于对照组,NE/1-AT比值高于对照组,提示GDM大鼠存在NE过度分泌的情况,作为与其对应的抗炎因子α1-AT则明显下降,NE/α1-AT升高;黄连素干预组NE水平低于GDM组,α1-AT水平高于GDM组,NE/α1-AT比值低于GDM组,提示黄连素干预后上述指标均有明显改善,炎症因子表达的不平衡现象也得到了改善;GDM组MCP-1、TNF-α mRNA表达均高于对照组,黄连素干预组MCP-1、TNF-α mRNA表达均低于对照组,提示妊娠期糖尿病大鼠肝脏组织NE/α1-AT比例的失衡可能促进了单核细胞和巨噬细胞的募集,导致过多的促炎因子的释放,进而导致大鼠胰岛素抵抗的发生,而黄连素可能正是通过改善上述通路发挥其有效作用,而不是通过调节血脂紊乱实现的。
