基于FlowJo 软件生物信息学降维方法的小鼠骨髓造血干祖细胞流式分析
2020-03-18梁昊岳于文颖付伟超董树旭赵轼轩茹永新高瀛岱
梁昊岳,张 森,于文颖,付伟超,董树旭,赵轼轩,茹永新,高瀛岱
(中国医学科学院血液病医院(中国医学科学院血液学研究所),实验血液学国家重点实验室,国家血液病临床医学研究中心,天津300020)
0 引言
作为研究最多的组织干细胞类型之一,造血干细胞(hematopoietic stem cell,HSC)能够自我更新并产生体内的所有血液和免疫细胞。在不同遗传背景的小鼠中,HSC 的活性似乎与寿命相关,稳态条件下小鼠体内造血干祖细胞分化发育和免疫调控是当前科学研究的热点[1-4]。HSC 能够在接受辐照的移植小鼠体内自我更新并进行多系造血重建。因此,基于流式细胞术建立的小鼠骨髓移植(bone marrow transplantation,BMT)技术是通常用于检查小鼠HSC 活性的主要检测方法,被广泛应用于小鼠骨髓造血干祖细胞生物学研究[5-8]。
以FACS Diva 和FlowJo 为代表的流式分析软件可帮助研究者获得细胞群体比例、平均荧光强度分析、细胞周期、细胞凋亡、细胞增殖等有效的实验分析数据,发挥着重要的实验支撑功能[9-12]。近期问世的FlowJo 分析方法在已有功能的基础上,结合生物信息学原理,提供了多种科学、直观的降维分析方法,具有广阔的应用前景[13-15]。
本实验应用流式细胞仪对小鼠骨髓造血干祖细胞进行分析。同时,对应用t-分布邻域嵌入算法(t-distributed stochastic neighbor embedding,tSNE)、统一流形逼近与投影(uniform manifold approximation and projection,UMAP)和流式自组织特征映射(flow selforganizing feature map,FlowSOM)分析所得结果与传统流式分析结果进行比较,以期为小鼠造血干祖细胞流式分析提供一种新方法。
1 材料和方法
1.1 实验动物
雌性C57BL/6J(B6)同类系小鼠用于小鼠骨髓造血干祖细胞流式分析实验。实验小鼠来自中国医学科学院血液病医院(中国医学科学院血液学研究所)实验动物中心。
1.2 实验试剂
流式细胞分析所需抗体APC-Cy7 标记的小鼠Lineage markers 抗体、APC 标记的小鼠c-kit 抗体、PE-Cy7 标记的小鼠Sca-1 抗体、FITC 标记的小鼠CD34 抗体、PE 标记的小鼠CD16/32 抗体均购自美国eBioscience 公司。Cytometer Setup&Tracking beads、Rainbow beads、Accudrop beads 均购自美国BD公司。
1.3 仪器与设备
流式细胞仪(Becton,Dickinson and Company CantoⅡ,美国),离心机(Beckman,美国)。
1.4 供体小鼠骨髓细胞的分离获取
(1)B6-Ly5.1 小鼠脱颈处死,在医用酒精中浸泡消毒5 min 后从两条腿上解剖出胫骨和股骨,将其放入装有预冷磷酸盐缓冲液(phosphate buffer saline,PBS)的6 或10 mm 培养皿中。(2)使用锋利的手术剪刀从骨骼中移除肌肉。对于每根骨头,使用5 ml注射器和25 号针头吸取3 ml 冰冷的磷酸盐缓冲电解液(phosphate buffer electrolyte,PBE)。将针头插入骨头的一端,然后将骨髓从小孔中取出放入5 ml 流式管中。(3)彻底混合细胞悬浮液,将细胞通过30~70 μm 尼龙筛网过滤器后放入新的5 ml 流式管中,以去除细胞团块。用血细胞计数器或自动计数器计算有核细胞的数量。将细胞悬浮在冰上备用。
1.5 流式细胞染色及上机检测
用PBE 将细胞浓度调节至每50 μl 约1×107个细胞。每50 μl 染色系统向细胞中加入抗体(APC-Cy7标记的小鼠Lineage markers 抗体,APC 标记的小鼠c-kit 抗体,PE-Cy7 标记的小鼠Sca-1 抗体,FITC 标记的小鼠CD34 抗体,PE 标记的小鼠CD16/32 抗体),并在冰上孵育细胞60~90 min。孵育后,用2 ml PBE 洗涤细胞2 次。通过30~70 μm 的尼龙网过滤细胞。将细胞悬浮在适当体积的预冷PBE 中进行流式检测。为了区分死细胞,在使用样品进行流式检测之前提前加入最终浓度为1 μg/ml 的DAPI(Pacific Blue 通道)。
1.6 分析方法
应用FlowJoTMv10.6.1 流式细胞分析软件(购自美国BD 公司)对小鼠骨髓造血干祖细胞进行降维分析。
2 研究结果
2.1 小鼠骨髓造血干祖细胞流式细胞分析结果
通过流式细胞检测小鼠骨髓造血干祖细胞结果如图1 所示。首先使用Lineage Cocktail markers 去除成熟血液细胞,再经c-kit+选出造血干祖细胞(hematopoietic stem and progenitor cell,HSPC),结合Sca-1、CD34 和CD16/32 圈选出长周期造血干细胞(long term HSC,LT-HSC,CD34-LSK CD16/32-)、短周期造血干细胞(short term HSC,ST-HSC,CD34+LSK CD16/32-)和多能祖细胞(multipotent progenitor,MPP,CD34+LSK CD16/32+)。各流式图中细胞分群特征明显,流式门圈选准确,为后续生物信息学分析打下了基础。
2.2 小鼠骨髓造血干祖细胞流式细胞tSNE 分析
小鼠骨髓造血干祖细胞流式细胞tSNE 分析结果如图2 所示,每个点对应一个单细胞,并根据荧光通道进行着色,(a)~(f)分别表征DAPI、Lineage markers、c-kit、Sca-1、CD34 和CD16/32 的表 达 水平。tSNE 分析将多维度显示的造血干祖细胞各群以二维形式呈现出来,处于相近位置的细胞具有相近的抗原表达水平和相近的细胞类型。这种形式改变了常规流式分析中逐级圈门的方式,将各群细胞的抗原表达情况全面直观地展示出来。由图2 中可以看出,细胞群体中DAPI-细胞占绝大多数,表明细胞活性较好。Lineage markers 表达较低,c-kit 呈弱阳性表达,Sca-1也呈弱阳性表达,表明细胞群体主要为低分化的干祖细胞。CD34 表达以阳性为主,与ST-HSC(58.3%)和MPP(12.6%)所占细胞群比例相符。CD16/32 有少量阳性,与LT-HSC(22%)所占细胞群比例相符。总体来看,tSNE 分析结果很好地反映了细胞群体的流式分群和比例情况,所得结果直观可信。
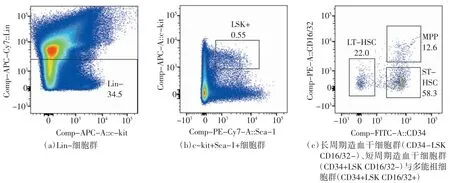
图1 小鼠骨髓造血干祖细胞流式细胞分析结果
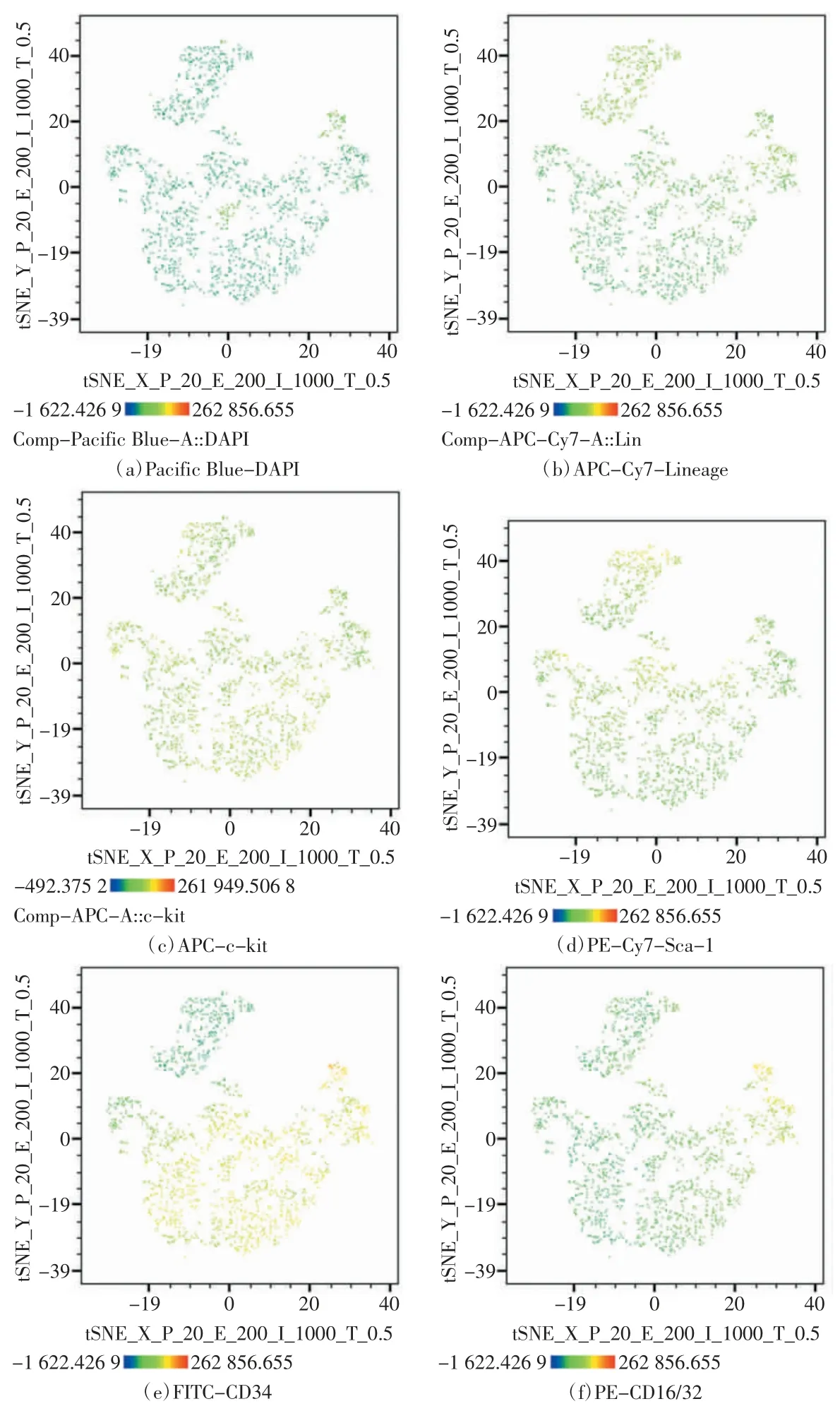
图2 小鼠骨髓造血干祖细胞流式细胞tSNE 分析结果
2.3 小鼠骨髓造血干祖细胞流式细胞UMAP 分析
小鼠骨髓造血干祖细胞流式细胞UMAP 分析结果如图3 所示,每个点对应一个单细胞,并根据荧光通道进行着色,(a)~(f)分别表征DAPI、Lineage mar-kers、c-kit、Sca-1、CD34 和CD16/32 的表达水平。分析结果与tSNE 结果相近。UMAP 分析结果图中细胞分为3 个群,LTHSC(22%)单独成群,其CD34 和CD16/32表达呈阴性,与所占细胞群比例相符。STHSC(58.3%)和MPP(12.6%)细胞群呈连续状态,CD16/32 阴性群为ST-HSC,阳性群为MPP,与所占细胞群比例相符。
2.4 小鼠骨髓造血干祖细胞流式细胞FlowSOM 分析
如图4(a)所示,UMAP 分析结果中红色为LT-HSC 细胞群,紫色为ST-HSC 细胞群,绿色为MPP 细胞群。如图4(b)所示,细胞群体经FlowSOM 分析分为8 组,热图颜色密度表示给定抗原的平均表达,经归一化后形成热图。8 组细胞中DAPI、Lineage 以阴性为主,c-kit、Sca-1 以阳性为主,CD34 和CD16/32 阴、阳性群体各有分布,反映了LT-HSC、ST-HSC 和MPP 的分布情况,与tSNE 和UMAP 结果相近。如图4(c)所示,每种颜色线条代表Flow-SOM 分析所得的一组细胞,折线图反映了8 组细胞中6 个抗原的表达变化情况,其结果与图4(b)反映的情况相一致。
如图5 所示,100 个单细胞以抗原表达情况为依据,形成聚类分析结果。标识颜色越相近、所在位置越相近的细胞,其抗原表达和细胞类型越接近。着色的扇形标识表示该抗原表达强弱情况,扇形标识越大,该抗原表达越多。由图5(c)可见,主要细胞群包括3 个,细胞比例最高的一群为ST-HSC(绿色),其CD34 表达为阳性,CD16/32 表达为阴性。细胞比例次之的为LT-HSC(红色),其CD34 和CD16/32 表达均为阴性。细胞比例第三的为MPP(蓝色),其CD34 和CD16/32表达均为阳性。聚类分析结果与3 种细胞的细胞群比例相符,呈依次降低关系(58.3%、22.0%、12.6%)。
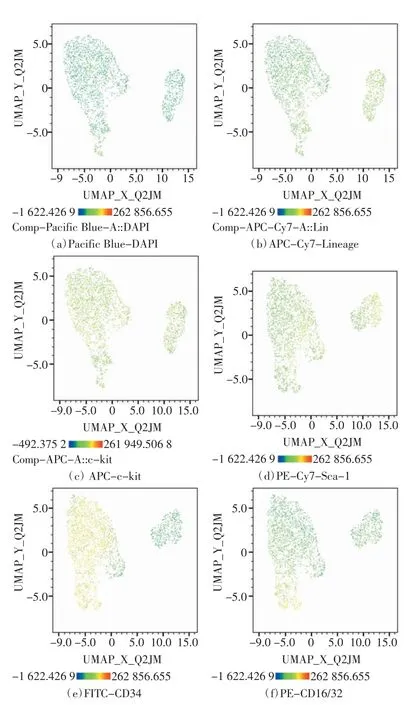
图3 小鼠骨髓造血干祖细胞流式细胞UMAP 分析结果

图4 小鼠骨髓造血干祖细胞流式细胞FlowSOM 分析结果
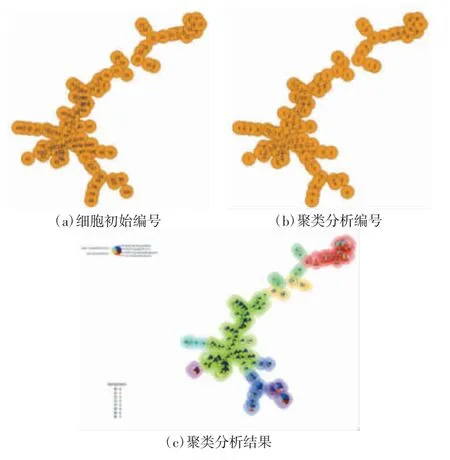
图5 小鼠骨髓造血干祖细胞流式细胞FlowSOM 聚类分析结果
3 讨论
小鼠骨髓造血干祖细胞流式检测原理主要包括LSK(Lineage/Sca-1/c-kit)、SLAM(signaling lymphocytic activation molecule)和SP(side population)3 种方法,分别以Lineage/Sca-1/c-kit、CD48/CD150 和Hoechst33342 为主要识别标志。本研究以LSK 方法为基础,结合CD34 和CD16/32 标记LT-HSC、STHSC 和MPP 进行流式数据分析,为后续流式分选和小鼠骨髓造血干细胞移植实验打下基础。小鼠骨髓造血干细胞移植并检测造血重建能力是研究造血干细胞干性的金标准,该实验对研究造血干细胞的自我更新、多向分化、归巢和发育等生物学功能有着十分重要的意义。因此,流式细胞检测和数据分析对造血干细胞生物学研究发挥着举足轻重的作用。
流式细胞仪数据分析常见软件包括FlowJo、FACS Diva、FACS Sortware 等,可以提供经典的流式细胞表型、荧光蛋白、细胞周期、细胞凋亡、细胞增殖、胞内钙动员、染色体核型、磷酸化蛋白分析、活性氧分析及微小颗粒物分析等实验血液学研究必备的数据分析方法[16-17]。FACS Diva 和FACS Sortware 均可与流式细胞仪联动使用,分别为BD LSRⅡ、LSRFortessa、CantoⅡ、AriaⅢ及Influx 等型号流式细胞仪分析及分选实验提供软件支撑。FACS Diva 界面设计友好,电压调节、补偿调节、圈门十分方便,但导出流式图片功能有待改善。FACS Sortware 主要为Influx分选仪提供支持,具有自动辅助圈门的功能,避免流式门圈选重叠,造成分选混乱。FlowJo 是专为流式数据离线分析设计的软件,以Excel 文件形式导出数据更加便捷,结合生物信息学降维分析,将传统的逐级圈门流式分析方法进行降维分析,形成可视化的数据图形,有助于发现新的细胞群体和获得更为直观的分析效果。与此同时,以FlowJo 为代表的流式数据分析软件为白血病免疫分型、淋巴瘤分型、血液系统肿瘤微小残留病及部分实体肿瘤检测提供了科学的分析方法,有效地促进了临床血液学和肿瘤生物学检测技术的发展[18-19]。基于流式细胞术的不断深入发展,流式数据分析方法研究也不断向前发展,结合生物信息学方法,为多激光多色流式分析和高速高通量流式分选实验奠定了基础[20]。
本研究采用tSNE、UMAP 和FlowSOM 分析与传统流式分析方式相比较的方法,分析流式细胞术检测的小鼠骨髓造血干祖细胞。tSNE 和UMAP 依据不同的算法对流式数据进行降维处理,使图形可视化水平更好。FlowSOM 对研究对象进行聚类分析,以树状图的形式反映被测细胞间的相互关系和抗原表达水平。这3 种FlowJo 软件分析功能所得结果反映了LTHSC、ST-HSC 和MPP 的分布情况,丰富了数据的表征形式,与传统流式分析方式所得细胞群比例相符,印证了tSNE、UMAP 和FlowSOM 分析方法的可行性和稳定性。本研究关注的小鼠造血干细胞流式分析是实验血液学研究的重要基础,但缺乏造血系统其他细胞如定向祖细胞及成熟细胞的流式分析,且与以热图为表征的聚类分析结合不够紧密。在未来的研究中,将以小鼠为模式生物的髓系祖细胞(common myeloid progenitor,CMP)、粒细胞-巨噬细胞祖细胞(granulocyte-macrophage progenitor,GMP)、髓系-红系祖细胞(myelo-erythroid progenitor,MEP)、单核细胞、淋巴细胞等造血细胞纳入分析,将基于Flowjo 软件平台的生物信息学流式细胞分析研究推向深入。
综上,流式细胞术与FlowJo 软件生物信息学分析方法相结合,可以很好地检测、分析小鼠骨髓造血干祖细胞各群分布和比例,反映群体细胞的抗原表达水平,对细胞进行分群和聚类,并且可以提供传统流式分析方法所不具备的直观视角,有助于造血干细胞生物学的研究发展,具有深远的科研和临床意义。
