腹腔镜广泛子宫切除术在治疗FIGO ⅠB~ⅡA期大瘤体宫颈癌中的临床价值
2020-03-18张蕾王嘉宁王利明陈昕
张蕾 王嘉宁 王利明 陈昕
宫颈癌是全球女性发病率和死亡率最高的第四类恶性肿瘤,仅次于乳腺癌、结肠癌和肺癌。宫颈癌的主要治疗方法有根治性子宫切除术和淋巴结清扫术及放化疗。对于早期宫颈癌传统的治疗方法是经腹广泛性子宫切除和盆腔淋巴结清扫术(ARH)。近年来,Nezhat等[1]提出腹腔镜广泛子宫切除术联合盆腔淋巴结清扫术(LRH)是治疗宫颈癌安全可行的方法。然而,国内外近年来大多是研究腹腔镜广泛子宫切除术用于治疗国际妇产科联盟(FIGO)ⅠA2~ⅠB1的小瘤体宫颈癌病例,很少有研究在治疗大瘤体宫颈癌中的可行性。为研究该术式在大瘤体宫颈癌中的临床应用价值,我们回顾分析腹腔镜和开腹广泛性子宫切除在FIGO ⅠB~ⅡA期大瘤体宫颈癌患者的临床资料,分析其安全性、可行性、远期肿瘤结局。
1 资料与方法
1.1 一般资料 选择苏州市第九人民医院和苏州大学附属第二医院妇产科于2012年10月至2018年9月收治的40例ⅠB~ⅡA期宫颈癌患者。纳入标准:(1)患者经宫颈活检或宫颈锥切术病理诊断为浸润性鳞状细胞癌、腺癌或腺鳞癌;(2)按FIGO2009年临床分期标准,术前由2位副主任医师一同进行妇科检查,共同确定临床分期为ⅠB~ⅡA期的患者;(3)宫颈肿瘤直径>3 cm;(4)术前未接受放化疗的初始治疗患者;(5)手术方式:腹腔镜广泛子宫切除术+盆腔淋巴结清扫术或经腹广泛子宫切除术+盆腔淋巴结清扫术。排除标准:(1)有重大心肺疾病史;(2)存在远处转移;(3)同时合并其他部位肿瘤。根据手术方式不同分为腹腔镜广泛子宫切除组(LRH组)和经腹广泛子宫切除组(ARH组),每组20例。2组患者一般资料及病理情况差异无统计学意义(P>0.05),具有可比性。见表1。
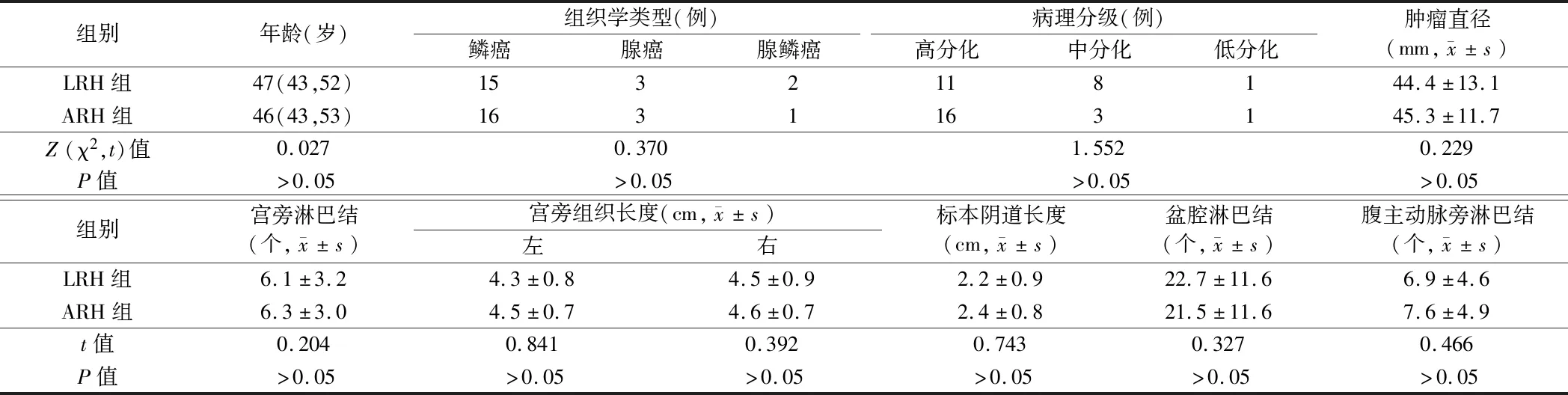
表1 2组患者一般资料及肿瘤病理情况比较 n=20
1.2 手术方法 ARH组患者采用常规开腹广泛性子宫切除和盆腔淋巴结清扫术。LRH组患者采用腹腔镜下广泛性子宫切除和盆腔淋巴结清扫术,年轻患者行卵巢悬吊术保留正常的卵巢。
1.2.1 建立气腹,切除或悬吊卵巢:气管插管联合静脉全身麻醉下,患者取截石位,腹部及外阴阴道常规消毒,铺巾,保留导尿,置入杯式举宫器,采用“四孔法”施术,充二氧化碳气体形成气腹,待腹腔内压力升至12~14 mm Hg后,将患者逐渐转成头低臀高与水平成30°,开始手术。双极电凝凝切双侧圆韧带近盆壁处。于双侧圆韧带断端处打开阔韧带前后叶及后腹膜直至髂总动脉部位,游离输尿管,距卵巢门6 cm处高位结扎卵巢动静脉,超声刀切除双侧输卵管,年轻患者若保留卵巢功能,则将卵巢游离移位至骨盆外骼窝处,
1.2.2 淋巴结清扫:超声刀打开右侧后腹膜,暴露右骼血管,沿右髂外动脉切开血管鞘,直达腹股沟深淋巴结,切除右侧腹股沟深淋巴结,沿髂外动静脉剥离淋巴组织,切除右侧髂外淋巴结,在右髂总动脉分叉上3 cm处切除右侧髂总淋巴结,暴露闭孔窝内闭孔神经及闭孔动静脉,切除闭孔神经上方的脂肪及淋巴结组织,暴露右髂内动脉,从上外侧分离及清除右侧髂内淋巴结。同法处理左侧盆腔淋巴结组织,如术中发现髂总淋巴结阳性则同时行腹主动脉旁淋巴结切除术,切除范围达腹主动脉分叉上方2 cm,淋巴结分别置入标本袋中取出。
1.2.3 根治性子宫切除:打开膀胱反折腹膜并下推至宫颈外口下,分别提起近子宫侧后腹膜,游离子宫颈段的输尿管直至宫颈旁,打开输尿管隧道,再次下推膀胱至宫颈下约4 cm,双极电凝凝切双侧子宫动静脉,宫颈旁3 cm处,Ligasure凝切双侧子宫主韧带,打开直肠侧窝,Ligasure凝切双侧骶韧带约3 cm。超声刀在穹窿下3 cm处打开阴道壁,完整切下全子宫及部分阴道壁。用-0合成线连续缝合阴道残端。
1.3 术后处理及随访
1.3.1 2组患者均术后常规预防性抗菌治疗2 d,腹腔引流量24 d<100 ml时拔出引流管。术后10 d开始定期夹闭导尿管,锻炼膀胱功能,术后12 d拔出导尿管,残余尿>100 ml重新放置导尿管。术后根据病理结果,按照宫颈癌NCCN指南,具有1个或1个以上复发高危因素的患者,包括阴道切缘阳性、淋巴结转移或宫旁浸润,术后补充盆腔外照射和顺铂同期化疗,如阴道切缘阳性加阴道近距离放疗,补充放射治疗和化疗增敏。若具有≥2个的复发中危因素,包括肿瘤直径>4 cm,脉管癌栓、浸润达宫颈间质外1/3,术后补充盆腔外照射和顺铂同期化疗[2]。
1.3.2 定期随访,即术后半年,每2个月复查1次,第1~2年每3个月复查1次,第3~5年开始每6月复查1次,第5年起每年1次。随访内容:全身体格检查、妇科检查及癌胚抗原、细胞角蛋白等肿瘤标志物检测和阴道脱落细胞学检查、人乳头瘤病毒检测,必要时行阴道镜检查及病理活检,胸片,盆腔MRI,超声,全身浅表淋巴结超声检查[3]。
1.4 观察指标
1.4.1 临床数据:临床分期、年龄、手术时间、术中失血量、输血率、术后肠道功能恢复时间、腹腔引流时间、导尿管留置时间、术后住院时间、术后辅助治疗、随访例数、复发例数、死亡例数。
1.4.2 术中术后并发症:输尿管损伤、血管损伤、直肠损伤、闭孔神经损伤、术后发热、淋巴囊肿、尿漏、肠梗阻、输尿管狭窄、伤口裂开、尿潴留。
1.4.3 随访:复发:手术治疗后1年,放化疗后6个月出现新的病灶。随访终点:临床确诊局部复发或远处转移。无病生存时间(disease free survival):定义为术后至疾病复发的时间。随访时间:从手术日开始计算。
2 结果
2.1 2组患者手术情况比较 LRH组术中失血量、输血率、肛门排气时间、术后住院时间均低于ARH组,差异有统计学意义(P<0.05);LRH组腹腔引流时间长于ARH组(P<0.05),2组患者的手术时间、导尿管留置时间、术后补充治疗差异无统计学意义(P>0.05)。见表2。
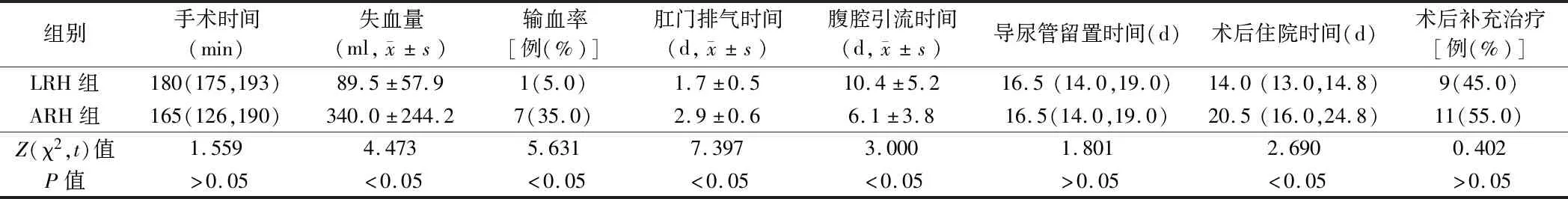
表2 2组患者手术情况比较 n=20
2.2 2组患者围术期并发症情况比较 2组分别有2例患者发生术中并发症,均为输尿管损伤,无血管、直肠损伤,无闭孔神经损伤。LRH组有1例患者因盆腔淋巴囊肿伴感染导致术后持续发热,经抗感染治疗后约术后16 d恢复正常体温;ARH组有2例患者发生盆腔淋巴结囊肿感染术后持续发热,经抗感染治疗约术后20 d恢复正常体温。LRH组有1例尿漏,术后15 d发生,放置输尿管支架保守治疗后3个月恢复正常。ARH组无尿漏发生,但有1例肠梗阻,术后1个月发病,经过开腹手术治愈。LRH组总并发症发生率为55.0%显著低于ARH组的85.0%,差异有统计学意义(P<0.05)。见表3。

表3 2组患者围术期并发症情况 n=20,例(%)
2.3 2组患者随访期情况 LRH组术后随访(25.10±15.62)个月,ARH组(27.60±16.17)个月,2组随访时间差异无统计学意义(P>0.05)。LRH组术后复发1例,无死亡病例;ARH组术后复发1例,无死亡病例。LRH组和ARH组的无病生存曲线差异无统计学意义(P=0.749)。进一步将2组按年龄(是否≥50)分层分析,对亚组进行单因素分析时发现,无论患者年龄(是否≥50)、淋巴结转移情况,LRH组和ARH组DFS差异均无统计学意义(P>0.05)。见图1~3。

图1 Kaplan-Meier分析ⅠB~ⅡA期宫颈癌患者腹腔镜广泛子宫切除术后与经腹广泛子宫切除术后无病生存率的影响图2 ⅠB~ⅡA期宫颈癌患者年龄(<50岁)对腹腔镜广泛子宫切除术后与经腹广泛子宫切除术后无病生存率的影响图3 ⅠB~ⅡA期宫颈癌患者年龄(≥50)岁对腹腔镜广泛子宫切除术后与经腹广泛子宫切除术后无病生存率的影响
3 讨论
妇科肿瘤专家建议有多种手术入路来完成腹腔镜下广泛子宫切除术。Naik等[4]的报道中显示腹腔镜辅助经阴道广泛子宫切除术后阴道切缘阳性率比腹腔镜下广泛性子宫切除术显著升高,可能是根治性切除的范围较少,同时Choi等[5]研究也发现腹腔镜辅助经阴道广泛子宫切除术复发率比完全腹腔镜组高,可能是因为手术较难确定足够的阴道切除长度和切缘阴性。另外,当阴道打开的时候,肿瘤暴露于循环的CO2中,举宫器有可能导致肿瘤的扩散[6]。
有作者报道,腹腔镜手术较开腹手术的围手术期并发症发生率高[7],最常见的是泌尿道损伤和血管损伤,泌尿道损伤包括膀胱损伤和输尿管损伤。本研究中术中泌尿道损伤发生率为10.0%,较颜笑健等[8]的研究发生率高,可能是因为我们的研究对象是肿瘤直径较大的患者,而之前的大多数研究对象都是FIGO ⅠA1~ⅠB1的患者。LRH组术后发生盆腔淋巴囊肿的比例低于ARH组,是由于超声刀能有效的闭合淋巴管,完整切除淋巴结,术后能减少淋巴囊肿的形成。本研究中的输尿管损伤的患者均在术后3~6个月内完全康复。本研究中LRH组的失血量比ARH组少,由于腹腔镜视野放大,对解剖位置有更加清晰的认识,尤其是在切开输尿管和小血管止血时,有效减少了出血。同时术中超声刀的使用也能明显减少术中出血。
局部肿瘤≥4 cm的早期宫颈癌放射治疗是其传统治疗方法,从20世纪80年代开始,同步放化疗对局部晚期宫颈癌有很好的疗效,但其也存在明显的缺陷,如放疗对卵巢和阴道的损伤,当放疗剂量达到6~10 Gy 时,卵巢永久性破坏,阴道上皮纤维化,进而形成阴道挛缩[9]。而初始的宫颈癌根治性手术有以下优点:不仅能准确的分期,切除镜下阳性淋巴结,切除巨大的宫颈肿瘤、还能保留卵巢功能。本研究年轻女性术中同时行卵巢悬吊术,很好的保留了卵巢功能。Sutton等[10]统计发现鳞癌的卵巢转移率为0.5%(4/770),腺癌转移率为1.7%(2/21),虽然腺癌转移率相对高,但总转移率仍低。故卵巢保留不失为一个安全可行的选择。一些回顾性研究表明,对于瘤体大的宫颈癌初始手术后的辅助放化疗可以获得较好的生存率和复发率[11]。此外,所有接受根治性手术的患者并不一定都接受辅助治疗。从而得出结论:初始根治性手术本身减少了不必要的辅助治疗,并为选择合适的治疗方案提供了依据。Park等[11]研究表明,有30%的早期宫颈癌合并大瘤体的患者单纯接受根治性手术,没有辅助治疗,也能收到较好的疗效。本研究中,LRH组就有55%的比例仅单纯接受根治性手术,ARH组也有45%单纯行根治性手术,没有辅助治疗。此外,Ziebarth等[12]报道仅完成根治性手术和淋巴结清扫在减少辐射暴露的同时并没有影响安全性和肿瘤结局。所以,手术切除原发性肿瘤从而限制了局部辐射暴露,可能减少长期后遗症。
虽然最近有不少研究关于FIGO ⅠB和ⅡA的宫颈癌腹腔镜广泛子宫切除的研究报道,但平均肿瘤直径<3 cm,若肿瘤直径>4 cm则术前行新辅助化疗待瘤体缩小1/2后再行手术[13]。迄今为止,笔者所见没有对肿瘤直径>3 cm宫颈癌直接行腹腔镜下广泛子宫切除术的相关研究数据比较。本例2组肿瘤最大直径分别 7 cm 和6 cm。本研究有别于以往的研究,具有重要的意义。本研究也有一些局限性,在分组的时候非随机分配,导致选择偏倚。医院首先开展开腹的宫颈癌根治手术,病例收集较早,腔镜开展较晚,病例收集较晚,导致LRH组的术后随访时间较短。LRH组的腹腔引流时间长于ARH组,考虑与腔镜手术过程中超声刀、双极电凝、Ligasure等能量器械的使用,导致组织渗出液较多有关。
综述所述,腹腔镜下广泛子宫切除术是治疗FIGO ⅠB~ⅡA期大瘤体宫颈癌的可行方法,和ARH组相比,LRH组失血量少,术后住院时间短,术后无病生存率相当。由于病例有限和随访时间较短,故临床应用的远期疗效性有待更多实践的检验。
