宫颈癌中miR-15b、DCLK1的表达变化及与放疗敏感性的关系
2020-03-18王雯智郑蕾李虹
王雯智 郑蕾 李虹
宫颈癌(cervical cancer)是危及女性生命的恶性肿瘤之一,主要与HPV感染、不良生活习惯等有关,随着现代生活节奏加快,宫颈癌的发病率及死亡率逐年增加[1]。目前,主要以手术与放疗为主要治疗手段,放疗敏感者不良预后因素明显减少,但放疗不敏感者预后较差,因而放疗前预测患者对放疗的敏感性具有重要临床指导价值[2]。miRNAs在肿瘤发展进程中发挥致癌或抑癌作用,研究表明miRNAs表达可影响抗癌药物的敏感性,且miRNAs表达变化与放疗敏感性的关系密切相关,可作为个性化治疗的生物性标志[3]。研究表明miR-15家族中miR-15a可调控靶基因DCLK1(doublecortin-like kinase 1,DCLK1)表达参与肿瘤发生过程并能改变肿瘤细胞对化疗的敏感性,而miR-15b作为miR-15家族的一员是否可通过调控靶基因DCLK1表达变化影响患者对放疗敏感性值得进行研究[4]。因此,本研究主要探讨宫颈癌中miR-15b、DCLK1表达变化与放疗敏感性的关系。
1 资料与方法
1.1 一般资料 收集2013年1月至2015年9月于陕西省人民医院治疗的118例宫颈癌患者为研究对象,并将手术中切除的癌组织标本为宫颈癌组,并选取相应癌旁5 cm处的正常组织标本为正常组。患者年龄38~72岁,平均年龄(54.42±6.13)岁;收集临床资料包括病理分级、淋巴结转移、临床分期及肌层浸润程度。病理分级[5]:高分化20例,中/低分化共98例。按照国际FIGO分期标准进行临床分期[6]:Ⅰ期 52例,Ⅱ期48例,Ⅲ期18例。无淋巴结转移50例,淋巴结转移68例。本研究经过陕西省人民医院伦理委员会审批通过。
1.2 纳入与排除标准
1.2.1 纳入标准:①宫颈癌患者均经病理证实;②无放疗禁忌证;③确诊前未接受放疗或化疗;④生存时间>3个月;⑤所有患者及其家属签署知情同意书。
1.2.2 排除标准:①严重心脑血管合并症;②肝肾功能异常;③患有其他肿瘤;④临床资料不全者。
1.3 方法
1.3.1 标本采集:入组时宫颈癌组织及癌旁组织标本均来源于手术切除,放疗后采用活检钳采集宫颈癌病灶处及癌旁组织(大小为4~5 mm),锡纸包好后将其置于液氮中保存,稍后将其置于-80℃超低温冰箱保存待测。
1.3.2 qRT-PCR法检测宫颈组织中miR-15b、DCLK1表达量:采用RNA试剂盒提取总RNA,按照反转录试剂盒说明书将RNA反转录为cDNA。采用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)试剂盒进行qRT-PCR反应。反应体系为qRT-PCR反应体系20 μl:cDNA 1 μl,引物各0.5 μl,SYBR Green Mix 10 μl,RNase-free ddH2O 8 μl。miR-15b以U6内参基因,DCLK1以β-actin为内参基因,反应程序为95℃ 10 min;95℃ 15 s、60℃ 15 s,72℃ 15 s,共40个循环。反应结束后将数据保存并对所得数据Ct值进行分析,采用2-ΔΔCt算法计算miR-15b与DCLK1 mRNA相对表达量,并分析miR-15b与DCLK1表达与患者临床病理特征的关系。见表1。

表1 qRT-PCR引物序列
1.3.3 免疫组织化学法检测宫颈癌组织中DCLK1蛋白表达:制作宫颈癌组织芯片并将其连续切片,二甲苯脱蜡并在不同浓度梯度乙醇中脱水,每隔3 min用蒸馏水浸洗1次,共3次。滴加H2O2(3%)置于室温10 min,PBS清洗后加入稀释后的DCLK1一抗(1∶200)并置于4 ℃冰箱过夜,PBS清洗后加入二抗并置于37℃ 30 min,室温下反应2 h,PBS清洗后加入DAB显色液进行显色反应,蒸馏水清洗后用苏木精复染,用中性树脂进行封片,置于显微镜下进行观察。
1.3.4 结果及疗效判定:每张切片挑选5个较清晰视野对阳性染色细胞数量进行统计[7]。按照阳性细胞数目:阳性细胞数目<25%为0分;阳性细胞数目在25%~50%为1分;数目在51%~75%为2分;阳性数目>75%为3分。根据染色程度:未显色为0分;黄色为1分;淡黄色棕2分;黄色为3分。取2组计分乘积:≤4分为阴性表达,>4分为阳性表达。
1.4 疗效评定 根据WHO肿瘤治疗疗效标准对患者放疗后的临床疗效进行评定[8]。完全缓解(CK)即肿瘤病灶完全消失;部分缓解(PK)即患者主要临床症状基本消失;病灶稳定(SD)即患者症状基本改善;疾病进展(PD)即病情恶化或出现新的病灶。将CR+PR作为有效组,SD+PD为无效组。
1.5 随访 自治疗结束后开始随访,主要通过电话、门诊等方式进行随访3年,并统计无生存进展期(progression free survival,PFS):患者开始治疗到肿瘤进展或死亡这一段时间。

2 结果
2.1 miR-15b与DCLK1 mRNA及蛋白检测结果 宫颈癌组织中miR-15b表达低于正常组(P<0.05),DCKL1表达高于正常组(P<0.05)。免疫组化结果显示DCKL1位于细胞核,染色呈黄色、淡黄色、棕黄色。宫颈癌组DCLK1阳性率高于正常组,差异均有统计学意义(P<0.05)。见表2、3,图1。
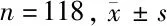

组别miR-15b/U6DCLK1/β-actin正常组 1.05±0.041.09±0.05宫颈癌组0.26±0.02∗3.30±0.12∗
注:与正常组比较,*P<0.05

表3 宫颈癌组织中DCLK1蛋白表达情况 n=118,例

DCLK1阴性表达

DCLK1阳性表达
2.2 宫颈癌组织中miR-15b、DCLK1表达与临床病理特征的关系 根据miR-15b中位值分为高表达组36例,低表达组82例。临床病理特征结果显示miR-15b表达与病理分级、淋巴结转移、临床分期有关,DCLK1表达与淋巴结转移、临床分期、肌层浸润程度有关,差异均有统计学意义(P<0.05)。见表4。

表4 宫颈癌组织中miR-15b、DCLK1表达与临床病理特征的关系 例(%)
2.3 miR-15b与DCLK1表达相关性分析 Pearson相关性分析结果显示miR-15b与DCLK1表达呈显著负相关(P<0.05)。见图2。

图2 miR-15b与DCLK1表达水平的相关性分析
2.4 放疗后宫颈癌组织中miR-15b、DCLK1表达变化与疗效的关系 放疗后宫颈癌组织中有效组miR-15b表达高于无效组,而有效组DCLK1表达低于无效组,差异均有统计学意义(P<0.05)。见表5。


组别miR-15bDCLK1有效组(n=97)0.89±0.021.17±0.11无效组(n=21)0.23±0.013.40±0.13t值3.1242.486P值0.0000.000
2.5 宫颈癌患者放疗后组织中miR-15b、DCLK1表达与预后的关系 Kaplan-Meier分析显示放疗后宫颈癌组织中miR-15b、DCLK1表达与PFS相关,miR-15b高表达组PFS(71.52%)高于低表达组(18.57%),DCLK1阴性表达组PFS(69.53%)高于阳性表达组(22.48%),差异有统计学意义(P<0.05)。见图3、4。

图3 放疗后宫颈癌组织中miR-15b表达与PFS的关系
3 讨论
近年来宫颈癌患者死亡率明显增加,但对其病因及机制尚未完全清楚,因而寻求宫颈癌诊断的特异性标记并明确其发病机制具有重要意义[9]。目前临床主要以手术与放疗结合的方式治疗宫颈癌,但由于放疗敏感性、耐药性等因素导致不同患者的治疗效果出现不同程度差异。由于宫颈癌发生发展与癌症相关基因的异常表达相关,研究表明miRNAs表达水平的变化可促进肿瘤细胞增殖分化及迁移从而引发宫颈癌[10]。Chen等[11]研究报道显示部分miRNAs的异常表达与癌症患者化疗或放疗的敏感性紧密相关。因此,本研究主要探讨miRNAs在宫颈癌组织中的表达变化与放疗敏感性的关系。

图4 放疗后宫颈癌组织中DCLK1表达与PFS的关系
miR-15b在胰腺癌等多种恶性肿瘤的发生发展中下调表达,并可通过不同调控机制影响肿瘤患者预后[12]。相关研究表明子宫内膜癌组织中miR-15b下调表达并发挥抑癌基因的功能[13]。目前关于miR-15b在宫颈癌组织中的表达研究笔者所见相对较少,本研究通过qRT-PCR检测宫颈癌组织及正常组中miR-15b表达,结果显示宫颈癌组织中miR-15b表达显著低于正常组(P<0.05),说明miR-15b在宫颈癌组织中低表达,可能在宫颈癌组织中发挥抑癌基因的功能。根据检测结果将miR-15b表达分为高表达组与低表达组,临床病理特征结果显示miR-15b表达与病理分级、淋巴结转移、临床分期均显著相关(P<0.05),说明miR-15b参与宫颈癌发生发展进程并随着病情进展表达逐渐降低。有研究报道显示miR-15b与抗癌药物或化疗敏感性相关,且miR-15b可调控下游基因表达而参与药物反应过程[14]。本研究结果显示与放疗前宫颈癌组织中miR-15b表达水平相比,放疗后宫颈癌组织中miR-15b表达明显升高且有效组miR-15b表达显著高于无效组(P<0.05),说明miR-15b表达变化与放疗疗效及敏感性密切相关。
DCLK1是DCX家族的一员并主要参与骨架形成及调节细胞运动等过程,有研究表明DCLK1在胃癌及直肠癌组织中呈高表达且与淋巴结转移及预后不良相关[15]。DCLK1可参与胰腺癌肿瘤形成过程,DCLK1阳性细胞可在胰腺癌组织中发生侵袭与转移并导致细胞增殖及病情恶化[16]。有研究表明DCLK1在结肠腺癌中高度表达并预测其为预防或消除结肠癌的重要靶点[17]。本研究通过qRT-PCR法检测DCLK1在宫颈癌组织中表达水平显著高于正常组(P<0.05),免疫组化结果显示宫颈癌组织中DCLK1阳性表达率显著高于正常组(P<0.05),说明DCLK1参与宫颈癌发生发展过程。临床病理特征分析结果显示DCLK1表达与淋巴结转移、临床分期、肌层浸润程度显著相关(P<0.05),在临床分期及发生淋巴结转移的宫颈癌组织中呈阳性表达,说明DCLK1不仅参与了宫颈癌病程进展,同时随着宫颈癌疾病程度加重DCLK1表达逐渐增加。与放疗前比较,宫颈癌组织中DCLK1表达显著降低且有效组DCLK1表达低于无效组(P<0.05),说明DCLK1表达变化与放疗效果及敏感性有关。相关研究表明miR-195与miR-15b可共同调控靶基因SALL4表达,miR-195可通过调控靶基因DCLK1表达进而参与肿瘤细胞增殖及迁移过程且与TNM分期、淋巴结转移率及预后相关[18]。基于此探讨宫颈癌组织中miR-15b是否也可调控DCLK1表达参与肿瘤细胞增殖分化过程具有重要意义,本研究采用Pearson法进行相关性分析,结果显示宫颈癌组织中miR-15b与DCLK1表达呈显著负相关(P<0.05),且放疗后二者表达变化趋势相反,说明miR-15b可能通过调控DCLK1表达而共同参与宫颈癌发生过程,同时其表达变化与放疗敏感性紧密相关。此外,本研究通过Kaplan-Meier法分析放疗后宫颈癌组织中miR-15b、DCLK1表达与患者PFS的关系,结果显示miR-15b高表达组PFS高于低表达组(P<0.05),DCLK1阴性表达组PFS高于阳性表达组(P<0.05),说明放疗后miR-15b与DCLK1表达水平的变化可作为预判患者预后的重要生物学指标。本研究结果揭示miR-15b与DCLK1在宫颈癌组织中异常表达可能在肿瘤发生发展进程中发挥重要作用且与预后不良有关,放疗能有效提高miR-15b在宫颈癌组织中的表达而促使DCLK1表达降低,放疗前宫颈癌组织中miR-15b与DCLK1表达与放疗敏感性及临床疗效密切相关,因而测定患者宫颈癌组织中miR-15b与DCLK1表达水平对放疗敏感性及患者预后预测均具有重要参考价值。
综上所述,宫颈癌组织中miR-15b下调表达,而DCLK1上调表达,二者呈负相关关系且均参与宫颈癌病程进展过程,miR-15b与DCLK1表达变化与放疗敏感性相关,二者均可能成为早期诊断宫颈癌、预测放疗敏感性及评估预后的重要分子标志物。但其中的具体调控机制有待进一步研究。
