Hippo-TAZ/YAP信号通路在头颈部鳞状细胞癌中的研究进展
2020-03-18邵伟华龚炜韬俞张红韩兴怡章馨钰杨建荣李中武
邵伟华,李 晋,龚炜韬,俞张红,韩兴怡,章馨钰,杨建荣,2,李中武
Hippo信号通路中的主要组分最初是在果蝇(drosophila)体内通过遗传筛选发现的、其对器官大小具有调控功能作用的遗传基因。其次,它是一个进化上高度保守的信号通路,从果蝇到脊椎动物,其核心组分在结构和功能上高度类似。目前研究已经证实,该通路活化后通过激酶级联反应直接磷酸化转录辅激活因子YAP(Yes-associated protein)及其同源蛋白TAZ(transcriptional coactivator with PDZ-binding motif),使其在细胞质中滞留并降解。非磷酸化形式的TAZ/YAP可进入细胞核内通过与TEAD(TEAD1/TEAD2/TEAD3/TEAD4)及其他转录因子结合激活下游靶基因(CTGF、Cyr61等)的转录以促进细胞的增殖、侵袭、迁移和化疗耐药等过程。目前研究发现Hippo-TAZ/YAP信号通路在人类多种恶性肿瘤中呈异常表达,与肿瘤的恶性表型以及患者的预后密切相关,被认为是一种新的肿瘤分子标志物及潜在的治疗靶点。
头颈部鳞状细胞癌(head and neck squamous cell carcinomas,HNSCC)作为一种世界范围内普遍发生的肿瘤已日益受到关注,主要指发生于口腔,咽(包括鼻咽、口咽和下咽)和喉部的鳞状细胞癌,发病率在所有肿瘤疾病中排第六位[1]。近年来,越来越多研究表明Hippo-TAZ/YAP信号通路在头颈肿瘤发生发展过程中扮演重要角色。本文主要综述Hippo-TAZ/YAP信号通路调控机制及其在头颈鳞癌方面的最新研究进展。
1 Hippo信号通路介绍
Hippo通路起源于果蝇细胞内的Hippo激酶,在多种多细胞生物中均有发现且高度保守,其第一个基因(wts)由耶鲁大学教授许田在1995年通过果蝇镶嵌体遗传筛选技术首次发现这些基因的突变会产生过度生长的表型[2]。经过十几年的探索,对Hippo通路的研究已日渐成熟。研究证实其主要参与调节细胞的生长、增殖、分化和凋亡等过程,并且参与调控组织器官的大小、形成及发育等,同时与肿瘤的发生和发展过程也有直接的关系[3]。目前,在哺乳类动物当中已阐明Hippo信号通路的研究主要包括以下四个部分:①上游信号输入因子(包括Fat4、Dchs、FRMD6、NF2、KIBRA等),主要功能是接受细胞内外各种信号并将接收的信号转换成Hippo信号通路可识别的调节信号,进而调控Hippo;②核心激酶级联反应链,(包括MST1/2(mammalian Sterile 20-like kinases 1/2)、hSAV1、LATS1/2 (large tumor suppressor 1/2)和MOB1(MOBKL1A/MOBKL1B));③下游核心转录共激活因子(包括TAZ/YAP和TEADs),Hippo通路的主要的调控效应依赖于核心激酶级联反应链和下游转录共激活因子对靶基因的转录的调控。④下游调节因子(包括ASPP1/2、p73、Ajuba等)[4]。目前对Hippo通路的研究也越来越关注下游调节因子,其调控机制不仅在于调控Hippo通路本身,而且可能在与细胞信号通路网的形成中发挥作用,具有一定的研究价值。
2 TAZ/YAP调控机制
2.1 TAZ/YAP介绍
TAZ/YAP作为Hippo通路的核心组成部分,最初是作为14-3-3的结合蛋白被发现,在正常生理状态下,TAZ/YAP及其mRNA在全身各种组织中可见表达[5]。人TAZ基因位于染色体3q25.1上,有400个氨基酸残基。TAZ的蛋白结构为一个N端富含脯氨酸的序列、多个HXRXXS序列、一个卷曲螺旋区域、一段转录激活区域、一个WW结构域和一个C端可以与PDZ结构域结合的基序LTWL(TAZ定位于分离的细胞核点)[6]。YAP基因位于染色体11q13上,蛋白由两个同种型组成,主要包含两个WW结构域、一个SH3结合基序、一个TEAD结合区域、一个卷曲的螺旋结构域和转录激活域,与TAZ是同源异构体[7],结合蛋白为TP53家族蛋白(p63、p73α、p73β等,但不包括p53本身)[8]。
2.2 Hippo通路中TAZ/YAP的调控机制
目前研究表明,TAZ/YAP调控方式主要是在胞外蛋白水平的调控,在正常细胞中表现为“开、关”两种形式(如图1所示)。第一种,当Hippo通路“开放”时,即上游信号传入激活核心激酶级联反应链中,蛋白激酶MST1/2先被磷酸化,磷酸化的MST1/2在蛋白SAV1的协助下激活LATS1/2(研究表明,MST1/2并非直接激活LATS1/2,MST1/2磷酸化LATS1/2的C端疏水基序,进而促进LATS1/2自磷酸化,自磷酸化完成后LATS1/2才完成真正激活[9])和MOB1,磷酸化的LATS1/2和MOB1结合形成LATS1/2-Mob复合物,进一步促进了TAZ、YAP发生磷酸化,磷酸化的TAZ及YAP蛋白与细胞质中的14-3-3蛋白结合,经过泛素化修饰并被泛素依赖的蛋白酶体(SCFβ-TrCP)(表示由β-TrCP参与构成的SCF E3泛素连接酶复合物)降解,从而抑制细胞增殖与分化等[10-12]。另一种,当Hippo通路“关闭”时,即核心激酶级联反应链未收到激活信号时,非磷酸化的TAZ/YAP核转位后与转录因子TEAD1-4结合形成转录复合体,激活下游靶基因CTGF、IGFBP3、Axl等,从而促进细胞增殖、分化、抑制凋亡等[13]。这两方面的调控在正常细胞中相互制约,从而使细胞的生长、分化受到严格的限制。
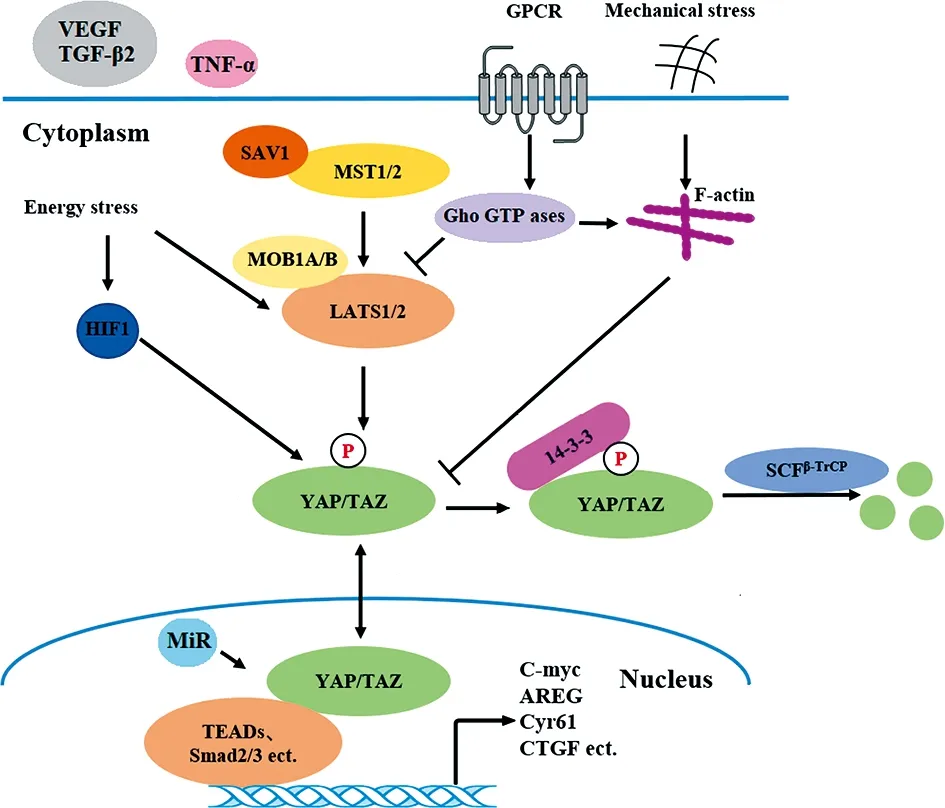
图1 Hippo-TAZ-YAP信号通路核心组分及其多重上游调控信号
TAZ/YAP的活性也受多种上游信号因子的调控,其中最为关键的是受机械环境的影响。研究表明,细胞外基质的硬度及细胞形态改变能够通过肌动蛋白-细胞骨架和Rho-ROCK(Ras homologfamily member-Rho kinase)两条通路显著调控TAZ/YAP的活性,参与调节细胞的增殖、分化以及相邻细胞间连接的紧密程度[14-15]。机械信号通过Rho-ROCK信号通路[16]或直接通过细胞骨架结构传入纤维状肌动蛋白(F-actin),F-actin将信号传递于LATS1/2,并抑制其活化,从而促进TAZ/YAP核转位。反之,当F-actin受到破坏时,将抑制TAZ/YAP的核转位[14]。G蛋白耦联受体(G-protein coupled receptor,GPCR)可单独或通过其下游的Rho GTP酶作用于F-actin,调控LATS1/2活性,进而对TAZ/YAP活性进行调控。其次,胞外众多分泌信号可通过相关的GPCR信号向下传递,通过改变TAZ/YAP的核定位从而发挥调节效应[17-19]。细胞内代谢状态也可调控TAZ/YAP的活性,细胞低活性状态时能抑制TAZ/YAP与TEAD的结合,从而抑制其转录活化下游靶基因[20],与细胞代谢相关的糖酵解、能量应激和甲羟戊酸生物合成参与调控TAZ/YAP的活性,当能量耗尽时,AMPK(AMP激活的蛋白激酶)在阻碍YAP和TEAD之间相互作用的位点上直接磷酸化YAP[21]。在正常细胞中,氧化应激水平对TAZ/YAP活性的调控主要表现为心肌细胞的损伤,但在肿瘤细胞中主要是促进LATS2蛋白降解,促使 TAZ/YAP核转位[22-23]。缺氧环境中,缺氧诱导因子HIF1 (hypoxia-inducible factors 1)可直接激活TAZ表达或与之相互作用来调节下游基因转录表达[24-25]。
除了上述机械环境和细胞内部代谢状态调控TAZ/YAP的活性外,Micro-RNA(MiR)也参与YAP活性调控。其中MiR-506,MiR-15a和MiR-16-1通过阻断YAP1诱导的TEAD的转录活性来调控YAP蛋白的表达,MiR-361通过抑制YAP的转录来调控YAP的表达[26-27]。有研究发现MiR-375因启动子甲基化而下调表达,导致YAP1、TEAD4和CTGF被共同激活促进胃癌的发生[28]。另外,不同的蛋白质翻译后修饰(PTM)可以通过激活酶、协调上游信号转导、TAZ/YAP核易位和转录激活等调控TAZ/YAP的活性[29]。现有研究发现某些细胞因子同样起调控TAZ/YAP作用并参与肿瘤的发生发展。作为肿瘤坏死因子的TNF-α通过介导LATS1/2的表达磷酸化YAP,磷酸化的YAP不进入细胞核从而调节与细胞增殖和侵袭相关的基因转录[30]。TGF-β通过TGF-β2-TAZ/YAP-Smad信号传导轴转录基因,表现为TGF-β2稳定TAZ/YAP并诱导核转位,而当TAZ/YAP受抑制时,出现抗纤维化效应[31]。血管内皮生长因子(VEGF)-NRP2信号传导通过调控TAZ/YAP-TEAD,调节靶基因Rad51,诱导受损DNA的修复[32]。IL-1β是YAP1的下游效应物,YAP1与IL-1β的启动子区域结合调控IL-1β转录,在幽门螺旋杆菌(Hp)感染引发的胃癌中促进持续性炎症微环境的产生[33]。而血小板衍生生长因子(PDGF)可以通过SRC家族激酶依赖性酪氨酸磷酸化驱动YAP的转录活性[34]。
3 Hippo-TAZ/YAP通路在肿瘤发生发展中的生物学基础
研究表明TAZ/YAP的激活可以促进细胞增殖,增强干细胞活性,加速组织修复与组织纤维化。其机制包括上调凋亡抑制剂的表达(如BCL-2[35]和凋亡抑制因子IAP等)促进细胞存活,调节细胞代谢促进细胞增殖,诱导胚胎细胞表型或更原始的干细胞的表达促进再生,激活星状细胞和成纤维细胞促进组织纤维化等[36]。Hippo通路的生物学效应导致其在调控紊乱的状态下诱导人体正常细胞向恶性肿瘤细胞转变,促进肿瘤的发生和发展[37-38]。
Hippo信号通路调控紊乱的机制多种多样,比如TAZ/YAP基因过表达,上游信号输入因子的突变致使上游调节信号输入紊乱,核心激酶链基因层面或蛋白层面的紊乱干扰信号传递,其他信号通路改变都能够对TAZ/YAP活性起到干扰作用。其中,异常活化的TAZ/YAP蛋白显著增强肿瘤细胞相关的生物学功能(图2)[39]。

图2 TAZ/YAP在肿瘤细胞中的生物学功能
3.1 TAZ/YAP- TEADs转录复合体促进肿瘤细胞增殖和转移
TAZ/YAP通过与TEADs等的结合形成转录复合体调控下游靶基因表达促进细胞异常增殖,主要机制包括诱导细胞自我更新,促进DNA合成,调控细胞周期蛋白和诱导其他原癌基因(如:c-Myc等)的激活从而提高细胞增殖水平[40]。TAZ与TEAD形成蛋白复合物后诱导表皮生长因子受体配体双调蛋白(amphiregulin, AREG)表达,从而促进肿瘤细胞增殖与迁移[41]。还有研究证明肿瘤细胞中TAZ不仅能增强肿瘤的侵袭性及恶性表型变化而且对于肿瘤耐药性的产生也起到重要的作用[37]。
3.2 上皮间充质转变(EMT)
大量研究表明,上皮-间质转化(EMT)在基本的细胞和病理生理过程中具有重要功能,包括伤口愈合,组织纤维化和许多器官肿瘤发生[42]。TAZ可促进肿瘤细胞中Twist蛋白表达诱导细胞发生EMT[43-44],并且TAZ的异常过表达可以显著减弱肿瘤细胞间的接触抑制和失巢凋亡效应,这将更容易促进肿瘤细胞发生侵袭与转移[45-46]。最近Qiu等发现肝激酶B1(LKB1)缺失将诱导EMT激活剂ZEB1通过激活YAP信号增强EMT效应,促进肝细胞癌(HCC)侵袭[47]。也有学者指出CAV1通过抑制YAP和14-3-3蛋白质之间的相互作用来确定YAP的活性,诱导ECM重塑和硬化,增强肿瘤侵袭性[48]。
3.3 TAZ/YAP介导的肿瘤细胞免疫系统失调
YAP和TAZ通过TEAD转录因子与程序化死亡-配体1(PD-L1)启动子结合,从而加强癌细胞中的PD-L1的表达来抑制T细胞功能,通过保护肿瘤细胞免受免疫系统的侵害从而增强肿瘤细胞的存活[49]。有学者通过B16黑色素瘤模型实验发现相比于对照组,在具有调节性T细胞(Treg)特异性YAP缺失的小鼠中,免疫原性较差的肿瘤不能生长,该结果显示出明显增强的促炎性抗肿瘤免疫指标。实验分析表明T细胞中YAP1的缺失在一定程度上削弱了Tregs的抑制功能,同时促进了Th1和Th17的发育,由此可见YAP对Tregs在肿瘤微环境中的积累和抑制功能具有重要作用[50]。Jiao等发现干扰素调节因子(IRF)通过N-末端DNA结合结构域(氨基酸1-191)与含有TEAD结合结构域和串联WW域的YAP的N-末端区域(氨基酸1-290)特异性结合,与YAP和TEAD4形成复合物,导致核保留和YAP活化,并且提出IRF3介导的抗病毒信号传导在病毒感染的病理环境中直接促进YAP活化而加快肿瘤进展的看法[51]。
3.4 TAZ/YAP在肿瘤干细胞中的作用
目前,有研究证实TAZ/YAP在胚胎干细胞(embryonic stem cells,ESCs)的干性维持与调控方面具有重要作用[52-54],其主要与SMAD2/3[53]和OCT4[52]形成复合体,从而参与干细胞的干性维持与调控。在肿瘤细胞中,异常高表达的TAZ/YAP不仅可以维持肿瘤干细胞的自我更新,而且能够赋予非肿瘤干细胞获得干细胞样特性和表型,进而促进肿瘤干细胞样化及其迁移和成瘤[55]。有学者指出TAZ/YAP与肿瘤相关成纤维细胞(CAFs)的促肿瘤作用有关:一方面,当肿瘤细胞表达整合素等机械感受器以提高ECM刚度敏感性时,粘附复合物激活Rho GTP酶进行细胞骨架再生。该过程通过ECM的增殖,转移,存活等刺激TAZ/YAP产生肿瘤干细胞(CSC)。另一方面,ECM刚度的增加激活CAFs内的YAP,YAP反馈增加ECM的刚度,CAFs直接将机械张力传递给肿瘤细胞以促进侵袭[56]。而在恶性周围神经鞘肿瘤(MPNST)研究中,TAZ/YAP通过上调祖细胞/干细胞基因特征,诱导Schwann细胞(SCs)过度增殖分化为干细胞/祖细胞样细胞,从而加强了SCs中的去分化过程,以保持良性细胞对肿瘤干细胞的TAZ/YAP重编程,促进恶性肿瘤发生[57]。
另外,有研究指出SYMPO2-LATS2-YAP通路与肿瘤的早期转移复发有关,SYNPO2通过稳定LATS2蛋白抑制YAP和TAZ的活性[58]。YAP和TAZ还可以通过影响转移部位的其他细胞类型来增强播散的肿瘤细胞(DTC)的存活和增殖,而YAP的活性能影响转移灶的大小[58-59]。
有趣的是,最近有研究发现TAZ/YAP的激活可以抑制肿瘤细胞的转移,所以TAZ/YAP活化可能并不在所有癌症发展中都能导致肿瘤形成与转移,大多数情况需要与其他诱导肿瘤的刺激相互作用才能致癌[60]。另外通过下调YAP表达,使得与YAP过度活化有关的肝肿瘤消退,可见TAZ/YAP过度活化产生的细胞增生和细胞去分化表型是可逆的[36]。
3.5 TAZ/YAP参与能量代谢诱导肿瘤代谢重编程
现有研究证明TAZ/YAP参与调控糖代谢、脂肪酸代谢、甲羟戊酸代谢。TAZ/YAP和糖酵解之间存在正反馈关系,TAZ/YAP通过增强糖酵解以促进肿瘤发生发展,糖酵解通过促进关键糖酵解酶(如PFK1)的表达来活化TAZ/YAP。在乳腺癌研究中,糖酵解副产物甲基乙二醛(MG)诱导Hsp90的翻译后糖基化,使LATS1/2蛋白的稳定性降低,LATS1/2激酶被降解,从而促进YAP的核定位,增强转录活性,导致癌细胞的生长和转移[61]。在脂代谢方面,有研究证明YAP转录活性的机械调节(由基质力学下游的细胞扩散介导的)可将肿瘤细胞转化为非增殖性脂肪细胞从而阻止肿瘤细胞增殖,促进其脂肪转化[62]。通过激活致癌蛋白RAS、Rho和TAZ/YAP,甲戊酸途径活性被激活,突变型p53通过维持甲羟戊酸中的SREBP表达来促进YAP / TAZ活性并导致癌细胞恶性肿瘤[61,63]。
4 TAZ/YAP在HNSCC中的研究进展
由于目前HNSCC的发病率有多元恶化的趋势,对于HNSCC的研究也逐渐成为热点,就Hippo-TAZ/YAP信号通路在头颈肿瘤的发生发展中的机制与效应也愈来愈受到研究者的关注。在最近一项包含HNSCC在内的9000多个肿瘤的研究中,Hippo-YAP通路被确定为主要致癌信号通路之一,构成Hippo-YAP通路细胞质复合物的激酶被认为是肿瘤抑制因子,而核效应器转录模块的成分为癌基因,其中,YAP与TP53家族蛋白的相关研究一直是YAP研究的一个比较重要的方向,YAP可以与一些p53家族成员相互作用,特别是与转录因子p73相互作用,增强p73依赖性促凋亡基因在DNA损伤中的转录[21]。在头颈鳞癌研究的背景下,Reza等人证明在HNSCC中,ΔNp63(p63异构体)可以通过与YAP启动子区的结合抑制YAP基因的表达,从而抑制HNSCC细胞的增殖、迁移并增强对化疗药物顺铂的敏感性[64];Srinivas等研究发现ACTL6A与p63形成物理性结合后,激活Hippo-YAP信号通路,促进HNSCC细胞的增殖抑制其分化,且ACTL6A与YAP的异常高表达与HNSCC患者不良预后密切相关[65];Lorena等最近的研究发现,YAP 与mut-p53和TEADs(主要是TEAD1)形成复合体不仅可以直接转录激活circPVT1的表达,还可以在转录后水平上调控其表达,主要表现为YAP与circPVT1直接结合参与形成成熟环形RNA的过程,敲低YAP/mut-p53/TEADs都会导致在HNSCC中新生circPVT1表达降低,从而抑制HNSCC细胞相关恶性表型[66]。
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是HNSCC中发病率较高,预后较差,也最受研究者关注的一种肿瘤。研究发现,TAZ蛋白在OSCC可通过呈现异常高表达,高表达的TAZ与肿瘤的大小、病理学分级、淋巴结转移等临床病理参数密切相关[67]。Li等对OSCC的研究也得出了相同的结论,进一步在分子调控机制层面揭示了TAZ通过与TEADs的结合参与调控口腔鳞癌细胞的增值、侵袭转移、EMT及肿瘤干细胞的干性维持过程,并证实TAZ可作为口腔鳞癌诊断的生物学标记及潜在的治疗靶点[68]。Samantha等研究发现:YAP在OSCC早期病损组织细胞核内异常聚集,从而促进OSCC的发生发展;体内外实验证实TAZ/YAP促进OSCC细胞增值、迁移、体内肿瘤的生长和肺转移;全基因组测序分析证明TAZ/YAP在OSCC生物学功能调控过程中具有核心调控作用[69]。
值得一提的是,化合物辛伐他汀可通过抑制TAZ及其同源物YAP入核从而抑制OSCC细胞的增殖、侵袭迁移、肿瘤生长并诱导凋亡等,产生强大的肿瘤抑制效果,这也填补了在头颈肿瘤领域此类研究的空白,揭示了他汀类药物在头颈肿瘤的治疗中可能是一种极富潜力且低毒性的靶向药物[68]。这为进一步探讨其他小分子化合物靶向抑制HNSCC中TAZ/YAP的表达从而达到抗肿瘤效应提供依据和参考价值。
5 展望
头颈部鳞状细胞癌的研究中Hippo-TAZ/YAP信号通路已经显示了较好的研究前景,但是目前相对于TAZ/YAP研究仍相对较少。其次,对靶向针对Hippo通路小分子抑制剂在头颈鳞癌的中发挥的作用及其机制的相关研究开展不多,仍有很多待发掘的空间。随着研究的深入,Hippo-TAZ/YAP信号通路在头颈鳞癌中的调控机制定能为广大研究者所熟知,其极有可能成为HNSCC治疗的潜在靶点。
