桃MPK3基因的克隆、表达及生物信息学分析
2020-03-17冀美玲张泽杰高东升
程 宁 冀美玲 张泽杰 李 玲 高东升
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东 泰安 271018)
近年来,随着设施果树栽培的迅猛发展,桃树已成为保护地栽培的主要树种之一,其栽培面积不断扩大。温带落叶果树存在休眠机制,在此期间完成营养物质贮藏以及花芽的进一步分化,从而抵御冬季不适宜生长的环境[1-2]。采取适当措施提早打破休眠,促进果树开花结果,已成为当前设施果树栽培的一项关键技术[3]。芽休眠受到外部环境、基因等多种因素的调控,涉及一系列的植物内部生理生化的动态变化以及信号转导[4]。目前已有关于苹果[5-6]、梨[7-8]、葡萄[9]、桃[3,10-11]等树种芽休眠的相关研究报道,且不同树种之间的休眠机理可能存在差异。
研究表明,无论是自然休眠还是环境调控引起的休眠,均是通过影响激素的合成和运输来调控休眠的[12]。激素是植物大部分生命活动的重要调控因子,休眠进程也受激素水平的影响,与芽休眠关系最密切的激素是脱落酸(abscisic acid,ABA),其次是赤霉素(gibberellin,GA),ABA 能够抑制芽萌发,GA 能够促进芽生长,芽生长促进物质与萌发抑制物质的动态平衡决定了果树芽的自然休眠状态[2]。段成国等[1]研究表明,ABA 作为调控种子休眠、芽休眠的重要植物激素,其在花芽组织内的含量变化决定着休眠进程。
前人研究表明,在二穗短柄草[13]、辣椒[14]、烟草[15]、拟南芥[16]等物种的MAPK级联反应途径激酶基因启动子序列中存在大量的胁迫应答元件和激素应答元件,能够响应激素信号,并通过激素应答非生物胁迫。经证实,MAPK级联途径由3种蛋白激酶组成:MAPK 激酶之激酶(mitogen activated protein kinase kinase kinase,MAPKKK/MEKK)、MAPK 激酶(mitogen activated protein kinase kinase,MAPKK/MKK)以及丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK/MPK)[17]。
目前关于MAPKs基因的研究主要集中在非生物胁迫信号传递[18]、植物激素响应以及信号转导[19-20]、活性氧[21]等方面,而鲜见关于休眠的研究。本试验拟通过生物信息学分析、亚细胞定位以及实时荧光定量等方法研究MPK3对激素调控的响应以及在芽休眠解除过程中的表达模式,以期为进一步探明MPK3 在植物休眠中作用机理奠定理论基础。
1 材料与方法
1.1 试验材料
以种植于山东农业大学温室大棚内的中油四号油桃(Prunus persicavar.nectarinaMaximZhongyousihao)为试验材料。
1.2 试验方法
1.2.1 处理枝条 2017年11月中旬,采用随机取样的方法获得一年生枝条100 根,预培养1 d(清水,温度为24.5℃,光照强度为40 μmol·m-2·s-1,光周期为光照12 h/黑暗12 h,相对空气湿度为80%)。处理组:0.5%Trtion 100+125 mg·L-1GA3溶液水培;空白对照(CK):0.5% Trtion 100 溶液水培。分别在处理0.5、1、3、5、7 d时随机采集花芽,立即用液氮速冻,-80℃保存备用。
1.2.2 采集花芽和叶芽 从2017年12月10日扣棚(休眠解除期开始)至2018年2月7号开花(休眠解除),根据天气情况每隔15 d 左右,随机采集花芽和叶芽,立即用液氮速冻,-80℃保存备用。
1.2.3 生物信息学分析 利用Plantcare 在线软件进行启动子分析;利用GSDS 在线软件进行内含子分析;采用DNAstar软件对序列进行开放阅读框查询并预测氨基酸序列;利用在线软件ProtParam 计算蛋白质分子质量和等电点;利用在线软件Signal P 进行蛋白信号肽预测;利用NetPhos 2.0 Server和DictyOGlyc 1.1 Server软件预测蛋白质修饰方式[22];利用在线软件SOPMA 预测蛋白质二级结构[22];利用NCBI 数据库中BLAST 进行同源蛋白基因的检索;利用DNAMAN软件进行同源蛋白序列的比对;利用MEGA5.0软件中的邻接法(Neighbor-Joining)构建系统进化树。
1.2.4 总RNA的提取及实时荧光定量表达 根据桃基因组公布的MPK3 CDS 序列设计特异性引物(表1),PCR 扩增的模板为桃花芽cDNA。分别将样品在液氮中充分研磨,参照冀美玲等[23]的方法,提取总RNA、反转录合成cDNA;根据杜培勇等[24]的方法设计荧光定量引物(表1)、进行实时荧光定量PCR,最后采用2-ΔΔCT[24]进行定 量数据分析,利 用GraphPad Prism 6 整理数据并制图[25]。

表1 所用引物信息Table1 Information of primer sequences
1.2.5 亚细胞定位 亚细胞定位参照万千等[26]的方法,将携PpMPK3-GFP 融合蛋白表达载体的农杆菌GV3101 渗透培养液注射到烟草叶片中,48 h后撕取下表皮细胞,用DAPI(4′,6-二脒基-2-苯基吲哚,4′,6-diamidino-2-phenylindole)对细胞核进行染色、压片,通过ZEISS 超高分辨率激光共聚焦显微镜(Carl Zeiss Jena,德国)观察绿色荧光蛋白信号。

图1 GA 处理后芽的形态Fig.1 The morphology of the buds after GA treatment
2 结果与分析
2.1 MAKPs基因在GA 诱导下的表达分析
由图1可知,与CK相比,中油四号油桃离体枝条外施GA3促进了其休眠解除,其花芽叶芽发育提前,处理7 d后,处理较CK 变化明显,芽发育饱满,体积增大,有明显的萌发迹象。
由图2可知,枝条外施一定浓度GA后,随着处理时间的增加,芽中PpMPK1、PpMPK2、PpMPK3、PpMPK7、PpMPK9、PpMPK11、PpMPK14、PpMPK15的相对表达量均呈增加的趋势,PpMPK9和PpMPK3 有相似的表达规律,分别比处理初期增长约10倍和30倍,特别是PpMPK3表达上调幅度最高,远高于其他基因,表明后期试验可以PpMPK3为切入点;PpMPK12的相对表达量有所下降,PpMPK5、PpMPK15 相对表达量整体变化不明显。由图3可知,清水培养枝条的花芽中的PpMPK3的相对表达量在7 d 内无显著变化。推断外施GA3可促进休眠解除期芽内PpMPK3的表达,提高PpMPK3的表达量,表现为正调控。

图2 GA 处理后芽内MAPKs基因的相对表达量Fig.2 Relative expression levels of MAPKs in the buds after GA treatment

图3 空百对照组芽内PpMAPK3基因的相对表达量Fig.3 Relative expression of PpMAPK3 in the buds of blank control group
2.2 PpMPK3基因全长cDNA 克隆与基因结构分析
以中油四号油桃油桃花芽cDNA为模板,利用特异性引物扩增出目的基因片段,通过胶回收,测序结果片段长度为1 113 bp,与目的基因一致,命名为PpMPK3(基因登录号:XP_007205387.1)(图4)。

图4 桃PpMPK3基因的克隆Fig.4 Cloning of PpMPK3 gene in peach
对PpMPK3 进行启动子预测,结果显示,PpMPK3的启动子内不仅包含CAAT-BOX和TATA-BOX 等启动子必需的核心元件,还包含很多与胁迫相关的顺式作用元件,如ABRE、LTR、MYB、WRE3 等,其中包括与赤霉素调控有关的GARE-motif。通过对PpMPK3 启动子的序列分析,推测PpMPK3的启动子可能是1个受赤霉素调控的启动子。通过内含子分析发现,PpMPK3 有5个内含子,长度分别为97、245、120、223、120 bp,5′-UTR 长度为170 bp,3′-UTR 长度为438 bp(图5),其编码370个氨基酸,组成蛋白质分子量约为42.6 kD,理论等电点为5.62,原子总数为5 975,不稳定指数为41.58,亲水性系数为-0.310,表明其属于不稳定亲水性蛋白。
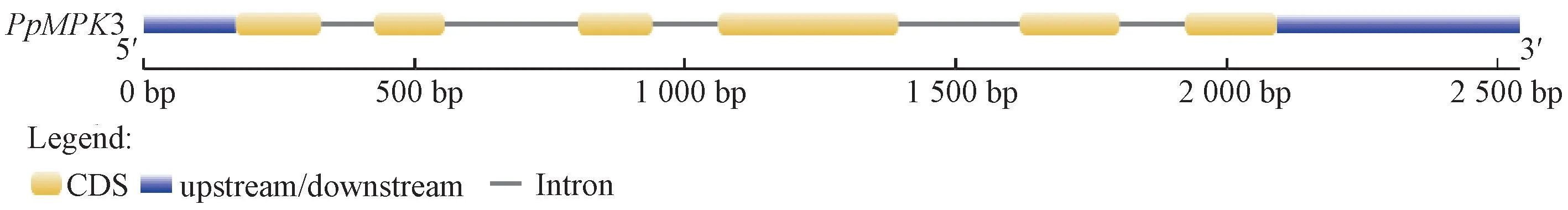
图5 PpMPK3的基因结构分析Fig.5 Genetic structure analysis of PpMPK3 gene
2.3 PpMPK3 蛋白的生物活性分析与结构预测
磷酸化和糖基化是蛋白质常见的修饰方式。通过NetPhos 2.0 Server软件预测发现PpMPK3 蛋白发生磷酸化修饰的位点有45个。其中,丝氨酸、苏氨酸和酪氨酸的磷酸化位点数量均为15个。磷酸化位点分布大致分为5个部分,分别是0~60、110~160、180~230、250~270和300~350 bp(图6)。利用DictyOGlyc 1.1 Server软件预测发现,PpMPK3 蛋白不存在糖基化位点(图7)。
PpMPK3 蛋白信号肽的预测结果显示,该蛋白的Y值为69,C值为22,二者数值均不高,且分值曲线不典型,预测该蛋白不存在信号肽。PpMPK3 蛋白的二级结构预测结果显示,该蛋白由α-螺旋、无规则卷曲和延伸链组成,其中α-螺旋占41.35%,延伸链占10.54%,无规则卷曲占48.11%。
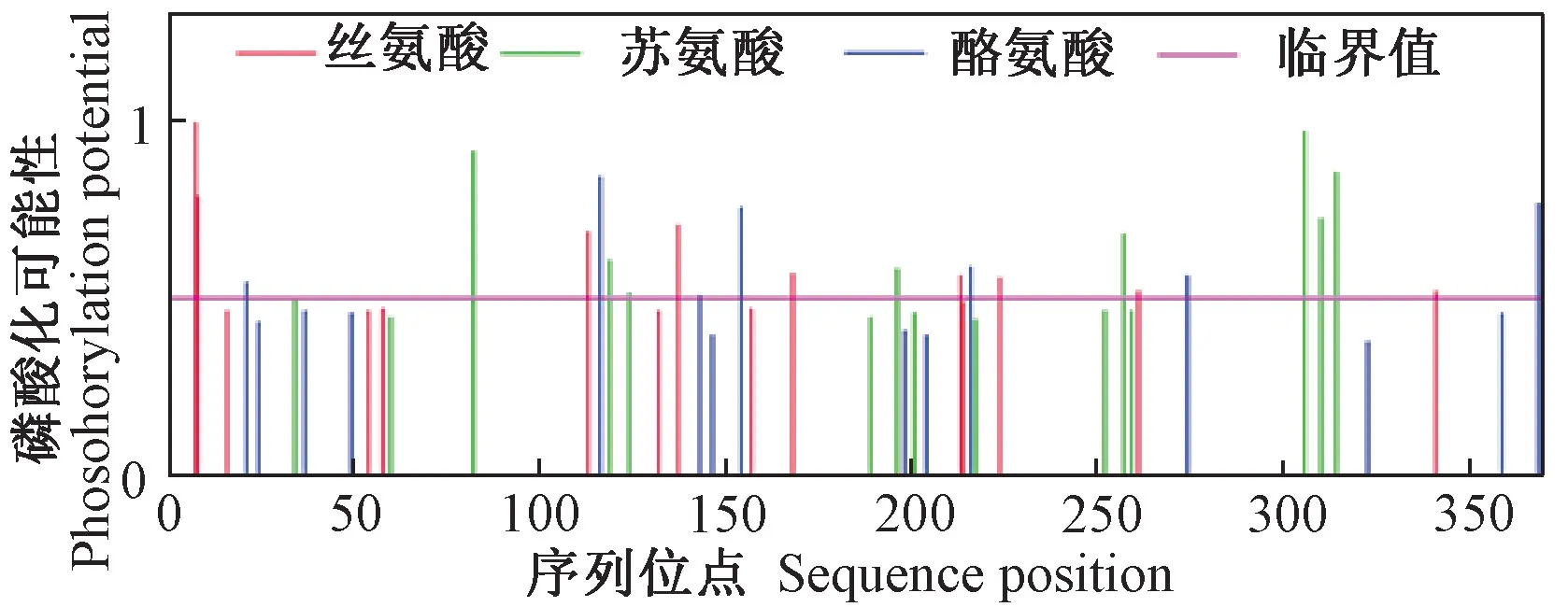
图6 桃PpMPK3 蛋白氨基酸翻译后磷酸化修饰位点预测Fig.6 Prediction of phosphorylation site after amino acid translation of peach PpMPK3 protein
2.4 PpMPK3 同源序列比对和进化树分析
图7 PpMPK3 蛋白氨基酸翻译后O-糖基化修饰位点预测Fig.7 Prediction of O-glycosylation site modification in amino acid sequences of PpMPK3 protein
利用NCBI BLAST 检索PpMPK3的氨基酸同源序列,在DNAMAN软件上进行氨基酸同源性比对。由图8可知,桃PpMPK3与甜樱桃(Prunus avium,XP _021809182.1)、苹果 (Malus domestica,XP _008385257.1)、可可(Theobroma cacao,EOY34273.1)、陆地棉(Gossypium hirsutum,NP_001314498.1)、白桦(Betula platyphylla,AHY02158.1)、黄瓜(Cucumis sativus,NP_001267653.1)、胡杨(Populus euphratica,XP_011025025.1)、拟南芥(Arabidopsis thaliana,NP_190150.1)、番 茄 (Solanum lycopersicum,NP _001234360.1) MPK3 氨基酸序列相似性分别为99.73%、95.95%、89.87%、89.33%、88.03%、87.60%、86.49%、83.78%、83.65%。
比较不同物种间的亲缘关系发现(图9),PpMPK3蛋白与甜樱桃(Prunus avium,XP_021809182.1)和苹果(Malus domestica,XP_008385257.1)聚为一类,亲缘关系最近;与拟南芥(Arabidopsis thaliana,NP _190150.1)、欧洲油菜(Brassica napus,NP _001303218.1)、萝卜(Raphanus sativus,XP _018436502.1)的亲缘关系次之,与白桦(Betula platyphylla,AHY02158.1)、可可(Theobroma cacao,EOY34273.1)、陆地棉(Gossypium hirsutum,NP _001314498.1)等亲缘关系较远。
2.5 亚细胞定位
为确认MAPK基因在细胞中表达的位置,将GFP与PpMPK3 融合后,进行烟草瞬时表达,利用DAPI对下表皮细胞染色,压片,使用ZEISS 超高分辨率激光共聚焦显微镜观测,发现细胞核是PpMPK3 主要的分布位置(图10)。
2.6 休眠解除过程中PpMPK3的表达分析
由图11可知,2017年12月10日(休眠解除开始)至2018年2月7日(开花)期间,叶芽中PpMPK3的相对表达量总体呈先升高后降低的趋势,2018年1月27日叶芽中PpMPK3的表达量大约是2017年12月10日的5.6倍。此期间,花芽中PpMPK3的相对表达量也呈先升高后降低的趋势,2018年1月16日(花芽休眠解除)PpMPK3 相对表达量达到最高,为2017年12月10日的4.39倍,之后PpMPK3的相对表达量开始下降,逐渐恢复到初始水平。花芽和叶芽中PpMPK3 相对表达量变化与休眠解除过程保持一致,相对表达量最高的时期在花芽和叶芽中有所不同,叶芽中PpMPK3 相对表达量在1月27日达到最高,比花芽中的最高表达推迟了11 d,同样符合桃先开花后长叶的自然生长规律,由此判断,PpMPK3基因参与了调控花芽和叶芽的休眠解除。
3 讨论
在植物中,MAPK级联途径几乎参与了植物全部的生长发育过程,在MAPK 信号转导过程中发挥着枢纽作用。研究表明,桃MAPKs与休眠进程有关。处于休眠状态的芽能够萌发是因为生长促进物质(如GA)克服了生长抑制物质的抑制作用,从而解除了休眠[1]。由此推测,桃MAPKs可能通过响应激素信号来影响休眠。在桃[3,27]、樱桃[1]、香椿[28]、平贝母[29]、芸薹属[30]、云南重楼[31]等植物中,植物休眠解除进程与植物体内GA含量的变化密切相关,在休眠解除期GA含量急剧升高,休眠解除后,GA含量又恢复到正常水平。本研究结果表明,GA 处理的中油四号离体枝条的芽发育饱满,发育成熟度高,体积也显著增加;且GA 处理后,MPK3表达上调,其中GA 处理后的枝条中MPK3 在5~7 d时,表达量急剧增高,7 d时达到最高峰,最终相对表达量是处理前的30倍。MPK3 相对表达量伴随GA 处理急剧增高,说明MPK3 能够响应GA 正调控,与前人研究一致。
本研究还发现中油四号在2017年10月15 至12月1日处于深休眠期;2017年12月15日芽体已经进入休眠解除期;2018年1月15日左右休眠解除;深休眠期间GA 在芽中含量稳定,在休眠解除过程中,GA含量迅速上升。花芽和叶芽中的MPK3 在休眠解除期的表达均呈先升高后降低的趋势,叶芽中MPK3的表达与花芽中的变化过程相似,但时间点具有滞后性,迅速增长期和最高峰较花芽晚13 d,出现在2018年1月27日。花芽和叶芽中MPK3的表达与休眠解除期的进程保持一致,同时也符合桃树先开花后长叶的生长特点。
4 结论

图8 桃PpMPK3与不同物种中的MAPK 成员的蛋白质序列对比Fig.8 The protein sequences of peach PpMPK3 compared with MAPK members in different species
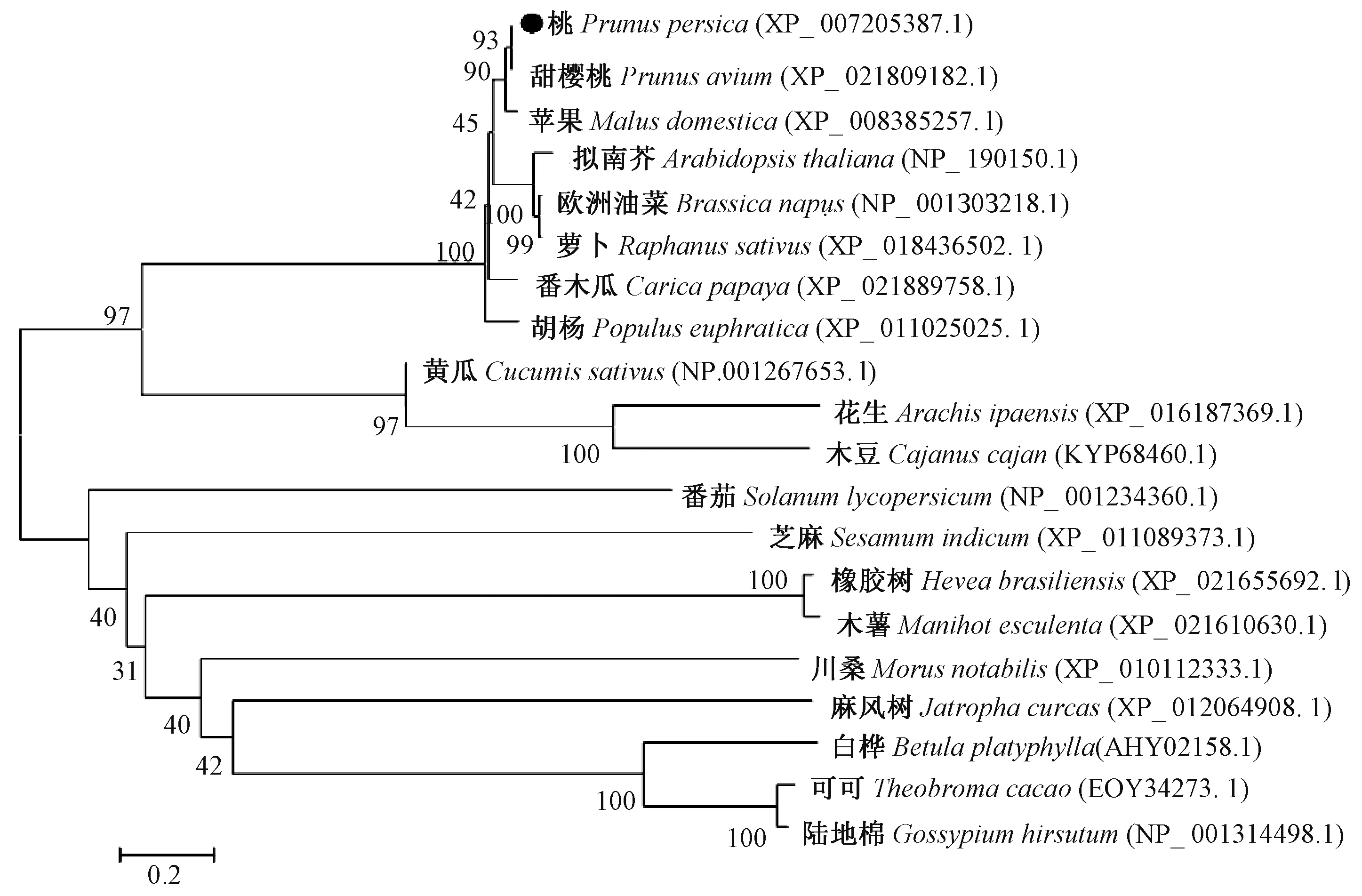
图9 桃PpMPK3与其他物种PpMPK3 蛋白的系统进化树Fig.9 Phylogenetic tree of PpMPK3 proteins in peach and other species
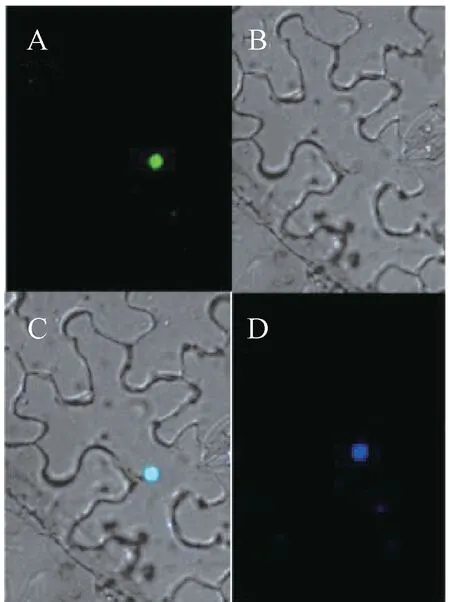
图10 PpMPK3 蛋白在烟草下表皮细胞中的定位Fig.10 Subcellular localization of PpMPK3 protein in nico-tianabenthamiana lower epidermal cell

图11 PpMPK3基因在叶芽(A)和花芽(B)中的表达分析Fig.11 Expression analysis of PpMPK3 gene in leaf bud (A) and flower bud (B)
本研究从中油四号材料中提取到cDNA,克隆得到了桃MPK3基因,通过生物信息学分析和荧光定量表达分析证明,桃芽能响应GA 信号,提高休眠解除期芽内MPK3的表达量,进而促进休眠解除,进一步验证了前人观点。本研究结果为PpMPK3 蛋白结构分析和功能鉴定提供了一定的理论依据。今后可从MPK3如何响应GA 信号以及种子内MPK3的表达模式等方面开展更深入的研究。
