铁皮石斛PRC2复合体成员的鉴定及对胁迫响应的表达分析
2020-03-17仇汉林屈东海陈东红朱玉球斯金平
仇汉林 屈东海 陈东红 朱玉球 斯金平
(1浙江农林大学/省部共建亚热带森林培育国家重点实验室/国家林业局铁皮石斛工程技术研究中心,浙江临安 311300;2 湖南农业大学生物科学技术学院,湖南长沙 410128)
铁皮石斛(Dendrobium catenatum)为多年生附生兰科植物,是一味历代皇室贵族、医家及医学典籍所推崇的传统名贵中药,位列“中华九大仙草之首”。现代药理研究进一步证明铁皮石斛具有益胃生津、滋阴清热、增强免疫力、抗肿瘤等独特功效[1]。近二十年来,在组培快繁和栽培模式等关键技术突破和大力推广下,铁皮石斛已走向平民化,成为大宗药材,相关行业产值达百亿[2],但同时也遭遇了新的发展瓶颈。培育铁皮石斛优良品种是在根本上克服该瓶颈的关键,目前育种的方向主要集中在高产、优质、抗逆等方面,以及多个优良性状的聚合。
多梳类(polycomb group,PcG)蛋白最先发现于果蝇中,可以通过表观沉默同源异型基因来调控体节发育[3]。PcG 蛋白在动植物进化中保守存在,主要构成PRC1(polycomb repressive complex 1)和PRC2 两类复合体[4-7]。果蝇PRC2 核心成员主要由Enhancer of zeste[E(z)]、Extra sex combs(ESC)、Suppressor of zeste[Su(z)12]和p55 四个亚基构成;对应的,拟南芥中有三个E(z)同源基因CURLY LEAF(CLF)、SWINGER(SWN)、MEDEA(MEA),三个Su(z) 12 成 员FERTILISATION INDEPENDENT SEED2 (FIS2)、EMBRYONIC FLOWER2(EMF2)、VERNALIZATION2(VRN2),一个ESC成 员FERTILIZATION INDEPENDENT ENDOSPERM(FIE)和一个p55 成员MULTICOPY SUPPRESSOR OF IRA1(MSI1)。它们可以搭配形成不同的PRC2复合体在植物发育的不同时相行使特定的功能,如EMF复合体(CLF/SWN-EMF2-FIE-MSI1)可以抑制营养到生殖发育的提前转变,并参与维持细胞处于分化状态;VRN复合体(CLF/SWNVRN2-FIE-MSI1)参与春化后FLC的表观沉默并促使开花;FIS复合体(MEA-SWN-FIS2-FIE-MSI1)对种子正常发育是必需的,可以阻止种子在未受精状态下发育[8-11]。其中,PRC2的催化亚基CLF、SWN、MEA 属于SET 结构域蛋白(SET domain group)[12],负责催化组蛋白抑制标记H3K27me3 在靶基因座位的沉积并介导基因沉默[13]。且H3K27me3 抑制标记与脱水应激记忆、冷胁迫应答以及病原菌抗性等现象密切相关[14-15]。为了调查PRC2复合体在铁皮石斛发育和胁迫应答中的功能,本研究鉴定了铁皮石斛PRC2的核心成员,系统分析了它们之间的互作保守性、组织器官表达谱以及对外界环境胁迫和病害胁迫的响应情况,有助于进一步研究铁皮石斛的生长发育和胁迫响应机制,并为应用于分子辅助育种提供候选基因。
1 材料与方法
1.1 试验材料
供试铁皮石斛(Dendrobium catenatum)材料保存于浙江农林大学国家重点实验室药用植物遗传育种团队组培室,培养温度为25℃,光照时间为16 h·d-1。对于组织表达分析,根、茎、叶部位取自8月龄幼苗,花蕾和成花取自处于花期的2年生成株。对于胁迫处理,选取发育良好且生长一致的8月龄幼苗进行试验。
1.2 铁皮石斛PRC2 核心成员的系统进化分析
在NCBI 数据库(https:/ /www.ncbi.nlm.nih.gov/)利用果蝇和拟南芥PRC2 核心成员通过BLAST 工具搜索铁皮石斛基因组,获得铁皮石斛PRC2 同源基因。将铁皮石斛PRC2 核心成员的氨基酸序列和拟南芥、水稻、果蝇的PRC2 成员一起采用MEGA7 构建系统进化树[16]。参数设置:使用Neighbor-Joining的No.of differences 模型构建,选择部分删除(partial deletion)空位(gap)的选项,Bootstrap method 取值1 000。
1.3 铁皮石斛总RNA的提取及cDNA 第一链的合成
利用改良CTAB提取铁皮石斛总RNA[17],用840 - 210800 紫外分光光度计(Thermo Fisher Scientific,美国)检验提取的总RNA 纯度和浓度,用1%琼脂糖凝胶电泳检测RNA的完整性。利用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(TaKaRa,北京)对铁皮石斛总RNA 进行反转录合成cDNA 第一链,-20℃保存备用。
1.4 铁皮石斛PRC2 成员的基因克隆
采用Primer Premier 5.0 设计铁皮石斛DcCLF、DcSWN、DcFIE、DcMSI1、DcEMF2的荧光定量PCR 引物和全长序列引物以及多梳蛋白DcLHP1的全长引物(表1)。以上述cDNA 第一链为模板进行PCR 扩增,反应体系(25 μL)包括10×Buffer 2.5 μL、2 mmol·L-1dNTPs 2.5 μL、25 mmol·L-1MgSO41 μL、KOD+0.5 μL、ddH2O 16 μL、10 μmol·L-1Primer-F 0.75 μL、10 μmol·L-1Primer-R 0.75 μL及cDNA 1 μL (日 本TOYOBO)。PCR 扩增产物经1%琼脂糖凝胶电泳检测后,利用DNA 凝胶回收试剂盒(TaKaRa,北京)回收目的片段,连接到pEASY-Blunt 克隆载体(TransGen Biotech)后转化大肠杆菌DH5α,菌落PCR和质粒酶切鉴定后的单克隆送至生工生物工程(上海)股份有限公司进行测序验证。
1.5 酵母双杂载体的构建及酵母转化
构建基因克隆载体(pEASY-DcCLF、-DcSWN、-DcFIE、-DcMSI1、-DcEMF2及-DcLHP1),根据预先设定在基因两端的酶切位点进行双酶切,定向克隆到同样双酶切的酵母双杂空载体pGADT7x和pGBKT7x。经常规的酶切-连接法,构建含有铁皮石斛PRC2 成员的酵母双杂载体。将分别装入pGADT7x和pGBKT7x的PRC2基因酵母双杂载体进行两两组合,根据文献[18]的方法共转化到酵母菌株AH109中,最后涂布于SD-LT 二缺平板上,30℃倒置培养2~3 d。将在二缺平板上生长出来的酵母单克隆转移到SD-LTHA 四缺平板上,同时转移一份到二缺平板上作为对照,30℃培养3~4 d 观察酵母互作情况。
1.6 胁迫处理
选取生长良好且长势一致的铁皮石斛幼苗进行以下处理,取处理的幼苗叶片提取RNA。非生物胁迫处理[19]:1)低温处理:将幼苗置于低温培养箱中4℃处理0、2、6、12 h;2)高温处理:将铁皮幼苗置于恒温培养箱40℃(其他条件与组培室条件保持一致),分别培养0、2、6、12 h;3)脱水处理:将幼苗置于恒温培养箱25℃(其他条件与组培室条件一致),分别培养0、2、6、12 h。生物胁迫处理:分别从齐整小核菌(Sclerotium rolfsii)和灰葡萄孢霉菌(Botrytis cinerea)平板上打取10个5 mm 菌饼,接种于200 mL PDA 培养液中,150 r·min-1、28℃培养100 h,分别用齐整小核菌(试验组1)和灰葡萄孢霉菌(试验组2)发酵液喷施铁皮石斛幼苗,然后置于30℃恒温培养箱中培养0、2、6、12 h。以喷施无菌水的幼苗为对照。

表1 本研究所用引物对序列Table1 Primer pairs used in this study
1.7 半定量PCR和实时荧光定量PCR(RT-qPCR)
提取上述不同处理的铁皮石斛总RNA,利用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(TaKaRa,北京)试剂盒进行反转录合成cDNA 第一链。根据荧光定量PCR 引物的设计原则,设计荧光定量PCR 特异性定量引物,并以EF1a基因为内参(表1)。半定量PCR的总反应体系(20 μL):2×Taq MasterMix(Dye)10 μL、Primer-F 0.8 μL、Prime-R 0.8 μL、cDNA 1.3 μL,ddH2O 补足至20 μL。
荧光定量PCR 试验参照SYBR © Premix Ex TaqTMⅡ(Tli RNaseH Plus) (TaKaRa,北京)试剂盒的说明书,反应在CFX96TMReal-Time System 实时定量PCR 仪(Bio-Rad,美国) 上完成。总反应体系(10 μL):SYBR Premix Ex Taq Ⅱ5 μL、Primer-F 0.4 μL、Primer-R 0.4 μL、cDNA 0.5 μL,ddH2O 补足至10 μL,每个样品重复3 次。扩增程序:95℃预变性30 s,95℃变性5 s,60℃退火20 s,72℃延伸20 s,共40个循环,每次循环中的第3 步进行荧光的采集,最后95℃变性1 min,退火至65℃,保温5 s后以0.5℃·s-1的速度上升至95℃,在此期间连续检测荧光值并且绘制溶解曲线。利用GraphPad Prism 5.0软件对试验数据进行制图与分析[20]。
2 结果与分析
2.1 铁皮石斛PRC2复合体核心成员的筛选与鉴定
利用果蝇和拟南芥PRC2 核心成员在NCBI 网站进行同源搜索,筛选出铁皮石斛PRC2 成员(表2)。随后分别以果蝇PRC2 成员为外类群,用双子叶模式植物拟南芥和单子叶模式植物水稻PRC2 成员为参照,通过系统进化分析(图1),最终确定铁皮石斛PRC2 核心成员。在E(z)组,铁皮石斛有DcCLF和DcSWN 2个成员,分别聚类到CLF和SWN 进化支,与水稻中的一致;缺少拟南芥的MEA 支。在Su(z)12组,铁皮石斛仅有1个成员DcEMF2,而水稻中有2个成员,拟南芥中有3个。在ESC 组,铁皮石斛和拟南芥一样,仅有1个成员,而水稻中有2个。在p55 组,铁皮石斛有4个同源基因,水稻有3个,拟南芥有5个,但关于拟南芥的研究表明,仅MSI1 确定为PRC2的成员,而铁皮石斛和水稻仅有1个成员与MSI1 聚在一起,由此推测铁皮石斛和水稻中也仅有一个p55 成员。因此,铁皮石斛PRC2复合体在核心成员构成上是基本保守的,但在进化过程中可能由于基因的复制或丢失导致不同亚基成员的数量存在变动。

表2 铁皮石斛PRC2 核心成员的筛选和分类Table2 Screening and classification of D.catenatum PRC2 core subunits
2.2 铁皮石斛PRC2 核心成员间的互作分析
基于NCBI 网站存储的铁皮石斛基因组序列,设计铁皮石斛PRC2 核心成员及相关因子DcLHP1的全长引物(表1),以铁皮石斛幼苗cDNA为模板进行扩增,成功克隆到DcCLF、DcSWN、DcEMF2、DcFIE、DcMSI1及DcLHP1基因,并利用pGADT7x和pGBKT7x 质粒构建了一批酵母双杂载体。
为了检测PRC2复合体在铁皮石斛中的互作保守性,通过酵母双杂试验来分析铁皮石斛PRC2 成员之间的互作关系。将pGBKT7x 空载、pGBKT7x-DcCLF、-DcMSI1 分别与pGADT7x 空载、pGADT7x-DcSWN、-DcMSI1、-DcFIE、-DcEMF2、-DcLHP1 进行两两组合,共转化酵母菌株AH109。由图2可知,经双质粒共转化的AH109 酵母细胞在SD-LT 二缺平板上能生长,说明共转化成功。将这些酵母细胞转移到SD-LTHA四缺选择培养基上,观察到pGBKT7x-DcCLF与pGADT7x-DcMSI1,pGBKT7x-DcMSI1与pGADT7x-DcLHP1、-DcFIE、-DcMSI1的组合可以生长,说明它们之间存在互作关系,这大体上与模式植物拟南芥PRC2的报道一致,进一步支持了PRC2复合体在进化中的保守性。
2.3 铁皮石斛PRC2 核心成员的组织器官表达谱
以持家基因DcEF1a为内参,利用半定量PCR对铁皮石斛PRC2 核心成员在根、茎、叶、花蕾及成花组织中的转录情况进行分析(图3)。结果显示,PRC2 所有亚基的表达均比较广泛,但不同的基因或它们在不同组织器官中表达丰度存在差异。其中,DcSWN和DcMSI1 在所有被检组织中的表达量均较高且一致;DcCLF相对而言在茎中表达最高,其次为根,在叶、花蕾、成花中则低表达;DcEMF2和DcFIE分别在花蕾和成花中高表达,其次为茎,根和叶中表达最低。因此,铁皮石斛PRC2 成员的表达模式基本与在拟南芥和水稻中的一致,在植物不同生长发育过程中发挥重要的功能。
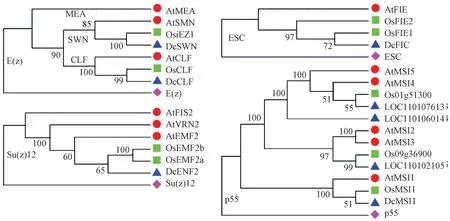
图1 铁皮石斛PRC2复合体核心成员的系统进化分析Fig.1 Phylogenetic analysis of PRC2 core components in D.catenatum

图2 酵母双杂测试铁皮石斛PRC2 成员之间的互作关系Fig.2 The interaction relationship between D.catenatum PRC2 members detected by yeast-2-hybrid system
2.4 铁皮石斛PRC2 核心成员对非生物胁迫的响应
由图4可知,在4℃低温处理下,DcMSI1和DcFIE的表达基本不变;DcEMF2 在处理6 h时表达上调,但在处理12 h时又下调;DcSWN和DcCLF在处理2 h后即受到强烈诱导,随后又下降到正常水平。在高温胁迫下,DcFIE的表达几乎不变;DcMSI1、DcSWN和DcCLF的表达呈现先升高后降低的趋势,且均在处理6 h时表达量达到峰值,在处理12 h时表达量回落至正常水平;DcEMF2的表达则呈现稳步的上调。在脱水胁迫下,DcMSI1和DcEMF2的表达基本不受影响;DcFIE和DcSWN基因在处理前期表达逐步下调,处理12 h时开始上调;DcCLF基因的表达随着处理时间的延长而逐渐增强,处理12 h时达到最高。综上,铁皮石斛PRC2 不同成员对特定的环境胁迫因子具有不同的响应方式。
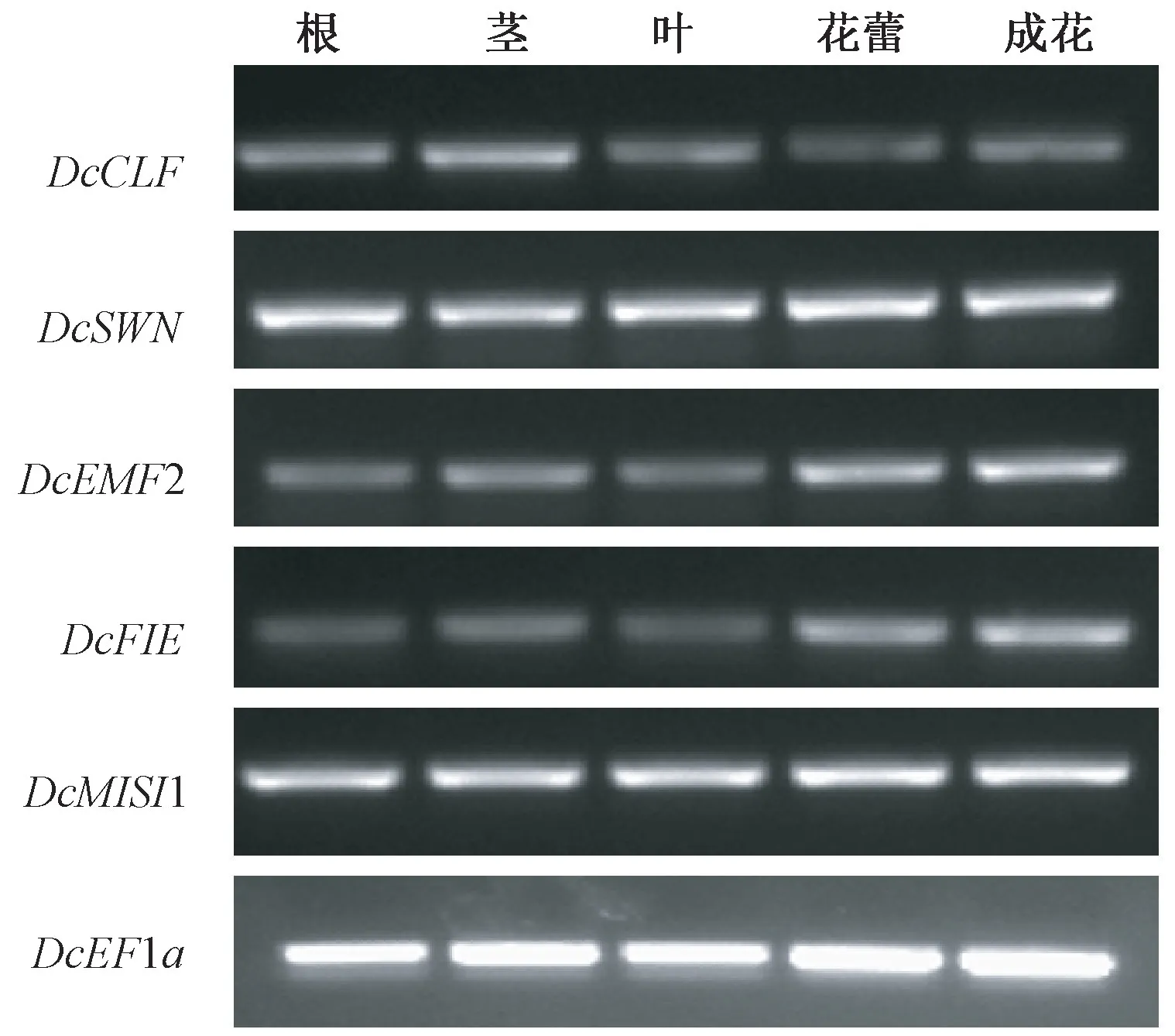
图3 铁皮石斛PRC2 核心成员的组织表达谱Fig.3 Expression profiling of D.catenatum PRC2 core components in different tissues
2.5 铁皮石斛PRC2 核心成员对真菌病害的响应
为了研究生物胁迫下铁皮石斛PRC2 成员的响应情况,选取引起铁皮石斛重要病害的齐整小核菌和灰葡萄孢霉菌作为接种测试材料。由图5可知,齐整小核菌发酵液侵染下,DcFIE和DcSWN的表达受影响不大;DcMSI1 在胁迫12 h时受到强烈诱导,DcEMF2 在胁迫2 h时即上调,随后继续保持高的表达水平;DcCLF的表达在胁迫6 h时有轻微上调,胁迫12 h时又出现下调。灰葡萄孢霉菌发酵液侵染下,DcEMF2的表达相对稳定,DcMSI1和DcFIE的表达随着胁迫时间的延长而逐步受到抑制,DcCLF表现轻微的上调,而DcSWN在接种胁迫2 h时即被强烈诱导且在胁迫6~12 h时一直维持高表达。综上,不同的铁皮石斛PRC2 成员对不同病原菌的响应方式差异明显。

图4 铁皮石斛PRC2基因对环境胁迫的响应Fig.4 Responses of D.catenatum PRC2 genes against environmental stresses

图5 铁皮石斛PRC2基因对病害胁迫的响应Fig.5 Responses of D.catenatum PRC2 genes against pathogen stresses
3 讨论
名贵兰科中药材铁皮石斛作为典型的附生植物,生存条件严苛,且在发育程序上存在诸多独特之处,如粗状肥厚的气生根、多汁的肉质叶、富含多糖等储藏物质的假鳞茎、高度特化的花器官、种子微小,无胚乳,且胚发育不全等[2,21]。而在普通模式植物拟南芥中的研究表明,PRC2 多梳复合体成员除了参与对多种逆境胁迫的响应外,还调控植物组织器官(根、叶、花、胚和胚乳等)的形态建成[8-15],因此对铁皮石斛PRC2复合体的研究有助于揭示其在物种形成中展现的特殊性。在本研究中,系统进化分析表明,铁皮石斛PRC2复合体成员与同属单子叶的水稻成员在进化关系上比较近:在E(z)组均缺少MEA 进化支,在Su(z)12 组均缺乏FIS2和VRN2 进化支;但不同的是,铁皮石斛在Su(z)12 组的EMF2 分支和ESC 组仅有1个成员,而水稻中均为2个。酵母双杂交试验表明,DcMSI1与其自身及DcLHP1、DcFIE、DcCLF 相互作用,这基本与拟南芥中的结果一致[22-23]。但拟南芥MSI1 也可与EMF2[22],CLF与EMF2[24]和FIE[25]存在互作;这可能是因为铁皮石斛独特的器官发育程序需要特定的PRC2 成员组合。半定量PCR 结果表明,铁皮石斛PRC2 核心成员在其根、茎、叶、花蕾和成花中均有不同程度的表达,总体上与拟南芥和水稻中的同源基因表达情况一致。然而,拟南芥MEA和水稻OsFIE1是胚乳印记基因,特异在种子中表达;MEA功能缺失导致中央细胞在未受精状态下发育成胚乳,并形成无胚种子[26];OsFIE1 功能缺陷导致种子小且结实率低,胚发育推迟,糊粉层细胞变小[27]。而铁皮石斛种子退化,失去胚乳发育,需与真菌共生萌发,推测这与铁皮石斛在进化中丢失了种子特异PRC2 成员有关。
铁皮石斛作为附生植物,在野外和仿野生栽培条件下全株近乎完全暴露在空气中,因此铁皮石斛更易遭到不同程度的环境因子胁迫[2]。本研究结果表明,低温和高温威胁下,DcCLF、DcSWN、DcEMF2、DcMSI1的表达呈现先升高后降低的趋势;脱水胁迫下,DcFIE、DcSWN的表达则呈先降低后升高的趋势,DcCLF持续上调。总体上,铁皮石斛PRC2 成员普遍参与对环境胁迫的短时响应,有利于协调发育程序和胁迫应答之间的平衡。Liu 等[28]研究发现,拟南芥PRC2 核心成员CLF和SWN 介导的组蛋白H3K27me3与脱落酸(abscisic acid,ABA)相关的转录因子可以共同调控ABA 诱导衰老基因的表达,从而使植物响应干旱等环境胁迫,提高植物生长过程中的抗逆性。Alexandre 等[29]研究发现,拟南芥中PRC2 成员MSI1也参与响应干旱胁迫反应。此外,当拟南芥暴露于低温环境时,冷应激基因COR15A和ATGOLS3 座位的H3K27me3的水平显著降低[30]。设施栽培的铁皮石斛生长条件良好,但高温高湿高肥易滋生病原菌,导致病害的大面积爆发[31]。本研究利用两种常见的铁皮石斛病原齐整小核菌和灰葡萄孢霉菌[32-34]进行接种测试,发现铁皮石斛PRC2基因在响应两种病害胁迫下的表达差异明显,齐整小核菌侵染导致DcSWN表达先升高后降低,DcEMF2和DcMSI1表达上调;灰葡萄孢霉菌侵染诱导DcCLF和DcSWN的表达,但是抑制DcMSI1和DcFIE的表达。PRC2 成员对齐整小核菌和灰葡萄孢霉菌不同的响应方式,表明PRC2基因在不同病害胁迫下发挥重要的功能。Berr 等[35]研究发现与CLF/SWN 同为SDG家族成员的SDG8 通过调节茉莉酸(jasmonic acid,JA)和/或乙烯信号通路中的一组基因,在植物防御真菌病原体中发挥关键作用。总之,铁皮石斛PRC2 成员对不同的环境和病害胁迫具有差异的响应方式,便于更加精准调控相关基因在特定条件下的开闭。
本研究中铁皮石斛PRC2基因在响应非生物胁迫和生物胁迫发挥重要的生物学功能,但其具体的响应机制还需进一步挖掘。因此,需要建立有效的铁皮石斛转化体系或借助异源转化系统对铁皮石斛PRC2基因功能进行深入验证,确定PRC2 缺失或过表达对非生物和生物胁迫的响应情况和耐受性,为后续铁皮石斛抗逆的遗传育种提供关键佐证。
4 结论
本研究结果表明,铁皮石斛PRC2复合体核心亚基包括DcCLF、DcSWN、DcEMF2、DcMSI1和DcFIE,进化上与水稻PRC2 同源性较高;核心组分DcCLF与DcMSI1、DcMSI1与DcFIE、DcMSI1与DcLHP1、DcMSI1与DcMSI1之间存在互作关系,表明了PRC2复合体在进化上的保守性;PRC2 成员在铁皮石斛不同组织中均有表达,且广泛参与对非生物胁迫(低温、高温和脱水)和生物胁迫(齐整小核菌、灰葡萄孢霉菌)的响应过程,表明它们在植物器官发育和环境适应方面的功能具有普遍性。本研究结果为铁皮石斛PRC2 核心复合体成员在生长发育过程和胁迫应答机制提供了理论依据,并为分子育种提供了重要候选靶基因。
