绥李3 号李叶芽萌发过程中内源激素含量的变化*
2022-04-20焦奎宝王明洁吴雨蹊孙毅民
周 双,孙 伟,杨 光,焦奎宝,王明洁,唐 克,吴雨蹊,孙毅民,高 媛
(1 黑龙江省农业科学院乡村振兴科技研究所,哈尔滨 150027)(2 黑龙江工商学院)
内源激素是植物体中重要的活性物质,它参与并调控植物整个生长发育过程。植物体中有多种内源激素,且每种激素的调控作用不尽相同[1-3]。吲哚乙酸(IAA)具有促进生长的作用,通过不同浓度调整其在植物不同的部位产生的发育效应,并且不同的组织对IAA 浓度的反应差异很大。此外,吲哚乙酸与其他激素相互作用,从而刺激或抑制各种发育过程,在各种酶反应、细胞分化至形态建成都起到至关重要作用[4]。赤霉素(GA)的典型生理作用就是促进细胞的伸长从而促进生长,并在种子萌发到开花结果等植物的各种生理现象中发挥重要作用。赤霉素在果树上应用广泛,可诱导无核果实,打破芽休眠,防止落果,调控植株衰老等过程[5-7]。脱落酸(ABA)主要的生理作用是促进休眠、抑制植株生长[8],脱落酸在植物体内分布广泛。另外,脱落酸是诱导花芽分化、提高抗逆性的重要物质[9]。玉米素(ZT)作为细胞分裂素的一种,对植物生长发育过程的作用非常广泛,从基因水平、生理生化水平、细胞水平以至整株发育水平都有深刻的影响。玉米素可以刺激细胞的分裂分化,并且在解除休眠、打破顶端优势、调配养分、抑制衰老[10]、促进黄化幼苗中叶绿体的成熟等方面起着重要作用。玉米素通常与生长素协同作用,在有生长素存在时,不同浓度的细胞分裂素不仅在培养烟草髓组织时促进根、茎干生长,还能使非机体形成胼胝体,促进植物生长。
植物激素对植物的萌发、细胞分化、花芽分化、果实成熟等生理活动起着至关重要的调控作用。检测植物内源激素的常用方法有:气相色谱法(GC)、酶联免疫法(ELISA)、液相色谱串联质谱法(HPLC-MS)、气相色谱串联质谱(GC-MS)和高效液相色谱法(HPLC)等[10]。GC 法是分析植物中乙烯含量最普遍的方法;ELISA 法具有操作简单、快速、敏感性高的特点,但重现性差、易交叉感染、不能同时分析多种激素,在精确定量测定方面存在不足;HPLC-MS 法可以直接分析激素,分析速度快,定性分析结果可靠,但仪器的高成本阻碍了其更广泛的应用;GC-MS 法广泛应用于有机物的现场分析检测,定量分析精度高,定性能力高,但维护成本高,结构复杂,对实验人员操作具有较高要求[11];HPLC 法较其他方法具有灵敏度高、选择性强、重复性好和分析速度快等特点,被广泛用于植物激素的测定[12]。
芽的休眠由内源激素控制,休眠的起始、萌发和调控以及休眠阶段的改变均受激素调节[13]。果树花芽分化的相关激素研究已有相关报道[14-17],但叶芽萌发过程中内源激素变化却鲜有报道。李叶芽属于纯芽,存在2 种着生形态,一是单纯的叶芽,二是复芽中与花芽伴生的叶芽(复叶芽),李叶芽萌发是李树枝叶形成的基础,叶芽萌发的质量影响树体的生长发育,通过研究李树叶芽萌发过程中内源激素含量的变化情况,以探究内源激素在叶芽萌发过程中的变化规律及各激素所起的作用。
1 材料与方法
1.1 试验地概况
试验地位于黑龙江省绥棱县城西1 km,地处北纬47°14′,东经127°06′,海拔202.7 m。属大陆性季风气候,年平均气温1.4 ℃,1 月平均气温-22.6 ℃,7 月平均气温21.8 ℃,有效积温2 200~2 400 ℃(≥10 ℃),无霜期118.2 d,平均年降水量551.5 mm。土壤为淋溶黑钙土,较黏重,pH值为6.8~7.3,有机质含量4.04%~4.16%。
1.2 试验材料
供试材料采自黑龙江省农业科学院乡村振兴科技研究所绥棱基地绥李3 号试验园,试材为成龄绥李3 号李树上的叶芽。绥李3 号是由黑龙江省农业科学院乡村振兴科技研究所经有性杂交选育而成,树姿较直立,萌芽力强,成枝力中等;抗寒、丰产,以花束状果枝结果为主。果实圆形,大而整齐,平均单果重48.4 g,最大果重84.0 g;果肉黄色,纤维少,汁多、味甜,有香气,可溶性固形物含量16.6%;核小、黏核;较耐贮运。该品种是黑龙江省的主栽品种之一,此外,吉林、辽宁、内蒙古、新疆等地都有栽培。
分别于2020 年4 月7 日(李芽休眠即将结束)、4 月14 日(叶芽即将萌动,芽鳞片松动)、4 月21日(叶芽鳞片开裂)、4 月28 日(叶芽加长变大,芽尖出现前)、5 月5 日(叶芽出现芽鞘)、5 月12 日(叶芽芽尖显现绿色)采集纯叶芽、复叶芽,共取样6 次。取样后样品立即置于液氮中,于-80 ℃冰箱中保存,待测。
测试试剂:吲哚乙酸(IAA)、赤霉素(GA)、脱落酸(ABA)、玉米素(ZT)的标准品均购自美国Sigma 公司。标样稀释浓度:IAA(1.000、0.500、0.250、0.125、0.050 g/L),GA(20.0、10.0、5.0、2.5、1.0 g/L),ABA(0.100、0.050、0.025、0.012 5、0.005 g/L),ZT(0.100、0.050、0.025、0.012 5、0.005 g/L)。
1.3 试验方法
利用高效液相色谱法(HPLC)对IAA、GA、ABA、ZT 的含量进行测定。仪器为日本岛津高效液相色谱仪LC-2010HT。流动相配制:分别量取甲醇45 mL、超纯水55 mL 混匀溶解。HPLC 液相条件:色谱柱为SymmetryRC18 柱,3.5 μm,4.6 mm×75 mm,进样量为10 μL,流速:0.7 mL/min,检测波长:254 nm,柱温:30 ℃。检测器:氢离子火焰检测器。
称取叶芽0.5 g 冰浴研磨后加入20 mL 预冷的80%甲醇,在4 ℃冷浸过夜。抽滤2 次,合并滤液,40 ℃氮吹至无甲醇。加入30 mL 石油醚萃取脱色2次,保留水相。水相pH 值调至6.4,加0.5 g PVP,超声30 min,抽滤。滤液pH 值调至2.9,用30 mL乙酸乙酯萃取3 次,合并酯相,减压浓缩。45%甲醇溶解,并定容至2 mL,用0.45 μm 微孔滤膜过滤。待测液保存在4 ℃冰箱中。
取待测液10 mL,在选定的色谱条件下置于高效液相色谱仪,测定各激素的含量。
1.4 数据分析
数据用Excel 进行统计并作图。
2 结果与分析
2.1 不同叶芽中内源激素含量的变化
由图1-A 可以看出,纯叶芽中IAA 含量总体呈现先上升后降低的趋势,在芽鳞片松动前有一个大幅提升(4 月14 日),达到最大值,为98.05 μg/g,较初始值提高了251.43%。IAA 含量的这种变化发生在鳞片松动前,叶芽鳞片松动是叶芽即将萌发、开始生长的一个重要形态变化,说明叶芽在鳞片松动这样重要的形态变化前需要较高水平的IAA 作基础,当高浓度IAA 成功激发了重要形态变化,叶芽进入萌发状态后,低水平的IAA 即可维持叶芽的后续生长发育,IAA 含量随后降低。芽尖出现前(4月28 日)IAA 含量又有一个小幅上升,可能叶芽芽尖的出现也是叶芽生长的一个较重要的形态变化,同叶芽鳞片开裂一样,需要一定浓度的IAA 作基础。IAA 含量的升高和降低,是为了保证叶芽重要形态变化的需求,维持叶芽的正常发育和生长。复叶芽与纯叶芽的变化相似,但复叶芽中的IAA 含量的提升较纯叶芽晚一些,高峰出现在鳞片开裂时的4 月21 日,含量为68.83 μg/g,较初始值提高了20.59%。
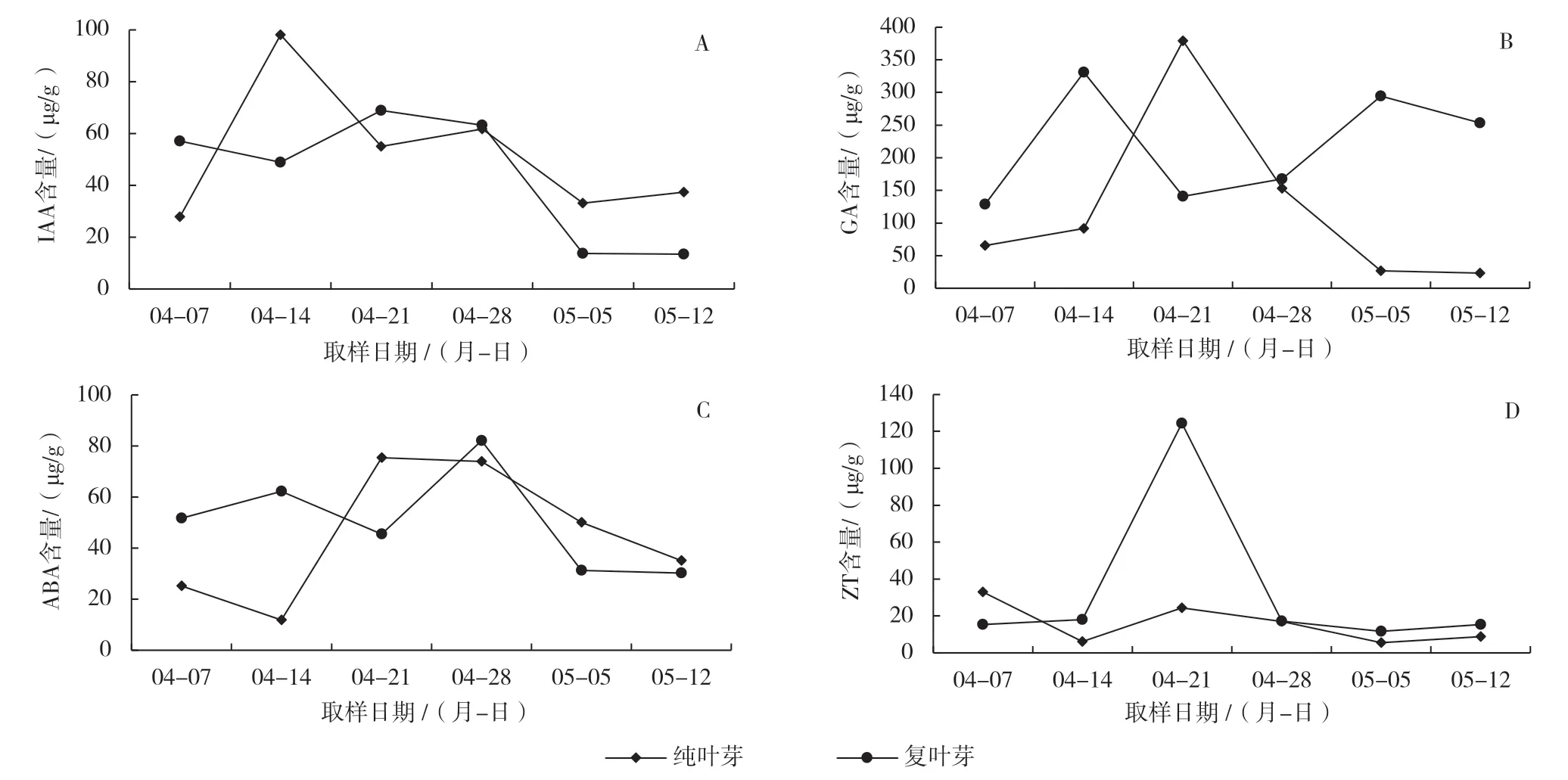
图1 不同叶芽中内源激素含量的变化
由图1-B 可知,不同叶芽中的GA 含量的变化趋势不尽相同。纯叶芽中GA 含量呈现先升高后降低的单峰趋势,在整个叶芽萌发期间对GA 的需求量都比较高,其中在叶芽鳞片开裂时期(4 月21 日)对GA 需要最多,其值为379.24 μg/g,较初始值提高了477.67%。复叶芽由于受到花芽的影响,使得复叶芽在萌发期间GA 的含量呈现M 形变化趋势,其2 次升高分别在4 月14 日(叶芽即将萌动)和5月5 日(叶芽出现芽鞘),其值分别为330.80、294.22 μg/g,分别较初始值提高了157.55%、129.07%。并且在整个萌发期间复叶芽对GA 的需求早于纯叶芽,需求量也普遍高于纯叶芽。说明GA 在叶芽萌发中期起着关键作用。
由图1-C 可看到,不同叶芽的ABA 含量变化有明显不同。ABA 在2 种叶芽中,前期含量均在较高水平,这可能是李芽休眠状态的正常含量(4 月7 日各芽均处于休眠状态),随着芽的形态变化,ABA 含量开始发生变化。纯叶芽中的ABA 含量呈现先下降后上升再下降的趋势,在4 月14 日下降到最低,在为萌发做准备;在激发了叶芽萌发的启动因子后,ABA 含量急剧升高,在4 月21 日,其含量从 11.91 μg/g 升高到 75.49 μg/g,提高了533.84%,可能是叶芽鳞片松动与脱落需要一定含量的ABA;随后一直缓慢下降,则是叶芽开始进入平稳、缓慢生长期,对ABA 的需求降低。复叶芽呈现先升高后降低再升高再降低的趋势,分别在4月14 日和4 月28 日有2 个跃升,含量分别为62.34、82.20 μg/g,分别较初始值升高了20.53%、58.93%。最大的跃升时期比纯叶芽出现的晚些,这2 个跃升期均在纯叶芽中的ABA 下降时出现,可能也是因为复叶芽与花芽相邻紧密,为保证花芽的正常生长发育而出现的自我调节,同时也验证了叶芽的生长势要比花芽强。叶芽在一定时期通过改变ABA 含量控制自身长势,来保证花芽的正常生长发育。
由图1-D 可知,不同叶芽的ZT 含量变化明显不同。纯叶芽内的ZT 含量先下降后小幅度升高再逐渐下降;复叶芽内的ZT 含量呈现先升高后降低的趋势。纯叶芽和复叶芽均在4 月21 日出现跃升,这一时期正是叶芽鳞片开裂时期,说明ZT 在叶芽的萌动中期起着重要的作用,叶芽萌动需要ZT 一定的浓度作为保证。复叶芽中的ZT 含量在4 月21日跃升幅度较大,含量为124.46 μg/g,较初始值提高了712.93%,可能是因为受紧密相邻的花芽的影响,它的萌发需要更高浓度的ZT 来激发。2 种叶芽在萌动发育迅速时期(4 月14—28 日)细胞分裂旺盛,对ZT 的需求量均较大。
2.2 内源激素含量的比值对叶芽的影响
植物的生长发育不是激素单独作用的结果,而是多个激素通过改变其比值从而协调或拮抗作用反应到发育过程。通常促进型激素GA 和IAA 与抑制型激素ABA 的比值能够反映植物的生长状态,比值高说明促进型激素占优势,植物加速生长;比值低说明抑制型激素占优势,植物生长缓慢或处于休眠状态[18]。
试验结果表明,纯叶芽(IAA+GA)/ABA 的值呈现先升高再降低的趋势,如图2-A 所示。在叶芽萌动初期(4 月7—21 日),纯叶芽生长旺盛,IAA 和GA 总含量比较占优势,并在4 月14 日出现生长高峰,4 月21 日鳞片开裂后,叶芽生长稍缓;5 月5 日(叶芽出现芽鞘)后,叶芽萌发生长加快,对促进型激素需求再次增加。由于复叶芽受花芽影响,整个萌发期间,(IAA+GA)/ABA 的值呈现M形变化趋势,在4 月14 日,出现第1 个生长高峰,但(IAA+GA)/ABA 的值均低于纯叶芽,在5 月5日出现第2 个生长高峰,比值高于纯叶芽,说明复叶芽在萌发过程中是初期较缓,后期生长迅速。
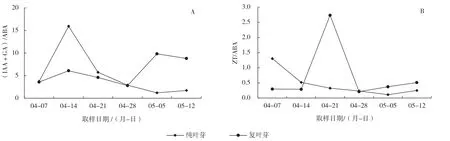
图2 不同叶芽中内源激素含量比值的变化
从图2-B 可以看出,在整个叶芽萌发过程中(4月7 日至5 月5 日),纯叶芽ZT/ABA 的值呈现下降趋势,说明ZT 与ABA 的比值对纯叶芽萌发的影响较小。然而复叶芽ZT/ABA 的值呈现先升高后降低的趋势,且变化范围较大,说明在萌动中期ZT与ABA 的比值对复叶芽影响较大,并且至关重要。
3 结论与讨论
2 种叶芽中的IAA 含量变化的总趋势是下降,叶芽形态变化前的启动因子需较高水平的IAA 来启动,启动后则需求降低。IAA 并不是在形态变化过程中发挥最大作用,而是在形态变化之前就已经开始积累,达到最高值,激发形态变化的启动因子时,IAA 发挥最重要作用。IAA 与其他激素的协同作用可能是调节叶芽萌发的方式。不同叶芽对IAA浓度的反应存在差异,由于复叶芽是与花芽伴生,在萌发时,受花芽的影响,其含量变化较纯叶芽迟缓。
试验研究表明,GA 与落叶果树芽休眠和萌发之间存在紧密联系[19]。本试验发现,2 种叶芽在萌发过程中对GA 需求量较大,这证实了GA 在抑制芽的休眠、促进芽的萌发中具有重要作用。不同叶芽在萌发的不同阶段对GA 的需求也存在差异,纯叶芽中GA 的含量呈现先升高后降低的单峰趋势,而复叶芽在萌发期间GA 含量呈现M 形变化趋势,说明叶芽的萌发不是单纯依靠GA,而是通过多种激素平衡互作的结果。
关于ABA 与叶芽萌发的关系,本试验发现,在叶芽萌发过程中ABA 呈现逐渐升高再降低的趋势,说明解除休眠并未带来ABA 的降低,ABA 与其他激素相互作用而起到调节叶芽萌发和营养物质加速积累的作用,在叶芽形态分化期间起到促进作用。
曾辉等[20]研究澳洲坚果内源玉米素与其花芽分化关系时发现,其叶片、枝条和细根中较高浓度的ZT 有利于花芽的分化。在本试验中,ZT 在2 种叶芽的萌发前期需求较低,在萌发中期需求量增加,然而后期又降低,尤其复叶芽受花芽影响对ZT 的需求更大,说明ZT 是在叶芽萌发中期起着重要作用。在本试验中还发现,复叶芽在萌发中期对ZT的需求量远高于纯叶芽,说明复叶芽受花芽的影响较大。
叶芽的萌发不仅是单一激素作用,而是多个激素协同作用的结果,(IAA+GA)/ABA 的值对2种叶芽的影响存在差异。纯叶芽在萌动前期(IAA+GA)与ABA 的比值较高,中后期逐渐降低,说明促进型激素在萌芽前期占主导作用,有利于叶芽打破休眠,促进萌发。而促进型激素对复叶芽促进作用分2 个阶段,前期生长稍缓,后期生长迅速,这与邻近花芽有关。
在整个叶芽萌发过程中,纯叶芽ZT/ABA 的值呈现下降趋势,说明ZT 与ABA 的比值对纯叶芽萌发的影响较小。然而复叶芽ZT/ABA 的值在萌动中期变化较大,说明受花芽影响,复叶芽对ZT 与ABA的比值需求增加,调动更多养分促进细胞分裂,从而利于自身萌发。
