花生种子特异启动子AHSSP1的克隆及功能分析
2020-03-17孙全喜徐洪明李春娟闫彩霞赵小波王苑翠玲单世华
孙全喜 徐洪明 李春娟 闫彩霞 赵小波王 娟 苑翠玲 单世华
(1山东省花生研究所,山东 青岛 266100;2东阿县农业技术推广站工作,山东 聊城 252200)
花生(Arachis hypogaeaL.)是重要的油料作物之一,其种子富含脂肪和蛋白质,是理想的“生物反应器”。自1993年获得转基因花生以来[1],陆续出现了以抗逆、品质改良等为目标的转基因花生的报道[2-6]。迄今为止,此类研究大都使用植物组成型表达启动子(即目的外源基因在植物整株中表达),如烟草花叶病毒CamV35S 启动子[7]。但在植物所有组织中持续高效表达目的基因会给植物生长发育带来不利影响[8]。而组织特异启动子作为一类专一性启动子,能驱动外源基因在植物发育过程中某一特定时空表达[9]。它不仅能使目的基因的表达产物在一定空间积累,增加区域表达量,而且能避免植物营养的浪费[10-11]。种子特异启动子可以驱动外源基因在种子中特异表达,这对花生种子遗传改良具有重要的应用价值。
随着生物技术的快速发展,陆续出现利用多基因聚合技术,以高等植物种子作为“生物反应器”异源合成营养物质的报道[12]。如,能生产维生素A的金色大米[13]、可产鱼油的油菜籽[14]、能异源合成花青素的紫晶大米[15]以及紫胚玉米[16]等,这些“生物强化”农作物的获得均需要引进外源代谢途径,而异源表达外源代谢途径涉及的基因需借助启动子的驱动。研究表明,多基因转化过程中,若每个基因使用相同序列的启动子,则存在大量重复序列,可能会造成转基因沉默,每个基因表达盒选择应使用不同序列的启动子[17-18]。因此,若想借助花生种子作为“生物反应器”异源合成营养物质,获得“生物强化”花生,需要克隆鉴定大量种子特异启动子。然而,目前可以利用的花生种子特异启动子较少,且均克隆自已知种子特异表达基因[10,19-20]。Paik-Ro 等[21]报道了花生PSC32基因(AF366560)在种子中表达,而在叶片、根和果针中不表达。因此,本试验克隆了花生PSC32基因上游957 bp的启动子片段,并借助转基因拟南芥对其功能进行鉴定,以期为花生种子品质改良或以花生种子作为“生物反应器”的研究提供参考。
1 材料与方法
1.1 试验材料
所用试验材料为花生(品种为花育33)和“Col0”生态型拟南芥,均由山东省花生研究所品种资源课题组保存。
大肠杆菌DH5α 感受态、DNA 分子量标记、PCR mix 等购自北京全式金生物有限公司;高保真聚合酶Phusion、反转录酶、DNase 酶以及限制性内切酶HindⅢ和BamHI 购自加拿大Fermentas 公司;T4 DNA 连接酶购自宝生物工程(大连)有限公司;用于GUS 组织化学底物X-Gluc 购自美国SIGMA 公司;质粒小提试剂盒和胶回收试剂盒购自天根生化科技(北京)有限公司;农杆菌菌株GV3101和植物表达载体pBI121 由山东省花生研究所品种资源课题组保存。
1.2 PSC32基因内源表达分析
设计PSC32基因特异引物PSC32-F和PSC32-R(表1),提取花育33 饱果成熟期根、茎、叶片、花、入土前的果针、成熟种子的果壳以及成熟种子的RNA,反转录成cDNA。利用半定量RT-PCR方法检测其在不同组织或器官中的表达情况,以花生Actin基因作为内参基因[22]。PCR 反应条件:94℃预变性3 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,26个循环;72℃后延伸10 min。

表1 本研究所用PCR 引物Table1 Sequence of PCR primers used in this study
1.3 顺式作用元件分析
利用NewPLACE (https:/ /sogo.dna.affrc.go.jp/cgibin/sogo.cgi? lang=en&pj=640&action=page&page=newplace)在线分析序列中顺式作用元件情况,如是否具有启动子所具备的TATA 盒和CAAT 盒,以及种子或胚胎特异启动子常有的RY REPEAT元件及其他的一些响应不同信号的保守序列。
1.4 AHSSP1 启动子的克隆及其驱动GUS 报告基因表达载体的构建
提取花育33 幼嫩叶片基因组,利用AHSSP1 特异引物AHSSP1-F和AHSSP1-R(表1)进行PCR 扩增。PCR 反应体系(50 μL):ddH2O 30.9 μL,5×HF buffer(含Mg2+)10 μL;dNTP(2.5 mmol·L-1)2 μL;AHSSP1-F和AHSSP1-R(5 μmol·L-1)各2 μL;DMSO 0.6 μL;Phusion 酶0.5 μL;基因组模板2 μL。扩增程序:98℃预变性30 s;98℃变性10 s,58℃退火10 s,72℃延伸50 s,28个循环;72℃后延伸10 min。经胶回收后,连接至克隆载体pEASY-Blunt Simple,经桑尼生物科技有限公司测序正确后得到质粒,并命名为pEASY-BAHSSP1。
用限制性内切酶HindⅢ和BamHI 将启动子AHSSP1 片段在质粒pEASY-B-AHSSP1 切下,在T4 连接酶的作用下,连接到经相同酶切的植物表达载体pBI121 上,得到质粒pBI121-AHSSP1。
1.5 农杆菌介导的拟南芥遗传转化、筛选及鉴定
利用热激法将构建好的质粒pBI121-AHSSP1 转化到农杆菌GV3101,然后利用花絮侵染法转化拟南芥[23]。收集农杆菌侵染后的拟南芥T0种子,在无菌超净工作台上操作,用70%酒精处理1 min,2.6%次氯酸钠处理10 min,再用无菌水冲洗4~5 次,分散置于含50 μg·mL-1卡那霉素的MS 培养基上。待T1卡那霉素抗性的拟南芥幼苗长出2 片子叶后,选取绿色健康的幼苗移栽到蛭石中[24],约2个月后收获种子,用于后续试验。
1.6 GUS 组织化学染色
预先配制GUS 染色液(含0.1 mol·L-1磷酸钠缓冲液、10 mmol·L-1EDTA、0.5 mmol·L-1铁氰化钾、0.5 mmol·L-1亚铁氰化钾、1 mmol·L-1X-Gluc和0.1%Triton X-100)[25]。先将试验材料在90%丙酮中(冰浴)固定15~20 min,然后在染色液(不含X-Gluc)中漂洗3 次,再置于GUS 染色液(含X-Gluc)中,37℃恒温放置12~16 h,最后用70%酒精脱色30 min,再用100%酒精脱色30 min[23],完成GUS 组织染色。
2 结果与分析
2.1 PSC32基因在花生不同组织中的表达分析
经序列比对分析发现,PSC32基因编码Conglutin蛋白,该蛋白是种子贮藏蛋白[26]。为进一步确定其组织表达特异性,利用半定量RT-PCR 检测了该基因在花生根、茎、叶片、花、入土前果针、成熟种子的果壳和成熟种子中的内源表达情况。由图1可知,PSC32基因在花生成熟种子中有很强的表达信号,在根、茎、叶片、果针和果壳中均不表达,表明PSC32基因是一个种子特异表达基因,暗示其启动子AHSSP1可能具有种子表达特异性。

图1 PSC32基因在花生不同组织中的表达情况Fig.1 PSC32 gene expression profile in different tissues of peanut
2.2 AHSSP1 启动子的克隆及顺式作用元件分析
试验设计了AHSSP1 启动子多对特异引物,其中以AHSSP1-F1和AHSSP1-R1(表1)扩增得到一个大约1 000 bp的片段(图2-A),经胶回收后,连接到克隆载体pEASY-Blunt Simple,获得带有目的启动子片段的质粒,命名为pEASY-B-AHSSP1。经测序,得到其正确序列,选取其起始密码子ATG 上游957 bp的片段进行顺式作用元件分析,发现AHSSP1 序列含有重要的转录必备RNA 聚合酶结合位点TATA box、CAAT box,以及3个RY REPEAT元件,通常存在于种子贮藏蛋白启动子中的2S SEED PROTBANAPA元件等(图3、表2)。这进一步暗示AHSSP1可能是一个种子特异表达启动子。此外,序列中还包含激素响应元件(如赤霉素、脱落酸和水杨酸等),以及响应光信号、低温和高温胁迫的元件。
2.3 AHSSP1 驱动GUS 报告基因表达载体的构建
将pEASY-B-AHSSP1 用限制性内切酶HindⅢ和BamHI 进行双酶切,得到启动子AHSSP1 片段,连接到同样经过HindⅢ和BamHI 酶切的植物表达载体pBI121中。此时,该载体中原来的烟草花叶病毒CaMV 35S 启动子被AHSSP1 替代,得到目的表达载体pBI121-AHSSP1(图2-B)。
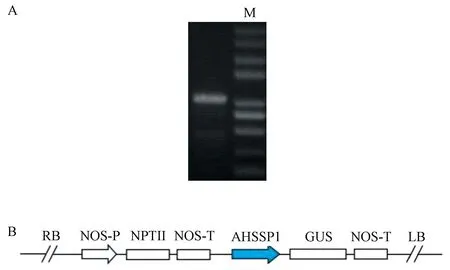
图2 启动子AHSSP1的克隆及其表达载体构建Fig.2 Cloning of promoter AHSSP1 and its expression vector construction for transformation
2.4 转基因拟南芥的获得及GUS 组织化学染色
将pBI121-AHSSP1 转化到农杆菌GV3101,利用花絮侵染法转化拟南芥,收集农杆菌侵染后的种子,在含50 μg·mL-1卡那霉素的MS 培养基上筛选,将绿色健康的抗性幼苗移栽到蛭石中。随机选取了12株抗性苗进行PCR 检测,发现均为转基因阳性苗(图4)。经筛选得到T2转基因拟南芥纯合体,分别对12个转基因个体后代的不同组织进行GUS 化学染色。结果显示,转基因拟南芥成熟的种子(图5-A)及萌发种子的子叶、下胚轴和胚根均能够被染上蓝色(图5-C);长出真叶后,子叶和下胚轴仍能被染色,而根及真叶不能被染上蓝色(图5-E);成年期转基因拟南芥的叶片也不能被染上蓝色(图5-G)。野生型拟南芥整个生长时期均不能被染上蓝色(图5-B、D、F)。上述结果表明,花生AHSSP1 启动子可以驱动外源报告基因GUS在拟南芥种子种特异表达。

图3 花生AHSSP1 启动子序列和预测的顺式作用元件Fig.3 AHSSP1 promoter sequence and predicted cis-acting elements

表2 AHSSP1 序列中存在的顺式作用元件Table2 Putative cis-acting elements in AHSSP1 sequence

图4 转基因拟南芥PCR 检测Fig.4 PCR detection of putative transgenic Arabidopsis

图5 转基因拟南芥的GUS 组织化学染色Fig.5 Histochemical GUS assays of transgenic Arabidopsis
3 讨论
花生种子富含油脂和蛋白质,是异源生产外源蛋白及次生代谢物的理想“生物反应器”。以花生种子中含量丰富的油酸和亚油酸为底物,在一系列延长酶和去饱和酶作用下,可异源生产超长链多不饱和脂肪酸花生四烯酸(arachidonic acid,AA)、二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA) (鱼油的主要有效成分)[2]。种子特异启动子可以驱动外源基因只在种子中表达,是实现这一目标的重要分子工具。然而,目前可供选择使用的花生种子特异启动子太少,本研究克隆了花生种子特异表达基因PSC32的启动子,借助转基因拟南芥鉴定了一个新的花生种子特异启动子AHSSP1,丰富了花生种子特异启动子资源。
文献报道PSC32基因只在花生种子中表达[21],该基因编码蛋白属于种子贮藏蛋白蓝豆蛋白(Conglutin)家族,此类蛋白在种子中表达量丰富[26]。本研究利用RT-PCR 分别对PSC32基因在花生栽培种花育33 各组织中的表达情况进行了检测,发现该基因在花生种子中表达,而在花生根、茎、叶、花、果针、果壳中均不表达,进一步证实了PSC32基因是种子特异表达基因,暗示其启动子是种子特异启动子。为进一步验证该结果,以PSC32基因起始密码子ATG 上游约2 000 bp的序列为参考,设计了多对引物,但由于该序列AT含量丰富,只有AHSSP1-F1和AHSSP1-R1 引物扩增得到一个951 bp的片段。启动子序列中顺式作用元件的种类和数量决定着启动子的表达方式[27]。分析PSC32 序列中存在的顺式作用元件发现,AHSSP1 序列中除具备启动子所必需的TATA 盒、CAAT 盒等,还具有常存在于种子特异启动子序列的RY REPEAT元件,2S SEED PROTBANAPA元件,胚乳蛋白表达相关的Skn-1元件,提高转录水平的5UTR Py-rich stretch元件,提供组织特异性-300 CORE元件等(图3)。以上结果均说明AHSSP1 启动子可能是个强表达种子特异启动子。
目前,开展花生遗传转化的研究比较困难,而以拟南芥或烟草等作为模式植物,为花生启动子的克隆鉴定提供了极大便利。本试验借助转基因拟南芥进行研究,发现PSC32 启动子可驱动报告基因GUS在转基因拟南芥成熟种子,以及萌发种子的子叶、下胚轴和幼根中特异表达,证明AHSSP1 启动子是一个种子特异启动子,这与前人鉴定种子特异启动子的方法一致[28-32]。
4 结论
本研究克隆并鉴定了一个新的花生种子特异表达启动子AHSSP1,该启动子可以驱动外源基因在种子中特异表达。本研究花生AHSSP1 启动子的克隆鉴定为下一步以花生种子作为“生物反应器”,获得“生物强化”花生提供了种子特异启动子资源。
