miR-203a靶向及其靶基因对乳腺癌淋巴结转移的影响*
2020-03-16韩利蓉宋江勤郭飞波张栋武
韩利蓉 , 宋江勤 , 郭飞波 , 张栋武
(1. 湖北省天门市第一人民医院, 天门 431700; 2. 广东医科大学附属佛山高明医院, 佛山 528500)
微小核糖核酸(microRNA, miRNA)是一种长度为18~22个核糖核苷酸的非编码RNA分子,主要通过与mRNA的3’- UTR结合,通过降解或抑制mRNA来抑制翻译,从而调节蛋白的表达,在肿瘤的发生发展中发挥重要作用[1-3]。国内外研究均表明,miR-203a参与多种癌症的生物学功能,包括增殖、转移和浸润等,在不同的肿瘤组织中呈现不同的表达模式,在肝癌[4]、胃癌[2,5]、膀胱癌[6]、胶质瘤[3]等癌组织中miR-203a呈显著低表达,在乳腺癌组织中miR-203a显著高表达,且发现浸润性小叶癌组织中,随着临床分级程度越高,miR-203a表达越低[7]。DNA损伤反应通路的改变是癌症的特征,DNA损伤的错误修复常常导致基因组不稳定[8]。ATM(ataxia telangiectasia mutated)是DNA损伤修复系统的核心组成部分,在DNA双链断裂时被激活以增强同源重组修复通路,当ATM基因沉默或缺失时,得不到及时修复的受损DNA遗传给子代,增加了基因组的不稳定性,从而加大肿瘤的易感性[9,10]。国内外研究均发现,ATM基因的缺失或变异与肿瘤的发生发展密切相关[11,12],但在不同癌症中表达各不相同:在乳腺癌中呈显著低表达[13],在卵巢癌中显著高表达[14]。文献报道,在胃癌中miR-203a和ATM是直接的靶基因调节关系,二者呈显著负相关[2]。另一项研究也发现miR-203和ATM在散发性乳腺癌中呈显著负相关[13]。由此,我们推断在乳腺癌组织中miR-203a和ATM很可能也是直接靶基因调节关系。乳腺癌是中国女性最常见的癌症,在大中城市,年轻女性中新发病例和死亡病例均有所上升[15]。因此,对乳腺癌发病机制尤其是分子层面的研究具有重要的临床意义。目前,国内有关乳腺癌组织中miR-203a及ATM基因的靶向关系,以及在淋巴结已转移和未转移之间是否存在显著差异性的问题,均鲜见相关文献报道。本研究通过RT-qPCR检测乳腺癌组织和癌旁正常组织中miR-203a及ATM基因的表达情况,分析二者相关性(即对上述推断进行验证),分析其与临床病理特征的相关性,比较在淋巴结已转移组和未转移组之间是否存在显著差异性,旨在为乳腺癌的发病机制尤其是淋巴结转移机制提供医学依据。
1 材料与方法
1.1 标本
自2016年12月至2018年12月,在天门市第一人民医院病理标本库里收集的30例配对的乳腺癌组织和癌旁正常组织。所有标本均为病理活检标本,并经病理明确诊断。纳入标准:术前均未经任何药物、化疗和放疗等治疗。诊断标准:参照乳腺癌诊疗规范(2011年版)[16],经病理确诊为乳腺癌。排除标准:合并其他肿瘤者;合并高血压、糖尿病、高血脂等慢性疾病者;合并心、肝、肾等慢性疾病患者。本研究经本院伦理委员会同意,并经患者知情同意并签字。其中,患者平均年龄(47.21±13.26)岁,平均体重(62.53±8.64)kg。
1.2 试剂与仪器
试剂:TRIZOL-LS(英伟创津);miRNA的RT-qPCR试剂为丹麦EXIQON的逆转录、引物和荧光定量PCR试剂盒,包括miRCURY LNATMUniversal cDNA Synthesis Kit、miRCURY LNATMPCR Primer、ExiLENT SYBR®Green master mix;mRNA荧光定量PCR试剂为Takara,包括RNase Free dH20、ROX Reference Dye II、PrimeScripTMRT reagent Kit、SYBR®Premix Ex TaqTM、mRNA forward and reverse primers。仪器:分光光度计(AMERSHAM UlRTROSPEC 2001);Bio-Rad电泳仪(英国,Bio-Tek);凝胶成像系统(GENEGENIUS GEL DOC 2000);普通PCR仪(美国,Bio-Rad);荧光定量PCR仪(美国,ABI,ViiA 7);低温高速离心机(美国,Eppendorf)等。引物序列如下:hsa-miR-203a:MIMAT0000089, GUGAAAUGUUUAGGACCACUAG (5’-3);GAPDH:Forward:CAGTAGAGGCAGGGATGATGTTCT;Reverse:CATGGGTGTGAACCATGAGAAGTA;ATM:Forward:ACTATCCCAATACACTGCTGGAGA;Reverse:TTTGAGCAACTGACTGGCAAAC。
1.3 总RNA抽提
按照试剂操作说明书操作,使用TRIZOL-LS从乳腺癌和癌旁正常组织中提取总RNA。使用分光光度计检测RNA含量、浓度和OD260/OD280值(OD260/OD280值在1.9~2.1,说明纯度好),将纯度好的样品分装标记存放-80℃冰箱保存备用。使用电泳仪和凝胶成像系统进行RNA鉴定。
1.4 miRNA的RT-qPCR
按照EXIQON的逆转录、引物和荧光定量PCR试剂盒的操作说明书进行操作,选择10 μl的反应体系。逆转录在普通PCR仪上进行,设置参数:输入20 μmol/L;42℃ 60 min;95℃ 5 min;4℃ 30 min~2 h。将得到的cDNA存于-20℃备用。荧光定量PCR检测在荧光定量PCR仪和专用的反应管中进行,设置参数:输入20 μmol/L;95℃ 10 min 预变性;40个循环重复:95℃ 10 s;60℃ 1 min;ramp-rate 1.6℃/s,即降温速度;65~98℃,1℃/6 s,即溶解曲线。以U6为内参。手动调节基线得出CT值,复3孔取平均CT值用于计算相对表达量,采用2-△△CT公式计算。
1.5 mRNA荧光定量PCR
按照TAKARA的逆转录、引物和荧光定量PCR试剂盒操作说明书进行操作,选择20 μl的反应体系。逆转录在普通PCR仪上进行,设置参数:输入10 μmol/L;37℃ 15 min;85℃ 5 s;4℃ 30 min~2 h。荧光定量PCR在ViiA 7(ABI)荧光定量PCR仪和专用的反应管中进行,设置参数:输入20 μmol/ L;95℃ 30 s 预变性;40个循环重复:95℃ 3 s;60℃ 30 s;Melt Curve stage(仪器默认,勿改):95℃ 15 s;60℃ 1 min。以GAPDH为内参,数据处理同上面的miRNA。
1.6 统计学处理
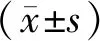
2 结果
2.1 miR-203a与AMT在乳腺癌及癌旁组织中的表达
miR-203a在乳腺癌组织中的表达高于癌旁正常组织,ATM在乳腺癌组织中的表达低于癌旁正常组织,两组比较均有显著差异(P<0.01,表1)。
Tab. 1 MiR-203a and ATM expression in tumor and adjacent normal tissues n=30)
2.2 miR-203a与ATM在乳腺癌组织中的相关性
采用Pearson相关分析表明,miR-203a和ATM在乳腺癌组织中的表达呈负相关(r=-0.847,P= 0.000)。
2.3 miR-203a和ATM分别与乳腺癌病理特征相关性分析
根据miR-203a相对表达量的中位数(0.114)将乳腺癌组分为低表达组(<0.114)和高表达组(≥0.114),根据ATM相对表达量的中位数(0.565)将乳腺癌组分为低表达组(<0.565)和高表达组(≥ 0.565),结果表明miR-203a和ATM表达与淋巴结是否转移与不同临床分期的相关分析均显著相关(P<0.05),而与诊断时的年龄均无相关(P>0.05, 表2)。
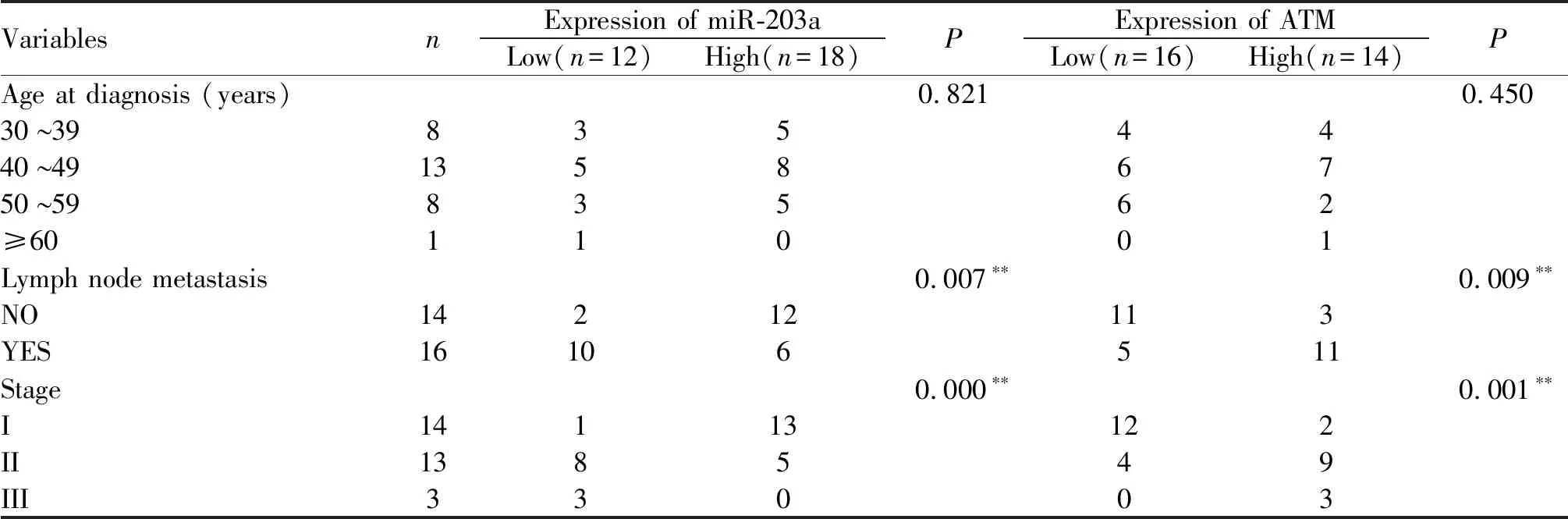
Tab. 2 Correlation analysis between mir-203a, ATM and pathological characteristics of breast cancer, respectively
2.4 miR-203a和ATM在乳腺癌淋巴结是否转移中的表达差异
miR-203a在淋巴结未转移组中的表达高于已转移组,ATM在淋巴结已转移组中的表达显著高于未转移组,两组比较均有显著差异(P<0.05,表3)。

Tab. 3 Expressions of mir-203a and ATM in lymph node metastasis or without
3 讨论
乳腺癌是目前我国大中城市女性发病率最高的癌症。国内外学者均致力于研究乳腺癌的发病机制尤其是分子层面如miRNA及其靶基因调控在乳腺癌发生发展中可能发生的作用,结果发现miR-203a及其靶基因ATM有可能参与其中。miR-203a参与多种肿瘤的生物学功能,包括增殖、转移和浸润等[4],ATM主要参与DNA双链断裂引起的损伤修复反应,在维持基因组稳定性方面起到重要作用[9]。文献报道,miR-203a在乳腺癌组织中高表达[7,17],ATM基因在散发性乳腺癌中呈低表达[13,18],miR-203的高表达和ATM的低表达呈显著负相关[13]。有研究已证实,在胃癌中miR-203a和ATM是直接的靶基因调节关系[2]。因此,本研究推测在乳腺癌中miR-203a和ATM也很可能是直接的靶基因调节关系。
miR-203a与AMT在乳腺癌及癌旁组织中的表达情况:本研究结果显示,miR-203a在乳腺癌组织中的表达显著高于癌旁正常组织,ATM在乳腺癌组织中表达显著低于癌旁正常组织,二者呈显著负相关,验证了上述推测,提示miR-203a的高表达和ATM的低表达共同参与了乳腺癌的发生发展,miR-203a很可能通过负性调节抑制或沉默其靶基因---ATM基因的表达,在乳腺癌分子层面的发病机制中发挥重要调节作用,结论与文献报道相近[7,17]。
miR-203a与ATM在乳腺癌组织中的相关性:乳腺癌转移是影响乳腺癌诊断、治疗、预后及复发的关键因素,因此对乳腺肿瘤细胞的侵袭和迁移方面的机制研究是乳腺癌发病机制研究中的重中之重。研究表明,乳腺癌组织中miR-203a表达水平与部分临床病理特征如诊断年龄、有无淋巴结转移、肿瘤类别和肿瘤直径等因素有关[7],miR-203a在侵袭性小叶癌中随着分期的增加而显著下调[7],ATM蛋白的表达随着乳腺癌临床分期的增加而增强[19]。本研究结果显示乳腺癌组织中miR-203a和ATM的表达高低与不同临床分期与淋巴结是否转移显著相关,随着乳腺癌临床分期越高,淋巴结发生转移,miR-203a高表达者占总人数的百分率逐渐下降,ATM高表达者占总人数的百分率逐渐升高,提示miR-203a和ATM可能参与了乳腺癌的发展进程,随着病程进展,淋巴结发生转移,二者的表达水平发生了改变。有研究发现在无淋巴结转移的乳腺癌组织中miR-203a高表达[7],在乳腺癌非转移性细胞系中miR-203上调,在转移性细胞系中miR-203显著下调[20]。另一项研究发现,随着乳腺癌迁移侵袭能力的增强,p-ATM表达量相应增加,晚期淋巴结转移的乳腺肿瘤组织中ATM激酶的表达非常活跃[21],当ATM基因被敲除或抑制后,乳腺癌细胞的迁移和侵袭能力明显下降[19]。本研究结果发现miR-203a在淋巴结未转移组中的表达显著高于已转移组,ATM在淋巴结已转移组中的表达显著高于未转移组,证实了作者前文推断且与上述学者的研究结果一致,提示在乳腺癌中晚期,可能通过表观遗传机制下调miR-203a上调ATM基因表达,促进乳腺癌细胞侵袭迁移和淋巴结转移,推动病程进展。由上述结果推测,miR-203a的过表达通过靶基因负性调节关系沉默或抑制ATM基因的表达在乳腺癌早期其实际上很可能是一种调节肿瘤细胞增殖、转移和侵袭性的保护机制,随着病程进展,很可能通过表观遗传机制抑制miR-203a的表达且增强ATM基因的表达促进乳腺癌细胞的淋巴结转移。
综上所述,miR-203a及其靶基因ATM均可能参与了乳腺癌的发生发展过程,在乳腺癌早期miR-203a过表达抑制其靶基因ATM的表达很可能是一种调节肿瘤细胞增殖、转移和侵袭性的保护机制,到中晚期下调miR-203a上调ATM基因,可能参与淋巴结转移。目前国内有关乳腺癌组织中miR-203a及其靶基因ATM的表达及其在淋巴结转移方面的机制研究鲜有报道,本研究样本量较少,需要大样本多中心试验,并在基因层面进行进一步研究确定,为乳腺癌的发病机制尤其是淋巴结转移机制提供更多医学依据。
