不同宿主源弓形虫ROP16基因的遗传变异分析
2020-03-16黄勉冯伟利植广林杨子鹏左珂菁杨晓颖陈绚姣袁浩袁子国
黄勉, 冯伟利, 植广林, 杨子鹏, 左珂菁,杨晓颖, 陈绚姣, 袁浩, 袁子国*
(1.广州动物园, 广州 510070; 2.华南农业大学兽医学院, 广州 510642)
刚地弓形虫是一种专性胞内寄生原虫,能感染包括人类、畜禽、鸟类在内的几乎所有温血动物[1-2]。妊娠动物感染弓形虫可垂直传播至子代,形成先天性弓形虫病,造成先天性缺陷或者死亡。动物眼部发生感染时,若处理不当,可造成严重的视力障碍[3-4]。弓形虫病爆发也能带来畜牧业的重大经济损失,动物弓形虫感染的阳性率为0.35%~85%,常呈现局部暴发流行[5]。近年来,猪弓形虫病的相关报道日渐增多,在我国能够自然感染弓形虫的15种动物中,猪的感染阳性率最高。20世纪80年代,猪无名热正是猪弓形虫病引起。因弓形虫病猪与猪瘟病猪症状类似,且多伴有混合感染或继发感染,所以对养猪业造成的影响较大[6]。棒状体是寄生虫的一种细胞亚器,蛋白组学研究表明,弓形虫棒状体共分泌30多种蛋白,根据在棒状体内的定位,这些蛋白可分为棒状体基部蛋白(rhoptry proteins, ROPs)和棒状体颈部蛋白(rhoptry neck proteins, RONs)两类。ROPs是弓形虫特异性蛋白,包括ROP2、ROP3、ROP4、ROP5、ROP7、ROP8、ROP16、ROP18等,可调控弓形虫入侵、生长、毒力及纳虫空泡(parasitophorous vacuole, PV)形成过程[7-9]。一般将ROPs分为ROP1和ROP2两个蛋白家族。与ROP1蛋白家族相比,ROP2蛋白家族成员众多,包括ROP2、ROP4、ROP5、ROP16以及ROP18。大部分ROP2家族成员能在虫体入侵时定位于纳虫空泡膜(parasitophorous vacuole membrane, PVM),起联系宿主细胞和PV的作用,该类蛋白的丝氨酸、苏氨酸激酶区发挥着重要作用[10]。ROP18是一种丝氨酸—苏氨酸激酶,是弓形虫毒力最重要的蛋白之一,被认为是弓形虫入侵的关键毒力因子[11-12],ROP18基因位于染色体Ⅶa,接近编码标记CS3的基因[13-14]。研究表明,ROP18单独或与ROP5组合分析可以有效地测定新型弓形虫分离株对小鼠的毒力[15]。ROP16几乎与ROP18同时被发现,亦为重要毒力因子[16-17],其与宿主细胞内STAT3、STAT6发生磷酸化,干扰宿主细胞内信号通路传导[16]。Yamamoto等[18]证实Ⅰ型弓形虫ROP16缺陷株不能激活STAT3,从而导致IL-6和IL-12 p40上调。进一步比较Ⅰ型和Ⅱ型弓形虫虫株ROP16间差异,发现Ⅱ型虫株激酶区存在一个关键氨基酸替代,导致其在胞内STAT3的磷酸化水平有较大差异。综上所述,棒状体蛋白ROP16在虫体入侵宿主、PV形成和毒力作用方面发挥着重要作用,是弓形虫毒力调节因子,在弓形虫逃避宿主的免疫应答中起着非常重要的作用[18]。由于弓形虫Ⅰ、Ⅱ、Ⅲ型和不同分离虫株毒力存在差异,以Ⅰ型标准虫株为参考,旨在研究不同来源虫株TgROP16的序列遗传演化分析,为了解我国弓形虫的流行趋势和遗传进化提供参考,也为弓形虫通用免疫制剂的研制提供靶标。
1 材料与方法
1.1 试验材料
1.1.1样品来源 弓形虫ME49株、RH株、VEG株、PRU株均来自华南农业大学兽医学院寄生虫教研室;其他样品来自广东省某动物园(表1)。

表1 弓形虫株样品来源Table 1 Details of T.gondii isolates used in the study
1.1.2主要试剂 1×PBS为HyClone公司产品;限制性内切酶BamHⅠ、HindⅢ、XhoⅠ、TaqDNA 聚合酶均为TaKaRa公司产品;DNA Kit试剂盒、小提质粒试剂盒、UNIQ-5柱式DNA胶回收试剂盒均购自TIANGEN生物技术有限公司;DH5α感受态细胞为全式金公司产品。引物合成和测序由上海生工生物工程有限公司完成。
1.2 方法
1.2.1样品DNA 的提取 将冻存的弓形虫ME49株、VEG株、PRU株从液氮中取出,立即放入37 ℃的温水中解冻,待完全融化之后腹腔注射健康的BALB/c小鼠。经过3~5 d,小鼠出现被毛粗乱、弓背闭目、精神萎靡、腹部膨大等症状后脱颈处死,向腹腔注入1 mL 1×PBS冲洗腹腔,收集腹腔液。将抽取的腹腔液注入到空白小鼠腹腔内,传代3次,以保持弓形虫的感染活力和毒力,收集腹腔液,-20 ℃冰箱保存备用。样品虫株及环尾狐猴源、人源、猪源共4株弓形虫临床分离株使用TIANamp Genomic DNA Kit试剂盒提取全基因组DNA。
1.2.2弓形虫ROP16基因的扩增及纯化 根据弓形虫ROP16(GenBank No. DQ116422.1)序列,用Primer Premier 5.0设计引物(F:5′-GAATT-CATGAAAGTGACCACGAAAG-3′,R:5′-GCGGC-CGCCTACATCCGATGTGAAGAAAGTT-3′)进行PCR扩增。
反应体系25 μL:12.5 μL 2×TaqPlus Master Mix,8.5 μL dd H2O,上下游引物各2.5 μmol·L-1,DNA样品2 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,64 ℃ 延伸30 s,72 ℃ 2.5 min,32个循环;72 ℃终延伸7 min。将PCR产物用10 g·L-1琼脂糖凝胶在1×TAE电泳液中电泳,按试剂盒说明回收纯化目的基因。
1.2.3弓形虫ROP16基因序列测定 将纯化的PCR产物克隆到pMD18-T载体上,构建pMD18-ROP16重组质粒,将其转化DH5a感受态细胞, 用含氨苄青霉素的LB平板筛选阳性克隆,并进行PCR酶切和序列测定。
1.2.4限制性片段长度多态性PCR(PCR-RFLP)分析 在0.5 mL EP管中分别加入dd H2O、限制性内切酶BamHⅠ、HindⅢ、XhoⅠ、Buffer、PCR产物,反应体系为20 μL,并根据各内切酶适宜的反应温度水浴2 h。酶切产物用1.0%的琼脂糖凝胶电泳观察并成像。
1.2.5弓形虫ROP16的序列分析及进化树的建立 用DNA Star软件对测序结果进行分析和比较。用MEGA 5.05软件建立系统进化树[19]。
2 结果与分析
2.1 不同宿主ROP16基因的序列分析
用提取的9株样品基因组DNA为模板,经PCR扩增均出现1条与预期片段(2 124 bp)大小一致的条带。测序结果分析发现,ROP16基因核苷酸序列的第68、242位等29个位点发生了变异(表2)。9株序列碱基中A+T含量在46.94%~47.03%,其中27处出现C↔T、A↔G、A↔C、G↔T突变,2处发生A↔T、G↔C突变。

表2 不同弓形虫样品ROP16基因碱基序列比较结果Table 2 Nucleotide polymorphisms of the ROP16 gene from different T. gondii strains
2.2 不同来源的ROP16 PCR-RFLP分析
9个扩增产物经限制性内切酶BamHⅠ、HindⅢ和XhoⅠ作用后均出现2条清晰的条带,其中经BamHⅠ酶切得到0.7 kb左右片段,经HindⅢ酶切得到0.5 kb左右片段,经XhoⅠ酶切得到0.6 kb左右片段(图1),该结果表明,不同分离株TgROP16的多态性无变化,作为弓形虫分型的Marker基因应当谨慎使用。
2.3 TgROP16序列分析及进化树的建立
9个样品弓形虫ROP16序列经DNA Star进行相似性比较,发现RH株和ME49株同源性最高,为100%,与猪源TgROP16同源性最低,为99.6%。环尾狐猴源TgROP16序列与猪源弓形虫ROP16同源性最低,为99.4%,RH株最高和ME49株,均为99.8%。人源血TgROP16序列与PRU同源性最低,为99.5%。猪源TgROP16序列与VEG和人源分离株TgROP16差异性最大,为0.7,以上结果表明,弓形虫在进化的过程中虽然感染宿主的种类繁多,但TgROP16基因的变异小、保守性高,不宜作为虫株进化历程和亲缘关系的标记分子。5株标准株和4株国内分离株的ROP16序列进化树分析(图2)显示,最大似然比为-3 170.349 9。
3 讨论
人和动物的弓形虫感染在世界范围内呈流行趋势。人可以通过摄入含有弓形虫组织包囊的未熟肉类,含有弓形虫卵囊的其他食物,或饮水引起感染。而通过位点酶切、PCR-RFLP和微卫星分型等分析手段,能够将从北美和欧洲分离到的绝大多数人源和动物源性的弓形虫虫株划入三个基因型谱系(Ⅰ、Ⅱ和Ⅲ)中。
ROP16也是由弓形虫棒状体分泌的一类丝氨酸——苏氨酸激酶,在弓形虫逃避宿主的免疫应答中起着非常重要的作用。弓形虫侵入宿主细胞时分泌并释放ROP16,后者最后被细胞核定位信号(nuclear local-ization signals,NLS)运输至细胞核内,在那里定位并发挥作用[20]。然而很少有针对不同样品弓形虫ROP16的序列分析。PCR-RFLP已经被广泛地应用于弓形虫基因分型[21],多分子标记的PCR-RFLP能更准确的鉴别寄生虫,但是需要大量的时间[22]。相对而言,单个分子标记的PCR-RFLP更简便和省时。5株标准株和4株国内分离株的弓形虫ROP16序列均含有一个BamHⅠ酶切位点、一个HindⅢ酶切位点和一个XhoⅠ酶切位点(图2),酶切结果表明,弓形虫ROP16序列存在多态限制性位点。本研究用TgROP16作为PCR-RFLP的标记分子,未能鉴别出传统的弓形虫Ⅰ型、Ⅱ型和Ⅲ型。
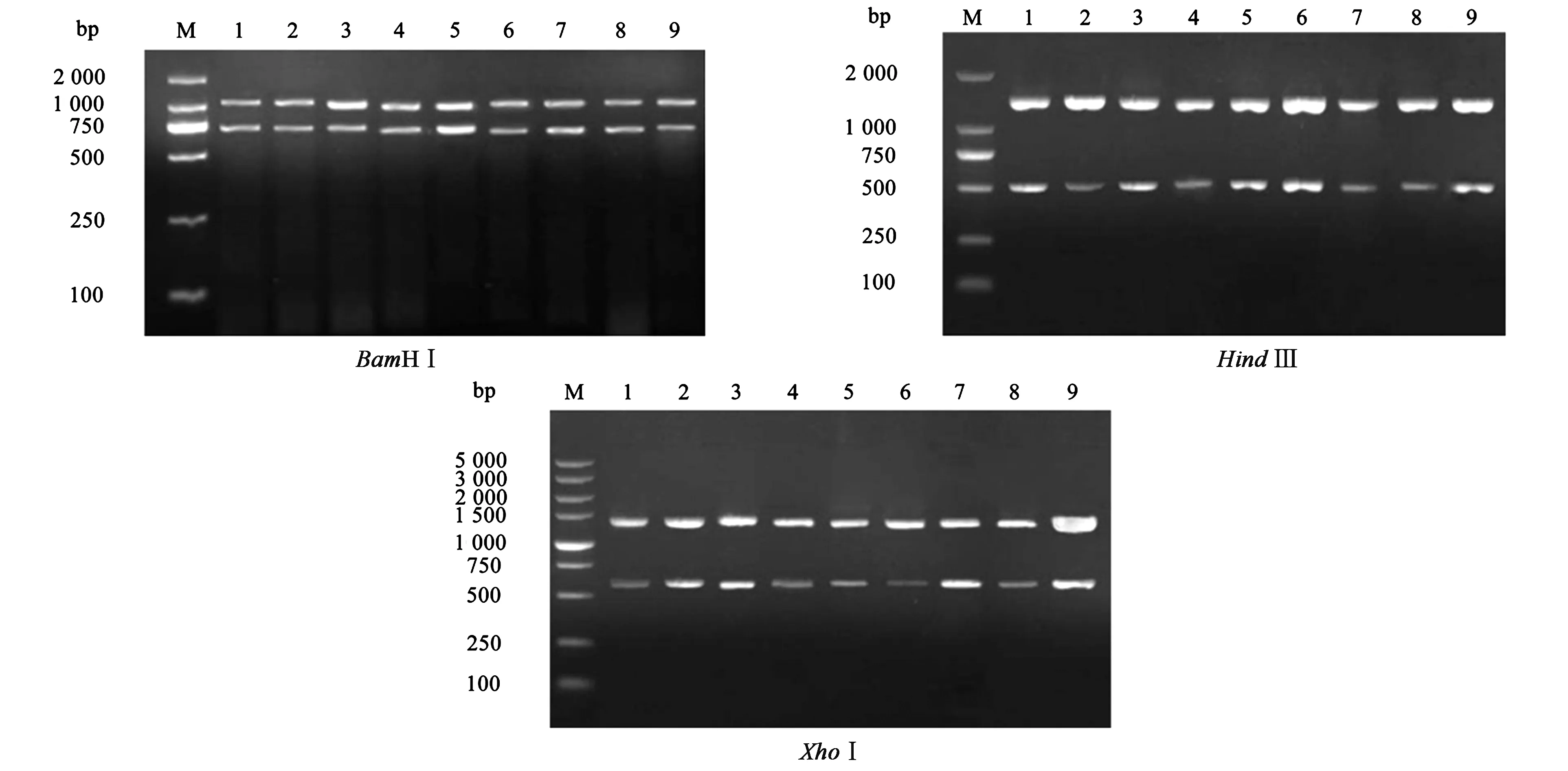
注:M为marker;1~9分别为弓形虫 RH株、ME 49株、PRU株、PTG株、VEG株、环尾狐猴源分离株、人源分离株1、人源分离株2、猪源分离株。Note: M is marker; 1~9 indicate T. gondii RH strain, ME 49 strain, PRU strain, PTG strain, VEG strain, ring-tailed lemur, human blood 1, human blood 2, and pig isolate, respectively.图1 不同分离株ROP16基因PCR片段酶切结果Fig.1 PCR-RFLP analysis of ROP16 fragments of T. gondii isolates using restriction endonucleases
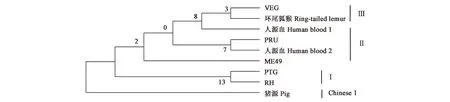
图2 不同分离株ROP16序列系统进化树Fig.2 Molecular phylogenetic anaylsis based on ROP16 sequence
根据传统的弓形虫分型,弓形虫Ⅰ型有RH株,ME49、PRU、PTG属于弓形虫Ⅱ型,VEG则是弓形虫Ⅲ型。本文以TgROP16序列为基础进行分析,发现PTG不能被划分为弓形虫Ⅱ型,与用弓形虫ROP38序列做进化树结果一致[23]。环尾狐猴同VEG一样被归为弓形虫Ⅲ型。人源血分离1和2分别被定义为弓形虫Ⅲ型和Ⅱ型,与很多感染弱毒性弓形虫株,症状不严重的病人一致。通过系统进化树分析,发现猪源弓形虫ROP16与其他虫株的同源性较低,是否为一个新的弓形虫分离株,需要进一步确认。
本研究所有样品扩增出的弓形虫ROP16序列全长均为2 124 bp。9种样品ROP16序列差异很小,其中核苷酸突变率为0~0.7%,低于弓形虫ROP47、ROP20、ROP17等序列[24-25];对比氨基酸发现有19处不同。之前已经有许多关于弓形虫ROP16的免疫保护性研究。Liu等[26]通过制备ROP16/GRA7 DNA疫苗评估了ROP16的免疫原性和反应原性。Yuan等[27]和Pan等[28]发现ROP16能诱导强烈的体液免疫和细胞免疫。这些结果表明:ROP16在不同分离株间非常保守,并能诱导强烈的免疫反应,是一个潜在的疫苗候选分子。
