棉花红腐病菌不同致病力菌株间毒素活性差异
2020-03-16刘梦丽李进张军高周小云杜鹏程郭庆元雷斌
刘梦丽, 李进, 张军高, 周小云, 杜鹏程, 郭庆元*, 雷斌*
(1.新疆农业大学农学院, 乌鲁木齐 830052; 2.新疆农业科学院核技术生物技术研究所, 乌鲁木齐 830091)
新疆光热资源丰富,适合发展棉花生产,现已成为我国最大的棉花生产、供给基地[1]。然而受连作年限长、极端天气不断增加等因素影响,棉花病害频繁发生、损失巨大。立枯病、红腐病是新疆棉区苗期主要病害,尤其拟轮枝镰孢霉(Fusariumverticillioides)引起的棉花红腐病,近年来发生危害渐增,并在适宜发病的条件下,造成缺苗断垄、产量和品质大幅下降[2-3]。拟轮枝镰孢霉侵入寄主植物后产生的毒素会抑制植物生长,导致寄主植物组织细胞损坏[4]。目前,已在玉米、小麦等农作物中分离出拟轮枝镰孢霉并检测到伏马菌素[5-7],Seo等[8]从拟轮枝镰孢霉菌株中分离出2种结构相似的伏马菌素,并分析了合成伏马菌素的必需基因。有学者认为镰孢菌(Fusarium)、立枯丝核菌(Rhizoctoniasolani)等的毒素对寄主植物形态及细胞病理反应有显著影响[9-11],能影响寄主植物的形态结构、细胞器结构及生理代谢[12-14]。潘月敏[15]研究发现,拟轮枝镰孢霉毒素对棉花胚根有抑制作用,且经毒素处理后的棉苗与接种病原菌的棉苗发病症状一致。以上关于病原菌粗提毒素在致病过程的作用机制研究主要集中在成分鉴定及其对寄主植物的毒害作用方面,而对不同菌株毒素的致病力差异缺乏系统深入研究。
鉴于拟轮枝镰孢霉毒素液的致毒成分是其侵染过程中的重要因素,并在寄主与病原物的互作中发挥重要作用,本研究利用3株致病力差异较大的棉花红腐病菌菌株,分别获得其粗毒素,研究粗毒素对棉种萌发、胚根生长、幼苗致萎和幼苗保护酶活性等的影响,旨在探明拟轮枝镰孢霉致病机理,明确寄主与病原菌间的互作关系,为利用拟轮枝镰孢霉毒素快速鉴定寄主抗病能力提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1菌株 选用编号为FAKS15-111、KYJS15-122、FBYL15-111的3个拟轮枝镰孢霉菌株作为供试菌株,其中FAKS15-111为弱致病力菌株,KYJS15-122为中致病力菌株,FBYL15-111为强致病力菌株[16]。菌株均由新疆农业大学植物病理实验室提供。
1.1.2棉花品种 供试棉花品种‘新陆早82号’(GossypiumhirsutumLinn.‘Xinluzao 82’)由新疆农业科学院核技术生物技术研究所化控实验室提供。
1.1.3培养液 选用马铃薯葡萄糖(potato dextrose,PD)培养液作为拟轮枝镰孢霉的产毒素培养液[15]。
1.2 试验方法
1.2.1拟轮枝镰孢霉毒素的提取 参照王立安等[17]方法提取拟轮枝镰孢霉毒素,略有修改。将病原菌接入PD培养液,调整培养液pH至9,置于温度为25 ℃、12 h/12 h光暗交替的人工气候箱中培养10 d,每隔6 h人工震荡1次;将培养好的菌悬液用2层纱布过滤掉菌丝,滤液经5 000 r·min-1离心,取上清液经121 ℃、20 min高压灭菌,获得病原菌粗毒素原液。粗毒素原液置于4 ℃冰箱保存,备用。
1.2.2棉花种子发芽胚根抑制试验 将3株病原菌粗毒素原液依次梯度稀释,分别稀释0、2、10、100和1 000倍,将发芽纸完全浸入不同浓度的粗毒素液中,浸泡24 h;分别在各发芽纸上均匀摆放50粒饱满棉种,以蒸馏水浸纸作为对照(CK1),每个处理重复3次。将装有种子的发芽纸放入密封袋中,置于25 ℃培养箱,培育4 d,逐粒检查棉花种子的萌发情况,测定胚根长度,并计算萌发率(G)和胚根抑制率(Ir)[18]。
G=N1/N×100%
Ir=(LCK-LT)/LCK×100%
式中,N1和N分别代表发芽种子数和供试种子数,LCK和LT分别代表对照胚根平均长度和处理胚根平均长度。
1.2.3粗毒素原液处理后的棉苗培育 因粗毒素原液毒素活力最高,毒力最强,本研究采用粗毒素原液作为水培处理溶液。取无菌土培养至两叶一心的棉苗,用蒸馏水反复冲洗根系3遍后,分别水培于装有FAKS15-111、KYJS15-122和FBYL15-111三种病原菌粗毒素原液的三角瓶中,不含毒素液的PD培养液为对照(CK2),共计4个处理,每个处理3个重复。
1.2.4棉苗致萎试验 分别在水培液处理12、24、36和48 h观察记载棉苗反应情况。植株反应级别分为无反应、轻度反应、中度反应和重度反应[15]。无反应,植株正常,叶片无萎蔫;轻度反应,叶片轻度黄化或轻度卷曲;中度反应,叶片大部分卷曲、黄化;重度反应,整个叶片卷曲至枯死。
1.2.5棉苗根部电导率检测 分别在水培液处理12、24 、36 和48 h时,随机取出3株棉苗测定电导率。参照张宪政[19]测定棉苗根系电导率,并计算相对电导率(relative electric conductivity, REC)。
REC=(CB-CCK)/(CA-CCK)×100%
式中,CA和CB分别代表30 ℃水浴处理电导率和沸水浴电导率,CCK指纯净水的电导率。
1.2.6棉苗根系保护酶活性测定 分别在水培液处理4、12、24、36和48 h时,取出棉苗根系,蒸馏水冲净表面残留粗毒素液,利用4种酶活测定试剂盒(南京建成生物工程研究所)分别测定SOD、PAL、POD和PPO活性。
1.3 数据分析与统计
用Microsoft Excel 2010统计数据,SPSS 21.0软件进行数据分析。
2 结果与分析
2.1 不同菌株及其不同稀释浓度粗毒素液对棉花种子发芽的影响
不同毒素处理的棉花种子发芽和胚根抑制结果见表1,可见,粗毒素原液处理下,3株致病力不同的病原菌毒素溶液对棉种萌发率及胚根生长抑制率的表现有差异,菌株致病力越强,其毒素溶液处理的棉种萌发率越低,胚根抑制率越高。致病力最强的FBYL15-111菌株毒素处理的种子萌发率最低,为17.67%,胚根生长抑制率最高,达到91.11%。菌株毒素溶液稀释倍数越高,棉种萌发率越高,胚根生长抑制率越低,当毒素液稀释度为1∶1 000时,无论病原菌致病力强弱,毒素溶液处理后的棉苗萌发率与对照无显著差异。经双因素方差分析(表2)表明,稀释倍数和菌株对棉苗胚根抑制率均有极显著影响(P<0.01);而稀释倍数对棉种萌发率的影响达到极显著水平(P<0.01),菌株对萌发率具有显著性影响(P<0.05)。
2.2 粗毒素原液浸根对棉苗的致萎作用
不同菌株粗毒素原液对棉花的致萎结果统计见表3,可知,3株致病力不同的菌株所提粗毒素对棉苗表现出不同程度的致萎作用,其中强致病力菌株(FBYL15-111)所提粗毒素对棉苗的致萎速度快,致萎能力强。处理36 h后,FBYL15-111的毒素溶液使棉苗子叶和真叶重度卷曲,KYJS15-122、FAKS15-111的毒素溶液处理的棉苗叶片萎蔫、黄化;处理48 h后,FBYL15-111、KYJS15-122毒素液中的棉苗枯死、根部发生腐烂,而对照(CK2)棉株生长正常。
2.3 粗毒素原液处理对棉苗根部电导率的影响
不同菌株毒素原液处理的棉苗根部电导率结果(图1)表明,随着处理时间的延长,3个菌株粗毒素原液处理的棉苗根系相对电导率逐渐升高。前12 h,各处理的棉苗根系相对电导率差异不大;处理48 h后,3个菌株粗毒素原液处理的棉苗根系相对电导率较对照(CK2)分别高1.48、1.23和0.90倍。由此可知,拟轮枝镰孢霉毒素处理可使细胞膜透性增加,且菌株致病力越强,细胞膜受伤害的程度越大。
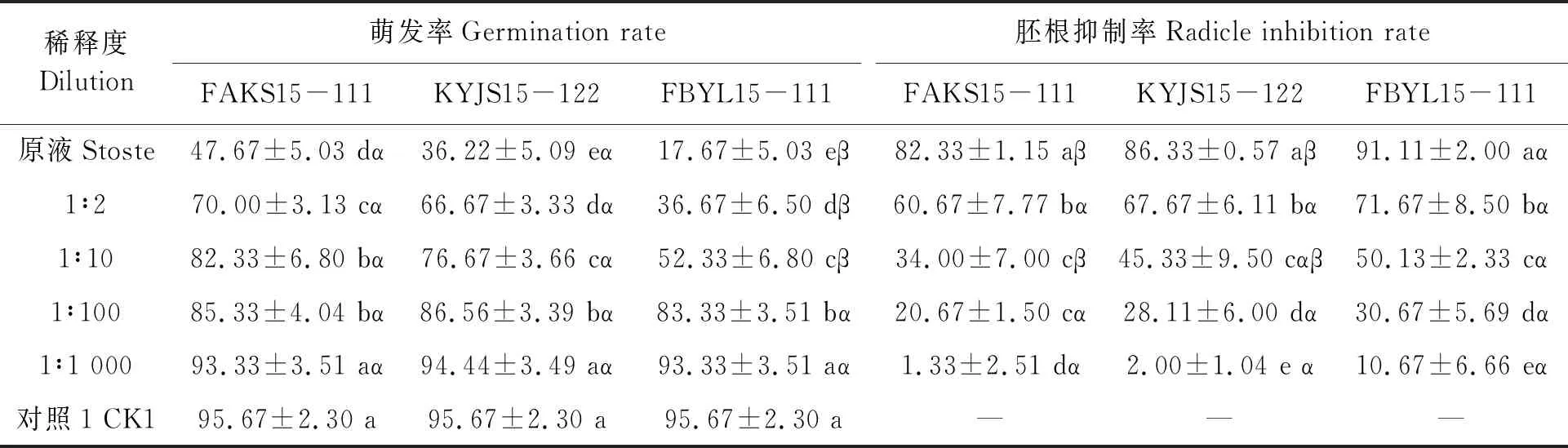
表1 不同菌株及其不同稀释度毒素液处理的棉花种子萌发率和胚根抑制率Table 1 Germination rate and radicle inhibition rate of cotton seed under different treatments (%)

表2 萌发率及胚根抑制率双因素方差分析Table 2 Analysis of variance of germination rate and radicle inhibition rate

表3 不同菌株毒素对棉苗的致萎作用Table 3 Lethal effect of toxin produced by different strains on cotton seedlings

图1 棉苗根系相对电导率Fig.1 Relative conductivity of cotton seedling roots
2.4 不同处理棉苗根系的PAL、PPO、POD及SOD酶活性
由图2可知,经病原菌毒素原液处理后,棉苗根系SOD、PAL、POD和PPO酶活性均呈先增高后降低的趋势,不同处理的PAL活性均在处理12 h时到达峰值,不同处理的PPO、POD和SOD活性均在处理24 h时达到峰值;而对照处理(CK2)的棉苗根系中4种酶活性在各个处理时间段差异不大。毒素处理4 h时,各处理的4种酶活性均显著高于CK2处理,其中FBYL15-111、KYJS15-122及FAKS15-111处理的SOD酶活性分别比CK2高出143.17%、118.03%及80.03%。毒素处理12 h时,各处理PAL酶活力达到最大值而后逐渐降低,其中FBYL15-111毒素处理的棉苗根系PAL活力最高,达到(30.79±1.72)U·mg-1蛋白;FBYL15-111毒素处理后SOD酶活性显著增高,比CK2高出209.66%;POD、PPO酶活性变化不大。毒素处理24 h时,各菌株毒素处理的SOD、PPO及POD酶活力均达到最大值,FBYL15-111所提毒素处理的PPO活力变化明显,达到(85.74±1.49)U·mg-1蛋白;FBYL15-111的SOD活力上升最快,在处理24 h时比CK2高出67.99%。毒素处理36 h时,各处理的SOD、PPO及POD酶活性逐渐下降,致病力弱菌株FAKS15-111的PPO活力与CK2无显著差异。毒素溶液处理48 h时,菌株FBYL15-111的PAL、PPO及POD酶活性仍然为最大,与FAKS15-111的SOD酶活性无显著差异,FAKS15-111与KYJS15-122的POD酶活性差异不显著。
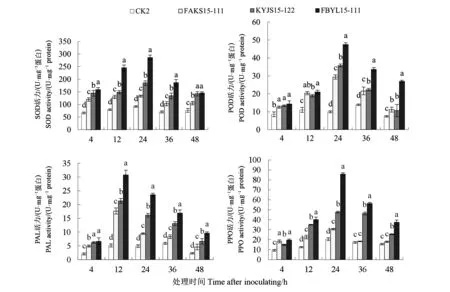
图2 棉苗根系的PAL、PPO、POD及SOD活性Fig.2 Activities of PAL, PPO, POD and SOD in roots of cotton seedlings
3 讨论
毒素作为病原菌侵染过程重要的致病因子之一,不仅造成植物细胞和组织凋萎死亡,还产生过量的生长调节物质,致使植物体内一些与抗病相关的防御性酶的活性发生改变[20-21]。
冯云程等[22]研究表明,菌株产毒量与菌株致病性强弱呈正相关,且毒素浓度越高,作用越明显;还发现,利用粗毒素对水稻幼苗进行致萎力研究的方法,表现出更高的试验灵敏性。本研究提取不同致病力拟轮枝镰孢霉菌株毒素侵染棉苗,经生物活性测定表明,致病力不同的菌株所提粗毒素液及其不同浓度溶液对棉花种子的萌发率、胚根抑制率均有一定影响;且粗毒素液浓度越高,棉种萌发率越低,其胚根抑制率越高。此外,菌株致病力越强,其毒素对棉苗的致萎作用越强。棉苗经拟轮枝镰孢霉毒素液处理后,其根系细胞由于细胞膜透性增加,电解质外渗,使细胞浸出液相对电导率增加,且强致病力菌株对其相对电导率影响最大,而对照处理的相对电导率变化不大。这一结论与田雪亮等[23]研究的拟轮枝镰孢霉粗毒素对玉米幼苗根系以及对小麦根系的影响结果一致。
当植物被病原菌侵染时,植物体内的一些与抗病相关的防御酶被激活,防御酶在植物细胞抵御外界逆境因子的胁迫过程中起重要作用[24]。SOD、POD、PPO及PAL都是与植物体抗逆相关的酶,SOD是生物体内重要的抗氧化酶,可对抗与阻断因氧自由基对细胞造成的损害。POD的主要作用是将过氧化氢水解,是评价植物组织细胞老化的一项重要指标。PPO通过催化木质素及醌类化合物形成,构成保护性屏障从而使植物细胞免受伤害。PAL是链接初级代谢和苯丙烷代谢的关键酶和限速酶[25-26]。本研究中,棉苗根部细胞PAL酶活性在12 h时就出现最大值,说明在毒素胁迫初期,棉苗就能通过提高细胞中PAL酶活性来抵抗病原菌侵染,这与张笑宇等[27]对马铃薯黑痣病病原菌毒素的研究结果一致。然而,研究者在研究毒素胁迫不同作物对防御酶活性影响所得的结论有差异,如松针褐斑病菌毒素对紫茎泽兰叶片细胞内的酶活性有抑制作用[28],而玉米大斑病病原菌毒素对玉米幼根的SOD、PAL、POD、PPO 4种酶活性的影响,均为先升高后降低的趋势[29]。本研究中,随着毒素对棉苗根系处理时间的延长,SOD、PAL、POD、PPO 4种酶活性都呈现出先适度升高后逐渐降低的趋势,且均在处理12~24 h左右出现最大酶活性。说明棉苗根部细胞在遇到毒素胁迫时首先需要一个适应过程,这段时间防御酶系统逐渐启动,是棉苗体内防御酶系统最活跃、生理生化反应最强烈的阶段。
