钩状木霉在辣椒根际定殖动态及其对辣椒疫病的生物防治
2020-03-15赵兴丽陶刚娄璇顾金刚
赵兴丽, 陶刚, 娄璇, 顾金刚
(1. 贵州省农业科学院生物技术研究所,贵阳 550006; 2. 贵州民族大学生态环境工程学院,贵阳 550025; 3. 贵州省农业科学院, 贵州省农业生物技术重点实验室,贵阳 550006; 4. 贵州师范大学生命科学学院,贵阳 550000; 5. 中国农业科学院农业资源与农业区划研究所,中国农业微生物菌种保藏管理中心,北京 100081)
辣椒是我国重要的经济作物,全国辣椒种植面积200万 hm2,产量达到4 000万t,产值超过700 亿元,占蔬菜种植面积12%以上[1]。辣椒疫病主要是由辣椒疫霉 (Phytophthoracapsici)引起的毁灭性真菌病害[2]。辣椒疫霉主要以卵孢子和厚垣孢子的形式在植物种子、土壤和宿主植物的病残体中越冬,当温度与湿度适宜时萌发,侵染植物致其发病死亡[3]。辣椒疫病多发生在辣椒现蕾挂果时期,田间扩展迅速,常造成大面积成片死亡[4]。目前,辣椒疫病防控仍以化学防治为主,如甲霜灵、精甲霜灵等苯酰胺类杀菌剂能够有效防治辣椒疫病[5],但化学药剂的使用使辣椒疫霉菌逐步产生一定程度的抗药性[6-7]。
近年来,许多研究表明,多种生防菌对辣椒疫病具有生物防治作用,包括木霉菌(Trichodermaspp.)、丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)及枯草芽孢杆菌(Bacillussubtilis)等[8-10]。辣椒疫病的生物防治主要是指利用微生物抑制辣椒疫霉的活性及繁殖能力,甚至杀灭病原菌的方式,来减轻和防治辣椒疫病的发生[11]。生防菌通过与病原菌竞争营养和生存空间,调节宿主内源激素平衡促进植株生长,提高宿主防御酶活性,诱导病程相关蛋白表达,产生次级代谢物及抗生素,改变宿主根系形态结构,使宿主通过有效阻挡病原菌侵入等方式防治植物病害的发生[12]。木霉菌是一类自然界广泛分布的真菌资源,很多种类对植物病害具有重要的生物防治作用。研究表明,木霉菌至少对l8个属29余种病原真菌和多种病原细菌有拮抗作用[13-15]。其中,在辣椒疫病生物防治方面,许多木霉种类,如棘孢木霉(Trichodermaasperellum)、钩状木霉(Trichodermahamatum)和俄罗斯木霉(Trichodermarossicum)能通过重寄生或产生挥发性和非挥发性抑菌化合物抑制辣椒疫霉的生长[16-19];刘青等[20]从腐木和土壤中分离得到绿色木霉(Trichodermavirens)、棘孢木霉(T.asperellum)、钩状木霉(T.hamatum)与哈茨木霉(Trichodermaharzianum) 4个种的11株木霉菌株都能对辣椒疫霉菌有一定程度的抑制作用。生防菌定殖能力的强弱是评价其生防潜力的重要指标[21-22]。木霉菌生防作用的实现,在很大程度上取决于木霉在繁殖阶段与栖居微生物的竞争能力,较强的吸附和繁殖能力是木霉竞争其他微生物的决定因素。进行强定殖能力的菌株筛选或者采用分子生物学技术有目的地增强木霉在植物表面或内部的定殖能力,可以有效提高木霉的生物防治能力和促生效果[23]。
本研究以钩状木霉菌ACCC31649为试验材料,在本实验室前期绿色荧光蛋白(GFP)标记该菌株的基础上,构建钩状木霉(ACCC31649-GF21)GFP标记真菌、辣椒及其重要土传病害辣椒疫病菌(P.capsici)的三者互作体系,结合平板拮抗试验和温室盆栽试验,研究钩状木霉菌在辣椒植株及根际中的定殖能力,以及对辣椒疫病的生物防治效果,为木霉菌生防机理研究和生防菌剂的开发应用提供科学依据。
1 材料与方法
1.1 供试材料
钩状木霉菌株(T.hamatum) ACCC31649由中国农业科学院农业微生物菌种保藏中心提供;ACCC31649-GF21由贵州省农业科学院植物保护研究所生防研究室进行GFP标记并保存[24];辣椒疫霉菌(P.capsici)由中国农业科学院农业微生物菌种保藏中心提供;供试辣椒品种‘极品青龙’为感辣椒疫病品种,种子由海南昊丰实业有限公司生产。
PDA培养基:200 g土豆放入1 000 mL水中煮30 min过滤,定容至1 000 mL,加入琼脂粉15~20 g,葡萄糖20 g,自然pH;PDB液体培养基:未加琼脂粉,其它成分同PDA培养基。
1.2 钩状木霉菌对辣椒疫霉菌的拮抗试验
1.2.1平板对峙法 钩状木霉菌和辣椒疫霉菌活化5 d后,用直径为5 mm的打孔器各取一个菌饼置于相距5 cm的PDA平板中心两侧,使钩状木霉菌和辣椒疫霉菌之间距离约为5 cm,5个重复,以单接种辣椒疫霉菌为对照,用封口膜封口,28 ℃黑暗培养5 d。
1.2.2抑菌圈法 取6个直径为5 mm的钩状木霉菌菌饼接种于120 mL PDB培养液中,150 r·min-1、 28 ℃振荡培养6 d,经3层灭菌纱布过滤后,得到的上清液分为2 份,一份7 830 r·min-1离心10 min后,再经孔径为0.22 μm滤膜过滤处理,另一份不做任何处理;将上述两种处理的上清液分别取4、6 和8 mL滤液加入100 mL PDA培养基中,混匀倒平板,待平板冷却后,取直径为5 mm的辣椒疫霉菌菌饼接种于含不同浓度的钩状木霉菌发酵液的PDA平板上,以不加钩状木霉菌发酵液的PDA培养基为对照,5个重复,25 ℃培养5 d。
生长抑制率= (对照菌落直径-处理菌落直径)/ 对照菌落直径×100%
1.2.3显微观察法 活化5 d的辣椒疫霉菌与钩状木霉菌接种于PDA平板的中心两侧,两个菌饼中间放置2片灭菌处理的盖玻片,28 ℃黑暗培养至两侧菌丝接触生长。用镊子将培养基上长有菌丝的盖玻片取出,制成水玻片,荧光显微镜下观察。
1.3 钩状木霉菌对辣椒疫病的生物防治试验
1.3.1辣椒种子催芽及辣椒苗培育 挑选籽粒饱满、大小均匀的辣椒种子,表面消毒(3% NaClO,1 min;75% 酒精,1 min)后备用。将消毒后的种子均匀平铺在铺有灭菌纱布的保鲜盒中,覆盖一层灭菌纱布,加入适量的无菌水使纱布湿润,密封,28 ℃黑暗下催芽。待种子萌发出白色根尖后播种于装有灭菌营养土的育苗钵中,长至4叶期和六叶一心时备用。
1.3.2钩状木霉在辣椒根际土壤中的定殖 将钩状木霉活化培养6 d后,加无菌水洗木霉菌培养平板,制成分生孢子悬浮液,血球计数板计数调整浓度为1×106conidia·mL-1。取2 mL分生孢子液加入到120 mL PDB培养液中,28 ℃,150 r·min-1振荡培养6 d,4层灭菌滤纸过滤,调整其浓度为1×107conidia·mL-1。取上述4叶期辣椒幼苗,灌根接种10 mL钩状木霉菌的孢子悬浮液,26/22 ℃,14 h光照/10 h黑暗交替培养。
上述处理培养后,每隔24 h取样制备根、茎和叶片组织水玻片,通过荧光显微镜观察记录,并每隔8 d进行一次辣椒植株根际土取样,观察木霉菌根际定殖动态。首先将辣椒植株从花盆中整体轻轻取出,去除根外围土壤,收集辣椒根际土壤,室温静置风干;取5 g土样加入50 mL无菌水,并于28 ℃,150 r·min-1振荡1 h,使土壤中的微生物均匀分散,静置20~30 s后,取土样稀释液滴于血球计数板,荧光显微镜下镜检并统计钩状木霉菌分生孢子,计算孢子数量。
稀释液孢子数 (conidia·mL-1)=400个小格菌总数×104×稀释倍数
孢子数 (conidia·g-1)=(每毫升稀释液的孢子数×稀释土壤用水量)/土壤重量
1.3.3钩状木霉菌对辣椒植株的促生
①辣椒疫霉菌接种液准备:将辣椒疫霉菌活化培育5 d后,用孔径为5 mm打孔器挖取菌饼,取6个接种于120 mL PDB培养液中,150 r·min-1、25 ℃振荡培养7 d,通过粉碎搅拌器将菌丝打碎制成菌悬液,备用。
②取六叶一心的辣椒幼苗,首先按上述方法准备浓度为1×107conidia·mL-1的钩状木霉菌孢子悬浮液,取15 mL灌根接种于辣椒幼苗根围土壤中,并将其移栽到花盆中。定殖生长7 d后,再取15 mL上述辣椒疫霉菌悬液接种于辣椒幼苗根围。试验设单接种辣椒疫霉菌悬液(PC)、接种钩状木霉菌和辣椒疫霉菌孢子悬浮液(Th+PC)两个处理,以PC为对照,每个处理15盆,共30盆。
上述处理的辣椒植株置于小温室中培养,培养条件:26/22 ℃,14 h光照/10 h黑暗交替。每天灭菌蒸馏水浇水一次,每盆大约5 mL。17 d后,选择健康植株测定辣椒植株的株高、根长、茎粗、鲜重和干重等数据。
促生率=(处理植株干重-对照植株干重)/对照植株干重×100%
1.3.4钩状木霉菌对辣椒疫病的防治 辣椒种子催芽和育苗方法同1.3.1。试验设置2个处理,以单接种辣椒疫霉菌悬液为对照,接种20盆,同时接种钩状木霉菌和辣椒疫霉菌的处理51盆,共71盆。接种处理后,每隔24 h取不同处理的辣椒幼苗,徒手切片,制备根、茎和叶片组织的水玻片,在荧光显微镜下观察,每次取2株,同时记录辣椒植株病害情况,病害调查及分级标准按照方中达[25]方法进行。
病害分级标准:0级—完全无病;1级—外叶茎部有局部病症 (黑褐色至黑色、溢缩);2级—外叶茎部溢缩变色部分在1/3以下,或外叶少数蔫萎 (脱落);3级—全株1/3以上出现溢缩变色,或倒伏,叶片脱落,枯死。相关指标计算公式如下。
发病率=(发病株数/调查总株数) ×100%
防治效果=(未发病株数/调查总株数) ×100%
病情指数=[Σ(各级株数 × 各级代表值)/(调查总株数×最高级值)] × 100%
1.4 数据统计与分析
数据均采用Microsoft Excel 2010和DPS 7.05软件进行数据分析及方差分析,并用LSD法进行显著性(P<0.05)差异分析。
2 结果与分析
2.1 钩状木霉菌对辣椒疫霉菌的抑制效果
对峙培养6 d,钩状木霉菌对辣椒疫霉菌生长抑制率可达49.8% (图1B)。通过抑菌圈法试验,当钩状木霉菌发酵液 (107conidia·mL-1的孢子悬浮液) 的加入量为6 mL时,其分生孢子能够完全抑制辣椒疫霉菌的生长 (图1C、1D),而当加入经滤膜过滤的无孢子的发酵液则没有拮抗辣椒疫霉的作用 (图1E、1F),说明木霉发酵液没有产生抑制疫霉的代谢物。通过荧光显微镜观察 (图2)发现,钩状木霉菌菌丝能够依附或缠绕在辣椒疫霉菌菌丝上生长,同时还发现大量钩状木霉菌分生孢子附着在辣椒疫霉菌菌丝上。
2.2 钩状木霉菌在辣椒根际中的定殖动态
灌根接种处理后,辣椒幼苗根际土壤中的钩状木霉菌的定殖量出现动态变化(图3)。在第1~25 d时,缓慢增长,第25 d后,出现急剧增长,接种第33 d时,钩状木霉菌的数量达到最大值,约为7.00×107conidia·g-1,然后定殖数量逐步下降,在第41 d,约为5.29×107conidia·g-1(图3C)。试验结果表明,钩状木霉菌能够在辣椒根际土壤中定殖和生长繁殖,呈现先增加后降低的动态变化过程。
2.3 钩状木霉菌对辣椒植株的促生作用
辣椒植株的株高、根长、茎粗、鲜重及干重结果(表1)表明,与单接种辣椒疫霉菌的对照相比,接种钩状木霉菌的辣椒幼苗的根长、鲜重、干重和含水量均显著升高,分别增加134.25%、111.97%、52.63%及121.14%。结果表明,钩状木霉能够有效促进辣椒植株的生长,促生率达到52.63%。

表1 钩状木霉与辣椒疫霉菌互作对辣椒植株生长的影响Table 1 Effects of the interaction between T. hamatum and P. capsici on the growth of pepper plants
2.4 钩状木霉菌对辣椒疫病的生防作用
2.4.1钩状木霉菌在辣椒植株中定殖 钩状木霉菌在辣椒植株的定殖结果见图4,可见,接种后24 h,钩状木霉菌在辣椒幼苗的根表皮定殖 (图4C、4D、4E);第3 d,钩状木霉菌在辣椒植株根部维管束中大量定殖并自内向外定殖于根部韧皮部 (图4F),部分可直接定殖于辣椒根部表皮 (图4G);第7 d,在主根与须根连接处的横切面和纵切面,可观察到大量木霉荧光菌丝定殖于根茎交接处 (图4H、4I)。接种7 d后,辣椒茎部表皮 (图4J) 及茎部木质部 (图4K) 有大量钩状木霉菌丝聚集,而且在辣椒植株的叶片 (图4L) 和叶柄 (图4M) 都能够检测到钩状木霉菌丝。结果表明,钩状木霉菌在辣椒植株的根、茎和叶组织中都能够定殖共生。
2.4.2钩状木霉菌对辣椒疫病的防治效果 直接对辣椒灌根单接种辣椒疫霉菌菌悬液2 d后,辣椒幼苗近地面茎部开始皱缩褐变;4 d后,辣椒幼苗大部分叶片开始萎蔫;5 d后,所有叶片都萎蔫且近地面的叶片开始脱落;7 d后,辣椒大部分叶片脱落,植株完全萎蔫;10 d后,干枯死亡 (图5)。
防治效果数据(表2)表明,单接种辣椒疫霉菌的处理中辣椒疫病的病情指数达到80.00%,而同时接种钩状木霉菌和辣椒疫霉菌的处理中辣椒疫病的病情指数明显降低,与对照相比,病情指数下降了50%,防治效果为53.33%。
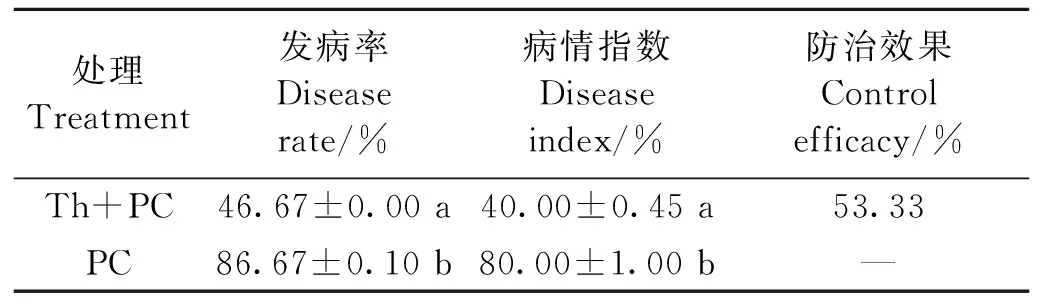
表2 钩状木霉对辣椒疫病的防治效果Table 2 Control efficiency of T. hamatum against pepper Phytophthora blight
3 讨论
生防木霉菌能够通过重寄生或产生挥发性和非挥发性抑菌化合物达到防控辣椒疫霉作用[17-19]。有些木霉种类作用于植物会表现出促进植物生长的现象。Chang等[26]通过哈茨木霉分生孢子液处理胡椒、长春花和菊花等植物的种子或根部后发现,胡椒的发芽率提高,长春花的花期提前,菊花的花朵数量增多,并且这些植物的株高及鲜重都有所增加,而番茄、黄瓜和胡椒干重也有明显增加。而Contreras-Cornejo 等[27]发现,绿色木霉和深绿木霉 (T.atroviride) 与拟南芥互作使野生型拟南芥生长加速,侧根增多,该过程与生长素含量增加有关。本研究通过荧光标记的钩状木霉对辣椒疫霉菌的互作抑制作用,证实了钩状木霉能够通过竞争作用抑制辣椒疫霉菌的生长,且木霉菌丝体能够依附或缠绕在疫霉菌丝上生长,其分生孢子也可附着在辣椒疫霉菌菌丝上并萌发,同时,钩状木霉还能够对染病辣椒有积极效果,能够有效促进受病害侵染后植株(包括根系及生物量等)的生长(表1)。钩状木霉促进辣椒植株生长发育的作用机制,还待进一步研究。
木霉菌不仅在土壤中广泛存在,也可在植物根、茎、叶的表面及组织内定殖。作为生防木霉菌在宿主植株及根际中定殖能力是评价其潜在生防能力一个重要标准[28]。本研究表明,钩状木霉ACCC31649-GF21 能够通过菌丝和孢子在辣椒不同组织中定殖,可通过侧根、根毛和根表皮的自然孔口或气孔侵入辣椒植株根内,经皮层到达根维管束系统。木霉菌能够成功进入宿主植物组织并与宿主形成一种和谐共生关系,这是一个复杂的过程。在这个过程中,木霉菌会产生多种化学物质以协助自身完成在植物表面和内部的生长和繁殖,其中大多是蛋白和多肽类物质,包括几丁质酶、蛋白酶、纤维素酶和β-1,3-葡聚糖酶等,这些酶类可以降解植物细胞壁以帮助木霉菌侵入和定殖,如哈茨木霉分泌的纤维素酶可以降解植物的细胞壁,从而使其进入到玉米根部的皮层组织中,纤维素酶的持续产生加速了木霉的定殖过程[29]。同时,木霉菌在植株及根际土壤中定殖是一个复杂的动态过程,会受到多种因素的影响,包括温度、土壤pH以及栖息微生物等[30-31]。已有研究表明,木霉菌在与栖居微生物竞争时,因有较强的定殖能力而具有明显的优势,从而有效抑制病原菌生长[23,32-33]。本研究通过GFP标记的钩状木霉菌,利用荧光显微镜直接对钩状木霉菌在辣椒根际和辣椒组织中进行实时动态定殖研究,发现钩状木霉菌能在辣椒根际土壤中长时间定殖和生存,呈现逐步增长达到一个最大数值,然后逐步下降的动态变化过程。杜婵娟等[34]也对土壤垂直和水平空间的木霉定殖特点进行了研究,并探讨了土壤含水量和pH对木霉在土壤中的定殖数量变化影响。本研究结果为生防木霉菌与辣椒病害及宿主辣椒植物之间的互作和生防作用的进一步研究提供了重要的科学依据和理论基础,也为木霉菌剂在土壤中的施用方式、施用条件及间隔时间等田间应用提供科学指导和借鉴。
