三叶木通愈伤诱导及分化研究
2020-03-15贾明良方荷芳李同建文锋韩兴杰金洪光徐玲玲廖亮
贾明良,方荷芳,李同建,文锋,韩兴杰,金洪光,徐玲玲,廖亮
(九江学院药学与生命科学学院,江西 九江 332000)
三叶木通[Akebiatrifoliate(Thunb.) Koidz.]为木通科(Lardizabalaceae)木通属(AkebiaDecne.)藤本植物,以其藤茎入药,具有利尿通淋、清心除烦、通经下乳功效[1]。此外,三叶木通作为一种新型水果资源也逐渐受到重视,其果肉清甜可口,可鲜食,具有很高的营养价值[2],进一步深加工可制作果汁[3]、果酒[4]、果茶[5]、果脯[6]等产品。三叶木通种质资源的开发利用已有报道,如利用野生资源进行驯化及进一步人工栽培[7-8]。对不同种质资源的繁殖方式也有研究,如利用种子进行播种繁殖[9],利用枝条进行扦插繁殖[10-13]等。种子繁殖容易产生性状分离,扦插繁殖系数相对较低且不利于进一步的品系改良,因此,有学者进行了三叶木通的植物组织培养研究,如沈国林等[14]比较了不同外植体、培养基、pH、温度、光照、植物生长物质种类及其配比等对三叶木通愈伤组织诱导的影响;刘香[15]研究发现,适当的超声波处理可促进三叶木通愈伤组织的诱导;黎世龄等[16]则对三叶木通胚乳进行了愈伤组织的诱导研究。以上研究均集中在愈伤组织的诱导上,并未进一步诱导产生胚状体或丛生芽。除了愈伤组织诱导以外,苏慧慧等[17]以下胚轴为外植体诱导愈伤,进一步研究了愈伤组织的再分化及褐化抑制;石小兵等[18]以种子为外植体诱导产生不定芽,然后再利用秋水仙素进行染色体加倍得到多倍体。以上研究虽得到了丛生芽,但外植体类型为下胚轴或是种子,来源受到季节的限制。本文利用来源广泛的幼嫩枝条及叶片为外植体,对三叶木通无菌外植体获得、愈伤诱导以及胚状体诱导等过程进行了研究,同时分析了愈伤组织褐化的主要影响因素,以期建立三叶木通组织培养体系,为三叶木通优良品系扩繁及进一步的品系改良和遗传转化提供理论基础。
1 材料与方法
1.1 试验材料
试验所用材料来自江西省九江市九江学院木通种质资源圃栽培基地,以选育的三叶木通优良品系幼嫩茎段、叶片为外植体,茎段选取尚未木质化的幼嫩枝条,叶片则选用刚展开的幼嫩叶片,取材时间避开连续阴雨天,选择晴朗的上午,取材后将材料置于采样袋内,喷水保湿,尽快带回实验室进行下一步试验。
1.2 试验方法
1.2.1无菌外植体获取及接种前浸泡对褐化的影响 采用幼嫩的茎段及叶片为外植体,流水冲洗后,在超净工作台中用75%酒精消毒1 min,然后无菌水冲洗3次,再利用0.1%的氯化汞水溶液(升汞)进行灭菌处理,处理时间梯度设置为3、5、8、12、15 min,随后无菌水冲洗5次以洗净升汞残留,置于无菌瓶中待用。
将灭菌后的幼嫩茎段切割为长度0.5 cm左右,叶片则切割为0.5 cm2大小进行接种,接种至培养基MS+2,4-D 1.0 mg·L-1+蔗糖30.0 g·L-1+琼脂6.0 g·L-1中,每瓶接种5个外植体,每个处理接种6瓶,于培养室中培养20 d后,记录污染率、褐化率等生长情况。培养条件为:光照强度 1 500~2 000 lx,每天光照时间为12 h,温度(25±1)℃。
选择合适的灭菌处理,先将切割后的茎段及叶片在无菌水中浸泡3 min,再接种到培养基上,考察浸泡处理对褐化的影响。
1.2.2外植体愈伤组织诱导 表面灭菌处理后的幼嫩茎段切割为0.5 cm左右长,叶片切割为0.5 cm2大小,接种至添加不同浓度的2,4-D(0.2、0.4、1.0 mg·L-1)和NAA(1.0、2.0、4.0 mg·L-1)的MS培养基中,以不加激素的MS培养基为对照。每瓶接种5个外植体,每个处理接种6瓶,于培养室中培养20 d后,记录愈伤组织的诱导率、褐化率等生长情况。培养条件为:光照强度1 500~2 000 lx,每天光照时间12 h,温度(25±1)℃。
1.2.3培养方式对外植体诱导愈伤组织时褐化的抑制效果 以褐化严重的幼嫩茎段为外植体,考察固体培养、液体培养两种培养方式,分别添加不同浓度活性炭(activated carbon,AC),在见光、避光两种培养条件下对外植体诱导愈伤组织时褐化的抑制效果进行研究。固体培养添加琼脂6.0 g·L-1,液体则不添加琼脂;AC浓度设定为0、0.1、0.5、1.0、2.0、3.0 g·L-1。见光培养时光照强度 1 500~2 000 lx,每天光照时间12 h,避光培养除遮蔽光照外其余同光照培养。每瓶接种5个外植体,每个处理接种6瓶,培养20 d后,记录愈伤组织诱导率、褐化率等数据。
1.2.4愈伤组织再分化诱导胚状体 将已诱导出来的愈伤组织,接种至添加不同浓度的6-BA(0.2、0.4、1.0 mg·L-1)和NAA(1.0、2.0、4.0 mg·L-1)的MS培养基中培养60 d,观察记录胚状体诱导率及褐化率等数据。培养条件为:光照强度1 500~2 000 lx,每天光照时间12 h,温度(25±1)℃。
1.3 数据处理
采用Excel 2007、SPSS 18.0统计软件对试验数据进行统计分析。
2 结果与分析
2.1 外植体处理方式对愈伤组织诱导和褐化的影响
2.1.1适宜外植体的表面灭菌处理方法 对幼嫩茎段及叶片灭菌处理后接种培养,污染和褐化情况见表1。由表1可以看出,随着升汞灭菌时间的延长,茎段和叶片外植体的污染率均逐渐降低,而褐化率则由于升汞的毒害而逐渐升高。对比茎段和叶片外植体,在相同的灭菌强度下,叶片外植体的污染率和褐化率均较低。因此,叶片为三叶木通愈伤组织诱导时优先选用的外植体。综合考虑污染和褐化的情况,茎段和叶片合适的灭菌处理组合为:75%乙醇消毒1 min,然后升汞灭菌12 min,并用无菌水冲洗干净升汞残留后接种。此时虽然污染率不是最低,但是褐化情况较低,为合适的灭菌组合。

表1 灭菌条件对无菌外植体获取的影响Table 1 Effect of sterilization conditions on the acquisition of sterile explants
2.1.2浸泡处理对愈伤组织褐化的抑制效果 接种前进行浸泡处理对褐化的影响结果如表2所示。可以看出,同一灭菌处理下,不管是茎段还是叶片,接种前通过浸泡处理3 min后,均可降低褐化情况的产生。在浸泡后,可发现无菌水由无色透明变为茶色。

表2 接种前浸泡处理对外植体褐化的影响Table 2 Effect of immersion treatment before inoculation on the browning of explants
2.2 茎段及叶片外植体的愈伤组织诱导
不同激素配比下,茎段及叶片愈伤组织的诱导情况如表3所示。从表3可以看出,在不添加任何激素的A1培养基中,茎段和叶片均无愈伤组织产生。茎段愈伤的诱导在A7培养基内可以达到92.00%的诱导率,显著高于其他培养基。因此,选取A7为茎段愈伤组织的适宜诱导培养基,即为MS+NAA 0.4 mg·L-1+2,4-D 4.0 mg·L-1+蔗糖30.0 g·L-1+琼脂6.0 g·L-1,pH5.8。叶片愈伤诱导在A9培养基内诱导率最高,达到97.53%,应为叶片诱导愈伤组织的适宜培养基:MS+NAA 1.0 mg·L-1+2,4-D 2.0 mg·L-1+蔗糖30.0 g·L-1+琼脂6.0 g·L-1,pH5.8。此外,在A5及A6培养基上的愈伤组织诱导率也分别达到了94.43%和91.00%,也可作为备选培养基类型。
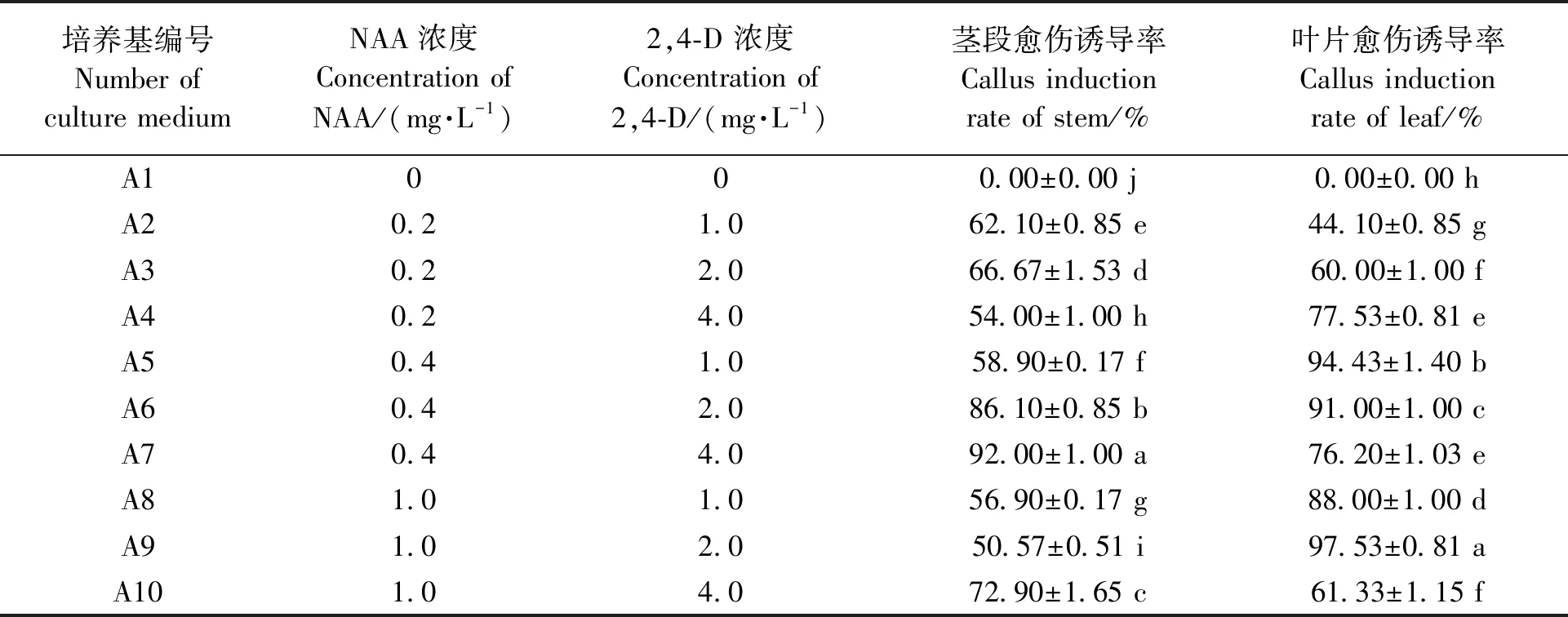
表3 不同激素配比对茎段及叶片愈伤诱导的影响Table 3 Effect of different hormone combinations on callus induction with stem and leaf
2.3 不同处理对外植体诱导愈伤时褐化的抑制效果
两种培养方式对外植体诱导愈伤时褐化的抑制效果见表4。固体培养条件下,见光及避光培养时,活性炭(AC)浓度的变化对愈伤的诱导有一定的影响。AC浓度在0~1.0 g·L-1时,愈伤诱导率虽有差异,但都在80%以上。以褐化率为标准,在见光培养时,AC浓度在1.0 g·L-1时最低,为7.33%;而避光培养时,在AC浓度在1.0 g·L-1时最低,为7.00%。横向比较见光及避光条件下的褐化情况,可以看出,在相同条件下,避光培养可以在一定程度上降低褐化的发生。由表4可以看出,液体培养时,不管是见光还是避光,不论在何种AC浓度情况下均不能诱导愈伤组织,所有的外植体均逐渐死亡。可见,液体培养不适合三叶木通茎段外植体的愈伤组织诱导培养。
结合2.1及2.2的结果综合考虑,可将外植体先用无菌水浸泡3 min,然后接种至MS+NAA 0.4 mg·L-1+2,4-D 4.0 mg·L-1+AC 1.0 g·L-1+蔗糖30.0 g·L-1+琼脂6.0 g·L-1的培养基中进行避光培养来诱导愈伤组织。
2.4 愈伤再分化诱导胚状体
将试验得到的愈伤组织接种至添加不同浓度的6-BA和NAA的MS培养基中,诱导再分化,结果见表5。从胚状体诱导情况来看,诱导率较高的培养基为B5,虽显著高于其他培养基,但也只有15.33%。其余的培养基类型条件下,则更低。诱导率虽低,但由于胚性愈伤组织可接种至相同培养基上进行增殖,因此,只要诱导得到胚状体即可进一步诱导成苗。因此,各处理中较好的胚状体诱导培养基为MS+NAA 0.4 mg·L-1+6-BA 2.0 mg·L-1+蔗糖30.0 g·L-1+琼脂6.0 g·L-1,pH5.8。从褐化率看,各培养基中褐化率都没有显著差异,且都较高,但低于见光培养和不加活性炭处理时100%褐化的情况。因此,前述外植体诱导愈伤组织时得到的褐化抑制的条件应用至愈伤组织增殖及胚状体诱导时,还需进一步进行优化。
诱导得到的胚性愈伤组织接种至胚状体诱导培养基,并不断去除褐化及生长不良的的组织后可得到生长较好的胚状体。由于每个胚状体为一个完整植物的雏形,将其挑出接种至不含激素的MS培养基中,可生长得到一棵完整的种苗。
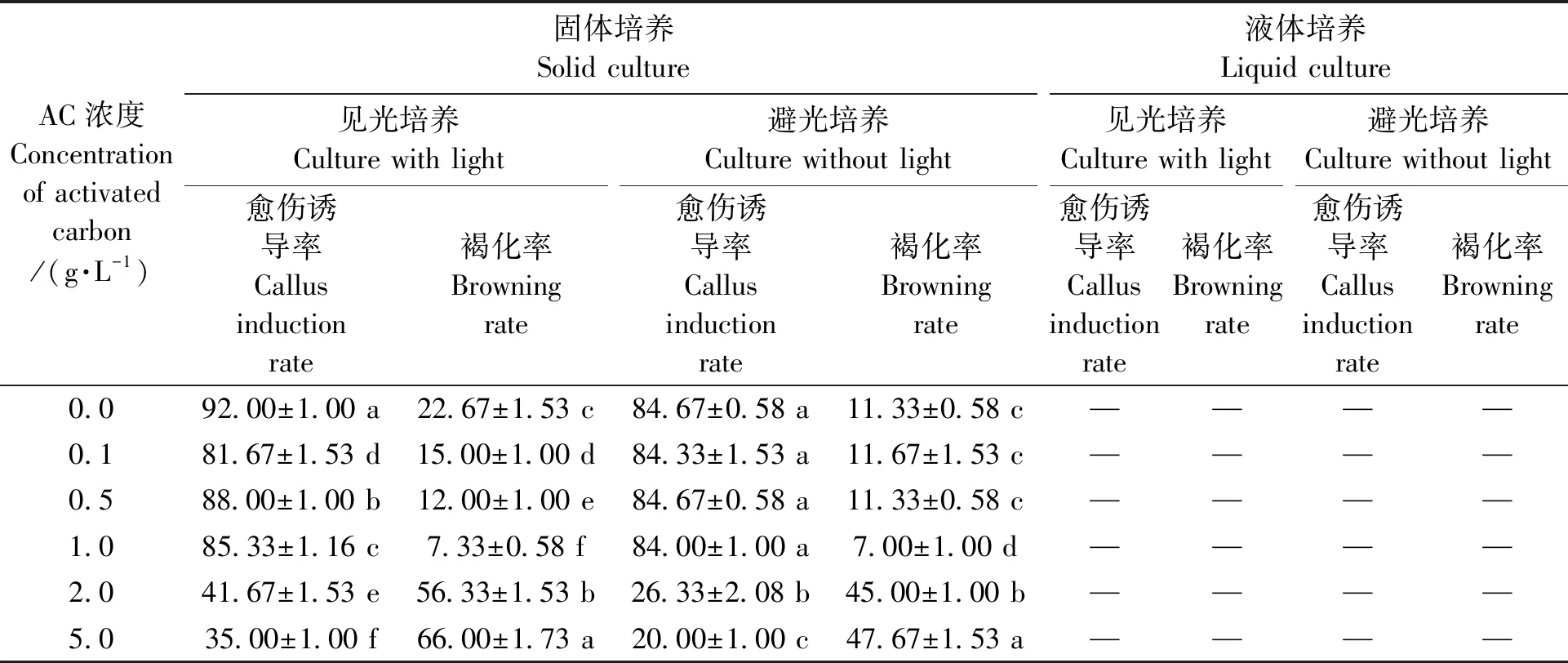
表4 不同培养条件对愈伤诱导及褐化的影响Table 4 Effect of different culture conditions on callus induction and browning (%)

表5 激素配比对胚状体诱导的影响Table 5 Effect of hormone combinations on induction of embryos

图1 三叶木通胚状体诱导及成苗Fig.1 Somatic embryo induction and seedling formation of Akebia trifoliate (Thunb.) Koidz.
3 讨论
本研究首先得出了合适的外植体灭菌条件,在接种前将外植体于无菌水中浸泡处理3 min,可显著降低褐化情况的产生,并且可观察到无菌水由无色透明状态变为茶色。分析原因可能是浸泡有利于产生褐化的酚类化合物的溶出[19]。对不同激素条件下愈伤诱导的研究表明,茎段愈伤诱导时合适的激素配比为NAA 0.4 mg·L-1+2,4-D 4.0 mg·L-1;叶片愈伤诱导时,合适的激素配比为NAA 1.0 mg·L-1+2,4-D 2.0 mg·L-1。可见,合适的NAA和2,4-D浓度有利于愈伤组织的诱导,这与沈国林等[14]的研究结果一致。
一般而言,避光培养以及添加活性炭可在一定程度上降低褐化的发生[20-21],这一结论在本研究中也得到了验证,三叶木通愈伤诱导时,合适的活性炭添加浓度为1.0 g·L-1。在考察褐化抑制常用的液体培养方式时发现,接种的所有外植体均死亡,这与张小红等[22]及唐利球等[23]的研究结果不同,分析原因可能是不同种类植物基因型差异所致。利用得到的愈伤组织接种至MS+NAA 0.4 mg·L-1+6-BA 2.0 mg·L-1+蔗糖30.0 g·L-1+琼脂6.0 g·L-1培养基中可诱导得到胚状体状态的丛生芽,但诱导率较低,且褐化严重。分析原因可能是三叶木通愈伤组织脱分化后再分化比较困难[14-16]。目前,得到丛生芽的研究也只集中在以种子或下胚轴为外植体上[17-18],因此,三叶木通愈伤组织的再分化条件还需要进一步的优化研究。
