血清mRNA-122对药物性肝损伤患者早期药物肝毒性评价的价值
2020-03-13寇曦曦
寇曦曦
临床上肝毒性评价方面主要依赖超微病理学、临床生化指标(如总胆汁酸、血清转氨酶等)、活性代谢产物、组织病理学、免疫相关指标,但这类指标稳定性、灵敏性、特异性较差,无法为其提供早期确切信息[1]。近几年,有报道显示肝特异性mRNA-122(microRNA-122,miR-122)调控肝细胞生长、发育、分化、代谢、应激等过程,相较于传统肝毒性评价指标,其能准确区分肝外损伤与肝损伤;与组织病理学结果具有明显相关性,有望成为早期药物肝毒性评价的生物标志物[2]。但目前鲜有关于miR-122评价药物性肝损伤(drug-induced liver injury,DILI)患者早期药物肝毒性的报道,故本文开展相关研究,旨在为DILI防治提供参考依据,报道如下。
资料与方法
一、一般资料
纳入2016年4月至2019年4月于我院收治的84例DILI患者为对象,获我院医学伦理委员会批准。诊断标准:参考《药物性肝损伤诊治指南》[3],均经肝穿病理确诊为急性药物性肝损伤,排除其他病因所致肝损伤;存在与药物性肝损伤发病规律一致的潜伏期;停药后异常肝脏指标迅速恢复;再次用药反应呈阳性。纳入标准:(1)年龄>18岁,首次发病;(2)均于用药1个月内出现肝功能损害,白细胞增加,伴发热、皮疹、黄疸、瘙痒等初发症状;(3)药物淋巴细胞刺激试验呈阳性;(4)偶然用药后再次出现;(5)抗丙型肝炎病毒抗体、乙肝表面抗原、抗人类免疫缺陷病毒抗体检测结果均呈阴性;(6)知情同意。排除标准:(1)既往有过量饮酒史;(2)伴自身免疫性肝炎、脂肪性肝炎、脑出血、病毒性肝炎、酒精性肝炎及其他严重肝脏疾病;(3)伴心、脑、肾、肺等严重脏器功能障碍及精神疾患者;(4)肝癌及其他恶性肿瘤。将纳入的84例DILI患者设为观察组,另选取同期入选的90例健康体检者为正常对照组,两组一般资料比较差异无统计学意义(P>0.05),见表1。

表1 两组一般资料比较[(±s),n(%)]
二、 方法
(一)miR-122检测 采用Trizol试剂盒 (日本Takara公司)提取血清中总RNA,应用Nanodrop ND-1 000分光光度计(美国Thermo Fisher公司),以分光光度法行总RNA浓度和纯度检测。采用Prime-Script®RT reagent Kit with gDNA Eraser逆转录试剂盒(日本TaKaRa公司)逆转miR-122,逆转录试剂包括样本RNA 1μg、DEPC水13 μL、Bulge-loop RT Primer 2 μL、反转录酶5×Prime-script RT Enzyme Mix 2 μL、反应缓冲液5×Primescript Buffer 4 μL。逆转录条件:42℃60min,70℃10min。将miR-122逆转录为cDNA后置于-20℃保存。内参基因取U6,采用逆转录实时荧光定量PCR方法(荧光定量PCR仪Step one plus,美国Applied Biosystems公司生产)测定U6、血清miR-122。反应体系:cDNA 2 μL,SYBR Green solution 10 μL,上下游引物均为0.4 μL,去离子H2O 7.2 μL。反应条件:95℃预变性10min,95℃变性2 s,60℃退火20 s,70℃延伸10 s,循环40次,软件分析Ct值。引物由美国SBI公司合成。采用公式2-△△Ct,对miR-122在DILI中的相对表达量进行计算,ΔCt=miR-122Ct-U6Ct。
(二)肝功能指标检测 采用HITA-CHI-7080型全自动生化分析仪(日本日立产业株式会社生产)及相配套试剂,检测血清丙氨酸氨基转移酶(alanine transaminase,ALT)、总胆红素(total bilirubin,TBil)、碱性磷酸酶(alkaline phosphatase,ALP)、门冬氨酸氨基转移酸(aspartate transaminase,AST)。
三、 观察指标
观察两组miR-122表达及肝功能指标TBil、AST、ALT、ALP水平,分析miR-122表达与上述肝功能指标的相关性。
四、 统计学方法

结 果
一、 两组miR-122表达及ALT、TBil、ALP、AST水平比较
观察组miR-122表达及ALT、TBil、ALP、AST水平均显著高于对照组(P<0.05),见表2。
二、 DILI患者血清miR-122表达与ALT、TBil、ALP、AST的相关性分
经直线相关分析显示,DILI患者血清miR-122表达与ALT、AST水平呈线性正相关(r=0.662、0.698,P=0.000、0.000),与TBil、ALP水平呈线性正相关(r=0.732、0.624,P=0.000、0.000),见图1~4。

表2 两组miR-122表达及ALT、TBil、ALP、AST水平比较(±s)
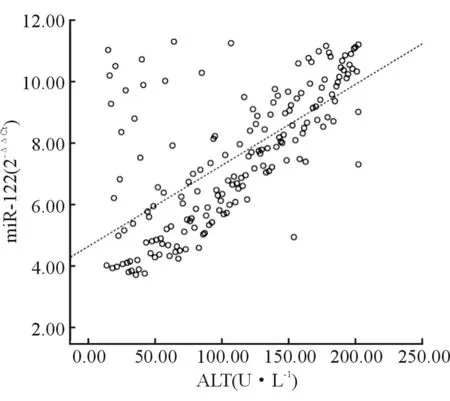
图1 miR-122与ALT的线性相关图

图2 miR-122与TBil的线性相关图

图3 miR-122与ALP的线性相关图
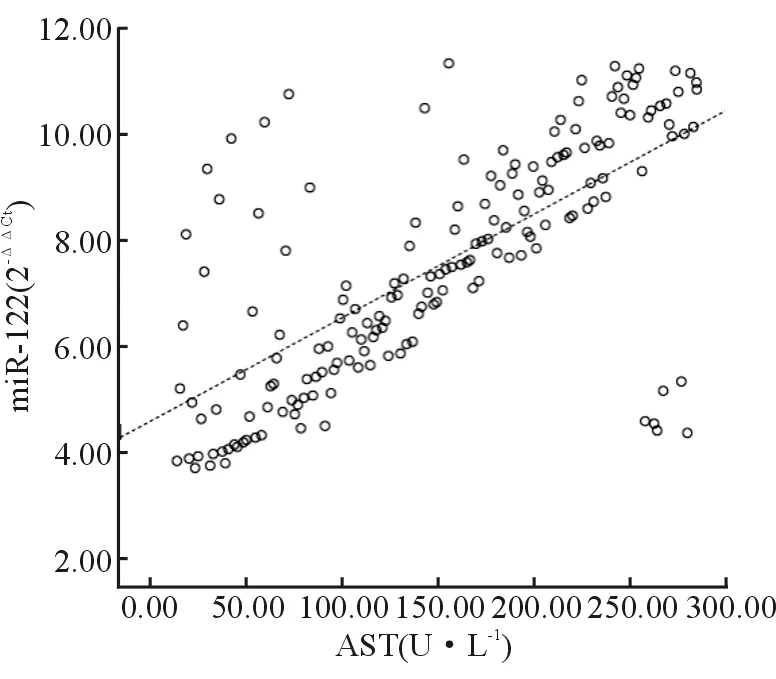
图4 miR-122与AST的线性相关图
讨 论
miR-122处于人类基因组第18号染色体,属内源性小分子单链RNA,可经调节其作用靶基因调控基因转录后表达。目前临床证实肝特异性表达的miR-122在肝组织中呈高度表达,表达量为肝中miRNAs的70%以上,在其他组织中呈低表达或不表达[4-5]。古巧燕等[6]采用乙酰氨基苯酚灌胃法建立急性药物性肝损伤动物模型,发现模型组灌胃8、16、24 h时血清miR-122水平较对照组有显著差异,且与ALT、AST水平呈正相关,与ALP、TBil水平无明显相关性(可能与动物模型病理损伤部位有关),推测急性药物性肝损伤血清miR-122水平升高预示肝细胞损伤加重。
本研究结果显示,观察组miR-122表达及ALT、TBil、ALP、AST水平均明显高于对照组,而直线相关分析显示DILI患者血清miR-122表达与上述肝功能指标均呈线性正相关,推测miR-122可能参与DILI发病过程,笔者推测,可能与miR-122特性有关,miR-122主要经与编码区碱基和靶mRNA 3’-或 5’-非翻译区互补配对,对靶mRNA稳定性进行调整,转录后水平对靶基因表达起着调控作用。而miR-122水平改变往往早于蛋白水平,可经组织细胞损伤致其被动漏出方式,或经微泡分泌后以RNA结合蛋白形式进入血液循环。发生药物性肝损伤时,血清miR-122表达显著升高,与肝组织病理学变化程度和血清ALT、TBil、ALP、AST存在明显相关性,与其检测方法(实时定量PCR)的高特异性、高敏感性也有关。也有报道认为循环中miR-122表达水平明显上调,推测组织损伤时其与循环中AST、ALT类似,由受损组织细胞分泌而来,能更好反映肝细胞损伤程度[7]。
综上,血清miR-122在DILI患者早期药物肝毒性评价中具有重要价值,临床应引起足够重视。但因样本量偏小,未涉及其他种类的miRNAs,并未探讨不同DILI病理类型、严重程度与血清miR-122的关系,故今后有待进一步深入调查研究。
