对氧磷酶-1 参与调控非酒精性脂肪肝脂质代谢与胰岛素抵抗作用及机制
2020-03-13张荣陈婧黄江涛吕海龙杨一邨王浩斌张抒
张荣 陈婧 黄江涛 吕海龙 杨一邨 王浩斌 张抒
对氧磷酶-1(paraoxonase 1,PON1)是一种具有调控血脂和抗炎特性的细胞外酯酶,参与调控动脉粥样硬化等多种代谢性疾病的发生发展[1, 2]。研究发现,PON1通过上调GLUT4和IRS-1/Akt信号通路参与胰岛素抵抗(insulin resistance,IR),影响二型糖尿病(type 2 diabetes mellitus,T2DM)等多种代谢疾病[3,4]。研究证实,NAFLD患者外周血中PON1活性显著降低[5, 6]。本研究通过分析NAFLD患者外周血PON1活性和含量,以及其与血糖、血脂、胰岛素抵抗等指标的关联,探究其可能的作用机制。
资料与方法
一、病例来源
选取2018年3月至2019年1月成都市第三人民医院收治的NAFLD患者129例,男79例,女50例,年龄(47.9±1.1)岁。同时选择130例无NAFLD患者作为对照,其中男72例,女58例,年龄(48.5±0.9)岁。两组性别、年龄比较均差异无统计学意义(χ2=0.552,t=0.153,均P>0.05)。比较两组研究对象身高、体质指数、腰围、血压、血糖、血脂、肝肾功能、胰高血糖素、胰岛素水平。所有研究对象均自愿参与,并签署知情同意书。本研究获得医院伦理委员会批准。
二、方法
(一)胰岛素抵抗的稳态指数评估 胰岛素抵抗的稳态指数(homeostatic index of insulin resistance,HOMA-IR)通过稳态模型评价,计算公式为:HOMA-IR=(空腹血糖值×空腹血胰岛素值)/22.51。
(二)人外周血PON1活性和含量检测 应用PON1活性检测试剂盒(美国Cusabio公司)和PON1含量检测试剂盒(武汉优尔生商贸有限公司),按照说明书进行操作。常规收集患者血浆后,加入200 μL至包被PON1抗体的96孔板中孵育12 h,随即漂洗并依次加入显色底物和终止液,测定450 nm的吸光度值,计算PON1活性。PON1含量采用标准曲线法计算,100 μL血浆加入至96孔板中,37℃孵育1 h,依次加入工作液和TMB底物,并测定450 nm的吸光值。
(三)细胞培养和处理 12孔板接种2.5×105个LO2细胞,培养24 h后分别加入0、0.1、0.2、0.4、0.8和1.2 mmol 油酸(上海阿拉丁生化科技股份有限公司)溶液处理24 h或10 ng/mL TNF-α处理6 h,以PEI转染1 μg空载质粒和PDEST42-hPON1-V5质粒(北京奥克鼎盛生物技术有限公司)24 h。
(四)细胞内脂质含量测量 使用尼罗红染料(大连美仑生物技术有限公司)测定细胞内脂质含量。处理24 h后,更换为含有1 μg/ mL尼罗红的培养基,并将细胞在黑暗中于37℃温育30 min,然后用PBS洗涤细胞并于ZOE荧光成像仪捕获荧光图像。
(五)蛋白质印迹检测 药物处理的12孔板LO2细胞以PBS洗去多余培养基,加入100 μL含cocktail和磷酸化酶抑制剂的RIPA裂解液,冰水浴剪碎后超声破碎,冷却并冰上裂解10 min,12 000×g离心20 min,取上清至新Ep管中,采用BCA法检测浓度后,加入含β-BE的5X loading buffer,95℃干热变性10 min,8%SDS-PAGE分离胶电泳分离,300 mA恒流湿转1 h至PVDF膜上,2%BSA的TBST溶液室温封闭1 h,分别加入抗人PON1、p-AKT(Ser473)、总AKT(T-AKT)、p-IRS-1(Ser307)、总IRS-1(T-IRS-1)、FAS、HMGCR、SREBP2、SREBP1C和β-actin抗体(武汉爱博泰克生物科技有限公司),4 ℃摇床孵育12 h。TBST室温漂洗3次。孵育HRP二抗TBST溶液(以1∶10 000稀释)室温2 h。ECL发光显示。蛋白表达以Image J计算总灰度值表示,标准化至β-actin灰度值。
(六)统计学方法

结 果
一、非酒精性脂肪肝患者和无非酒精性脂肪肝患者一般资料比较
NAFLD患者腰围、BMI、ALT和AST明显增加,外周血PON1活性和含量显著降低。见表1。
二、非酒精性脂肪肝和无非酒精性脂肪肝患者血脂分析
NAFLD患者外周血FFA、TG、TC、LDL-C和VLDL-C显著升高,HDL-C明显降低。见表2。
三、非酒精性脂肪肝和无非酒精性脂肪肝患者胰岛素抵抗和脂肪因子变化分析
NAFLD患者空腹血糖、胰岛素、HOMA-IR、抵抗素、瘦素、IL-6和TNF-α明显升高,胰高血糖素和脂联素显著降低。见表3。

表1 非酒精性脂肪肝和无酒精性脂肪肝患者临床指标比较(±s)

表2 非酒精性脂肪肝和无非酒精性脂肪肝患者血脂特点(±s)

表3 非酒精性脂肪肝和无非酒精性脂肪肝患者胰岛素抵抗和脂肪因子变化特点(±s)
四、非酒精性脂肪肝患者PON1活性和含量与胰岛素抵抗和脂肪因子的相关性
NAFLD患者外周血PON1活性和含量与FFAs、TG、TC、LDL-C、VLDL-C、空腹血糖、胰岛素、HOMA-IR、抵抗素、瘦素、IL-6和TNF-α显著呈负相关,与DL-C、胰高血糖素和脂联素显著呈正相关。见表4。
五、过表达PON1减少OA诱导的LO2细胞脂肪变性
转染PON1质粒显著降低OA诱导LO2细胞内脂质含量升高。见图1。
六、过表达Paraoxonase 1抑制TNF-α诱导的LO2细胞胰岛素抵抗
转染PON1质粒显著增加PON1,同时p-IRS1和p-AKT蛋白表达量显著增加。见图2。
七、过表达Paraoxonase 1抑制TNF-α诱导的LO2细胞脂肪代谢
转染PON1质粒显著增加FAS、HMGCR、SREBP2和SREBP1C蛋白表达。见图3。

表4 非酒精性脂肪肝患者PON1活性和含量与NAFLD患者血脂含量、胰岛素抵抗和脂肪因子显著相关(±s)
**P<0.01;***P<0.001

A: LO2细胞PON1活性水平;B:LO2细胞尼罗红染料染色;C:LO2细胞内甘油三酸酯含量;D:PON1-V5蛋白水平电泳图
图1Paraoxonase 1调控OA诱导的LO2细胞脂肪变性
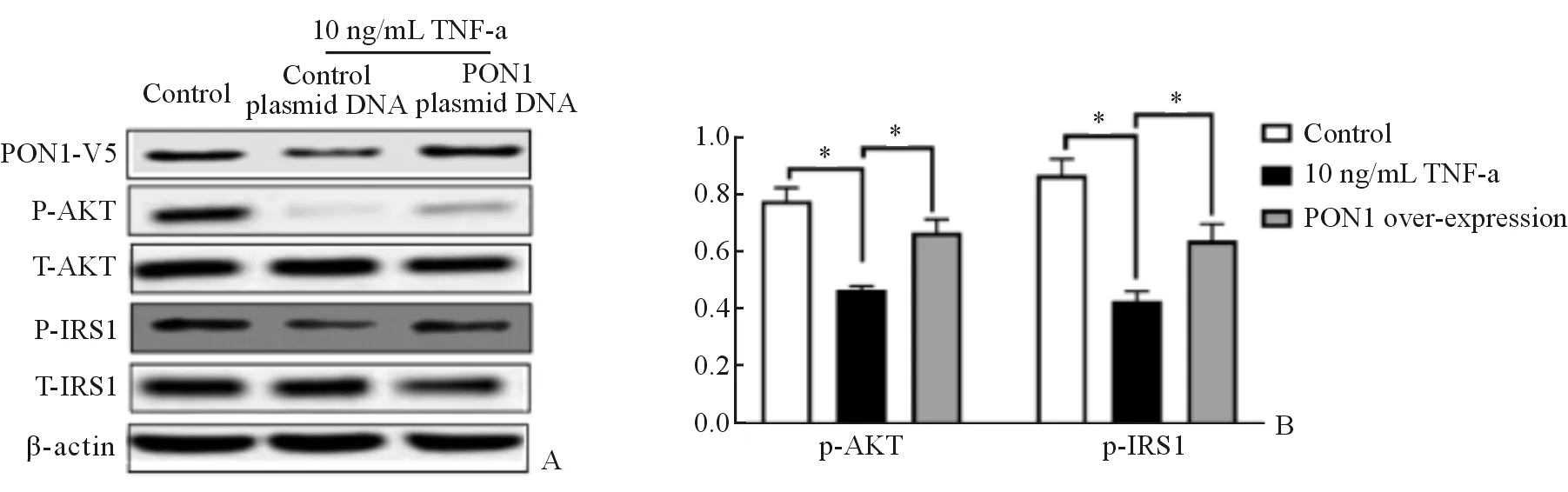
A:PON1,p-AKT,t-AKT,p-IRS1,T-IRS1蛋白水平条带图;B:p-AKT,p-IRS1蛋白水平
图2Paraoxonase 1调控TNF-α诱导的LO2细胞胰岛素抵抗

A:FAS,HMGCR,SREBP2,SREBP1C蛋白水平条带图;B:p-AKT,p-IRS1蛋白水平
图3Paraoxonase 1调控TNF-α诱导的LO2脂质代谢
讨 论
临床数据表明,NAFLD患者常伴有代谢紊乱和胰岛素抵抗,通过干预脂质运输可显著控制其病死率[7,8]。文献报道,NAFLD患者外周血中PON1活性显著降低[9],而PON1具有血脂调节、抗炎症特性,参与调控胰岛素抵抗[4,10]。
本研究发现,NAFLD降低PON1含量和活性与自身血脂水平和胰岛素抵抗及相关因子密切相关[4,11]。经选取公认的OA诱导的脂肪变性和TNF-α诱导的胰岛素抵抗LO2细胞模型[3, 12],利用质粒转染技术,在该模型中过表达PON1,分析其对胰岛素抵抗和脂肪代谢的影响和机制。结果发现过表达PON1显著抑制细胞脂肪变性和胰岛素抵抗,并且其与IRS1/AKT通路作用有关[4,13],其上调FAS,HMGCR,REBP2和SREBP1C增强脂质代谢[14,15]。
综上所述,本研究分析NAFLD外周血PON1与血脂、血糖、胰岛素抵抗和脂肪因子等与NAFLD密切相关的蛋白的关联性,证实其可作用IRS1/AKT通路参与胰岛素抵抗调节,作用FAS、HMGCR、REBP2和SREBP1C参与脂再生和脂肪氧化代谢。然而,其具体如何调控这些蛋白仍待进一步研究。
