血清TNF-α、IL-35在炎症性肠病患者中的表达及临床价值
2020-03-13邓雳毛成荣赵家文
邓雳 毛成荣 赵家文
炎症性肠病(IBD)是临床上常见的消化系统疾病之一,主要包括溃疡性结肠炎(UC)、克罗恩病(CD)等,具有慢性、迁延性、频繁反复发作的特点,故有效评估IBD及其病情进展具有重要的临床意义[1]。目前,IBD的病情评估主要根据内镜特征与临床症状等,但临床上尚缺乏有效的血清学指标。有研究报道,IBD的发生发展与肠道慢性非特异性炎症反应有关[2,3]。而肿瘤坏死因子-α(TNF-α)、白介素-35(IL-35)是其中重要的炎性因子,可直接参与和介导的机体非特异性炎性反应[4,5]。对此,本研究通过检测IBD(CD、UC)患者血清TNF-α、IL-35水平,并与健康人员比较,探讨二者与IBD的关系,以为寻求临床评估IBO可靠的血清学指标,报告如下。
1 资料与方法
1.1 一般资料 选取2016年9月至2018年9月收治的IBD患者48例,其中CD患者24例为CD组、UC患者24例为UC组,同期选取体检健康人员48例为对照组。3组性别、年龄、体重指数比较,CD组、UC组病程、活动性比较,差异无统计学意义(P>0.05)。CD组、UC组中活动期和缓解期患者性别比、年龄、体质量指数、病程比较,差异无统计学意义(P>0.05)。见表1、2。

表1 3组一般资料比较

表2 CD组、UC组中活动期和缓解期患者一般资料比较
1.2 纳入与排除标准
1.2.1 纳入标准:经临床症状、病史、实验室、镜检、影像学等检查为IBD(包括CD、UC)[6],年龄>18岁、无精神病病史,知情同意。
1.2.2 排除标准:①检查前1个月有抗感染、免疫、抗炎、抗凝、放化疗等治疗史,有感染、恶性肿瘤等疾病,有心、肝、肾等严重性疾病;②妊娠期、哺乳期女性;③本研究经伦理委员会审批通过。
1.3 方法 TNF-α、IL-35检测,所有人员均抽取外周静脉血3 ml置入无菌试管中,分离血清(3 000 r/min、10 min)后采用酶联免疫吸附法检测血清TNF-α、IL-35水平,试剂盒均购自上海恒远生物科技有限公司。比较对照组、CD组、UC组血清TNF-α、IL-35水平,比较CD组、UC组中患者活动期和缓解期血清TNF-α、IL-35水平,并分析血清TNF-α与IL-35的关系。

2 结果
2.1 3组血清TNF-α、IL-35水平比较 CD组、UC组血清TNF-α水平明显高于对照组,CD组、UC组血清IL-35水平明显低于对照组,差异有统计学意义(P<0.05),CD组、UC组血清TNF-α、IL-35水平比较,差异无统计学意义(P>0.05)。见表3。
2.2 CD组、UC组中活动期和缓解期患者血清TNF-α、IL-35水平比较 CD组、UC组中,活动期患者血清TNF-α水平明显高于缓解期患者,活动期患者血清IL-35水平明显低于缓解期患者,差异有统计学意义(P<0.05),CD组和UC组活动期患者、缓解期患者血清TNF-α、IL-35水平比较,差异无统计学意义(P>0.05)。见表4。


组别TNF-αIL-35对照组(n=48)1.02±0.3680.26±8.51CD组(n=24)2.68±0.58∗48.26±5.57∗UC组(n=24)2.58±0.57∗47.48±5.62∗F值16.37218.253P值<0.01<0.01
注:与对照组比较,*P<0.05


组别TNF-αIL-35CD组 缓解期(n=10)1.92±0.5158.05±5.72 活动期(n=14)3.53±0.52∗40.25±5.62∗UC组 缓解期(n=8)2.02±0.5359.62±5.76 活动期(n=16)3.82±0.54∗41.06±5.58∗ F值26.38730.572 P值<0.001<0.001
注:与对照组比较,*P<0.05
2.3 血清TNF-α与IL-35的Pearson相关性分析 Pearson相关性分析结果显示,血清TNF-α与IL-35呈负相关(r=-0.842,P<0.05)。见图1。
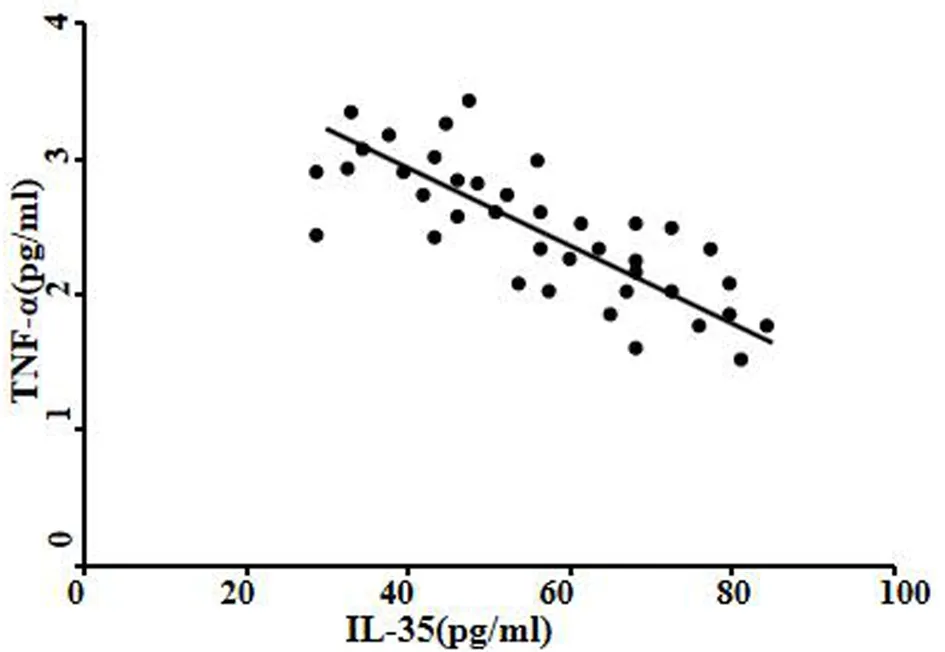
图1 血清TNF-α与IL-35的Pearson相关性分析
3 讨论
IBD是一种累及回肠、直肠、结肠的消化科常见病、多发病,其病因和发病机制尚未完全明确,主要与环境、遗传、感染、免疫等因素有关,以CD、UC较为常见,且近年来我国IBD发病率呈逐年增长趋势,严重影响患者的身体健康[7,8]。而IBD的病情评估主要通过临床症状内镜表现及病理等综合判断,其临床准确性高,已逐渐被认可,但仍有部分患者(尤其是某些早期活动、易复发者)的临床表现不明显且内镜检查亦未发现明显的活动性征象[9,10]。
近年来,血清学诊断技术有了较大的发展,通过检测疾病血清中的标志物,可有效评估相应疾病的发生发展情况,可作为临床上重要的辅助诊断方法之一[11,12]。而多数量研究已证实,在IBD发生发展中,肠道黏膜免疫系统异常反应所致的炎性反应起重要的作用,其相关的细胞因子及其相关受体发挥重要的作用,提示通过检测相应的细胞因子及其相关受体对评估IBD及其病情进展具有重要的临床意义[13,14]。而TNF-α是机体中常见的促炎性因子之一,主要通过自分泌与旁分泌途径发挥局部炎性细胞活化与聚集的作用,可直接参与和介导的机体非特异性炎性反应,其与多种炎症性疾病的发生发展有关[13,14]。IL-35水则是机体中常见的抗炎性因子之一,主要调节性T细胞表达与分泌而发挥免疫拮抗作用,可直接参与和抑制机体非特异性炎性反应,其在多种炎症性疾病中呈低表达状态[15,16]。
本研究结果显示,CD组、UC组血清TNF-α水平明显高于对照组,CD组、UC组血清IL-35水平明显低于对照组,CD组、UC组血清TNF-α、IL-35水平比较无统计学差异,表明血清TNF-α、IL-35水平与CD、UC等IBD的发生发展有关,但与IBD疾病类型无关。这可能是由于CD、UC的IBD疾病发生过程中,肠道黏膜免疫系统异常反应所致的炎性反应会刺激和调节相关的炎症细胞因子的产生[7,8],如可能大量刺激了TNF-α等促炎性因子[13,14]的分泌并抑制了IL-35等抗炎性因子[15,16]的产生,使肠道炎性反应失衡并趋向于炎性反应的发生,从而使肠道出现非特异性炎性反应的损伤,最终导致CD、UC等IBD发生。同时,本研究中,CD组、UC组中,活动期患者血清TNF-α水平明显高于缓解期患者,活动期患者血清IL-35水平明显低于缓解期患者,CD组和UC组活动期患者、缓解期患者血清TNF-α、IL-35水平比较无统计学差异,表明血清TNF-α、IL-35水平与CD、UC等IBD的病情活动性有关,但与IBD疾病类型无关。这可能是由于活动期IBD患者的病情较为严重,其肠道黏膜免疫系统的异常状态更严重,使肠道炎性反应的失衡也更严重[9,10],进而导致TNF-α等促炎性因子[13,14]的分泌更多而IL-35等抗炎性因子[15,16]的产生更少,使肠道出现非特异性炎性反应的损伤也更严重,疾病活动性也越剧烈。此外,本研究的Pearson相关性分析结果显示,血清TNF-α与IL-35呈负相关,这可能是由于TNF-α是促炎性因子[13,14],IL-35是抗炎性因子[15,16],TNF-α、IL-35在机体的炎性反应平衡中呈互相抑制的作用,故提示TNF-α与IL-35在CD、UC等IBD的发生发展中呈互相拮抗的作用。
综上所述,血清TNF-α、IL-35水平与CD、UC等IBD的发生发展有关,提示TNF-α、IL-35可作为评估IBD及其病情进展的重要指标。
