去甲斑蝥素诱导黑色素瘤M14细胞凋亡及相关机制的研究
2020-03-13高杨丛力宁程毅刘岩
高杨 丛力宁 程毅 刘岩
黑色素瘤是一种好发于皮肤的高度恶性的肿瘤,有易发生转移,病死率高,预后差[1,2]等特点,且缺乏较有效的治疗手段。斑蝥素是从斑蝥的干燥虫体中提取的一种抗肿瘤活性成分,具有抗肿瘤、升白细胞、增强免疫、抗病毒、抑菌及抗氧化等作用,临床上可用于治疗多种肿瘤。去甲斑蝥素是斑蝥素的衍生物,由人工合成,其毒副作用比斑蝥素低,具有独特的升白细胞作用及较强的抗癌作用。本研究通过去甲斑蝥素作用于人黑色素瘤M14细胞,观察去甲斑蝥素对M14细胞凋亡和有关凋亡基因及细胞内活性氧(ROS)的影响,探讨其可能的抗肿瘤作用机制。
1 材料与方法
1.1 材料与试剂 人M14黑素瘤细胞株,购于中国科学院上海细胞研究所;去甲斑蝥素购于美国Sigma 公司,1640培养基购于美国Gibco公司,CCK8试剂购于日本同仁化学研究所,Trizol试剂购于Invitrogen公司、高效RIPA裂解液购于北京索莱宝来生物技术有限公司,PCR引物购于北京鼎国昌盛生物技术有限公司,活性氧检测试剂盒购于南京凯基生物科技发展有限公司,丙二醛(MDA)检测试剂盒购于碧云天生物技术研究所。
1.2 方法
1.2.1 细胞培养:M14细胞培养于10%胎牛血清的1640培养基,37℃,5%CO2的恒温培养箱中。于倒置显微镜下观察细胞形态和生长状态,待细胞融合达到90%以上时,按1∶2或1∶3的比例进行传代。将细胞分为空白对照组和50、100、500 μg/L去甲斑蝥素给药组。
1.2.2 CCK8检测:细胞活性将对数生长期的M14细胞接种于96 孔板中,每孔5×103个细胞,每组设5个平行孔,待细胞贴壁后,弃去原培养液,实验组每孔加入100 μl的药物,浓度分别为0、50、100、500 μg/L,只加培养基无细胞孔为空白对照组。分别作用12、24 h后,加CCK8每孔10 μl作用2 h,用酶标仪测定每孔450 nm波长的吸光度值并计算抑制率。生长抑制率=[(Ac-As)/(Ac-Ab)]×100%。
1.2.3 qRT-PCR法检测凋亡相关mRNA的表达
1.2.3.1 Trizol法提取细胞总RNA:贴壁细胞PBS洗涤3次,加入1 ml Trizol,吹打充分混匀,移至EP管,冰盒静置5 min,加入0.2 ml氯仿,上下剧烈震荡15 s,冰盒静置5 min,2 min,4℃离心,12 000 r/min×15 min,取上层水相移入一新无RNase管中,加入等体积异丙醇,冰盒静置10 min,4℃离心,12 000 r/min×10 min。弃上清,管中白色沉淀即RNA,去除残液后加入0.4 ml 75%乙醇洗涤,4℃离心,9 000 r/min×5 min,弃上清,晾干RNA。加入40 μl ddH2O溶解,吹打混匀,-80℃保存。
1.2.3.2 总RNA质量的检测:测定RNA样品的OD260及OD280,计算RNA的浓度,以OD260/OD280,保证其比值在1.9~2.0,若偏差过大,则表示RNA有污染,判断RNA样品中有无蛋白质或者有机溶剂污染。
1.2.3.3 RNA反转录成cDNA。见表1。

表1 RNA反转录成cDNA反应体系
1.2.3.4 qRT-PCR GAPDH为内参,每个样品设3个复孔,总体积为20 μl。充分混匀,操作IQ5软件:热学过程:95℃×5 min,95℃×15 s,58℃×30 s,72℃×30 s,共40个重复循环,采集PCR产物荧光值。结束后,设置溶解曲线程序:95℃×15 s,60℃~95℃,缓慢升温,产生熔点曲线或称解离曲线。设阈值,检测mRNA的表达情况。见表2。

表2 qRT-PCR GAPDH为内参反应体系
1.2.3.5 引物序列:见表3。

表3 引物序列
1.2.4 双重加热法检测MDA的水平。其实验原理基于硫代巴比妥(TBA)和MDA反应产生的紫色,通过比色法间接测定MDA的水平。调整M14细胞浓度为1.0×105个,接种于6孔板,37℃、5% CO2温箱中孵育过夜。加入不同浓度的去甲斑蝥素后孵育24 h后离心收集细胞。加入200 μl细胞裂解液充分裂解后,1 600 r/min离心10 min取上清,按照试剂盒的操作说明,加入TBA溶液,95℃煮沸40 min。样品迅速冷却至室温,并按要求加入96孔板中,在532 nm酶标仪测定吸光光度值。MDA含量为每毫克蛋白质中的纳摩尔数。
1.2.5 细胞内ROS水平检测:DCFH-DA被自由基(H2O2)去乙酰化转变为其荧光产物DCF,通过检测DCF的荧光值,可间接检测细胞内ROS的水平。调整M14细胞浓度为1.0×105个,接种于6孔板,37℃、5% CO2温箱中孵育过夜。加入不同浓度的去甲斑蝥素后孵育24 h后收集细胞。按照活性氧检测试剂盒的操作说明,用DCFH-DA 荧光探针标记细胞,利用荧光酶标仪在488 nm激发波长、525 nm发射波长下测定不同组别中DCF 的荧光值。

2 结果
2.1 去甲斑蝥素抑制M14细胞增殖 CCK8结果所示,去甲斑蝥素可抑制黑素瘤M14细胞的增殖,药物作用24 h后各组的细胞生长抑制率比较有显著差异(F=135.76,P<0.05),作用48 h后亦有显著差异(F=96.12,P<0.05),经两两比较,各浓度去甲斑蝥素与阴性对照组组间差异均有统计学意义(P<0.05)。见表4。


组别24 h凋亡率48 h凋亡率对照组 6.34±1.037.86±1.3750 μg/L NCTD 14.57±1.45∗18.89±2.13∗100 μg/L NCTD38.48±2.67∗#46.18±3.06∗#500 μg/L NCTD56.72±3.78∗#△63.57±3.64∗#△
注:与对照组比较,*P<0.05;与50 μg/L NCTD比较,#P<0.05;与100 μg/L NCTD比较,△P<0.05
2.2 去甲斑蝥素对凋亡相关基因的影响 采用RT-PCR法检测去甲斑蝥素对人M14黑色素瘤细胞中凋亡基因mRNA的影响。去甲斑蝥素作用M14细胞24、48 h后,均能够升高凋亡相关基因Bax、caspase-3、caspase-9、细胞色素c的mRNA的表达,减少凋亡抑制基因Bcl-2的mRNA表达(P<0.05)。见表5。


组别Bax相对mRNAcaspase-3相对mRNAcaspase-9相对mRNA细胞色素c相对mRNABcl-2相对mRNA对照组 1111150 μg/L NCTD1.11±0.251.07±0.181.05±0.030.83±0.110.83±0.08100 μg/L NCTD1.32±0.0451.74±0.09#1.34±0.05#1.18±0.06∗0.60±0.16#500 μg/L NCTD1.47±0.085∗1.74±0.38#1.42±0.04#1.25±0.08#0.40±0.11#
注:与对照组比较,*P<0.05,#P<0.01
2.3 去甲斑蝥素对M14细胞中ROS的影响经过药物处理人M14黑色素瘤细胞24 h后,采用荧光探针标记法检测不同浓度去甲斑蝥素作用在人M14黑色素瘤细胞ROS水平。如图3显示结果发现,去甲斑蝥素能明显的提高细胞内ROS水平(F=22.029,P<0.05),与对照组对比,各实验组差异均有统计学意义(P<0.05)。见表6,图1。


组别ROS相对含量对照组 150 μg/L NCTD 1.31±0.035∗100 μg/L NCTD1.25±0.04∗500 μg/L NCTD1.34±0.10∗
注:与对照组比较,*P<0.01

图1 荧光探针法检测去甲斑蝥素对黑素瘤M14细胞ROS的影响
2.4 去甲斑蝥素对M14细胞中MDA的影响经过不同浓度药物处理人M14黑色素瘤细胞24 h后,采用双重加热法检测不同浓度去甲斑蝥素作用在人M14黑色素瘤细胞后的MDA水平。去甲斑蝥素能明显的提高细胞内MDA水平(F=14.230,P<0.05),且呈剂量依赖性。与对照组相比,100 μg/L、500 μg/L 2组差异有统计学意义(P<0.05)。见表7,图2。


组别MDA对照组 0.31±0.0450 μg/L NCTD 0.56±0.10100 μg/L NCTD0.88±0.13∗500 μg/L NCTD0.99±0.23#
注:与对照组比较,*P<0.05,#P<0.01
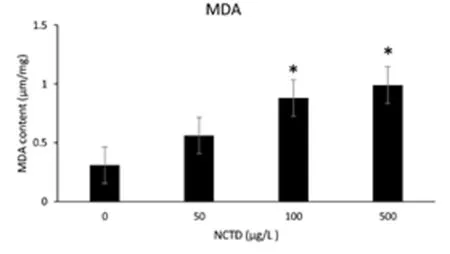
图2 双重加热法检测去甲斑蝥素对黑素瘤M14细胞丙二醛(MDA)的影响
3 讨论
去甲斑蝥素(noncantharidin,NCTD)为斑蝥素的衍生物,是人工合成的一种新型抗癌药物,是一种水溶性合成小分子,与斑蝥素相似,其摩尔质量、复杂度和重原子数分别为168.15 g/mol、246和12。NCTD可以引起多种细胞系的凋亡,目前已有研究表明去甲斑蝥素对人皮肤鳞状细胞癌A431细胞[1]、骨髓瘤U266细胞[2]、肺腺癌A549细胞[3]、胰腺癌PANC1细胞[4]、胃癌SGC7901细胞[5]、乳腺癌MCF7细胞[6]等均具有抑制作用。此外,它还可以抑制血管的生成和转移,影响控制细胞增殖的多种途径。
目前,包括Wnt/β-连环蛋白,Sonic hedgehog(Shh)和Notch信号通路在内的几种途径已被确定在癌症干细胞的自我更新中起到关键作用,并可导致肿瘤复发和多药耐药,以及血管生成,迁移,侵袭和转移[7]。去甲斑蝥素可以促进β-catenin活化的丧失并抑制具有显性β-连环蛋白信号传导的Jurkat细胞的增殖[8];NCTD可抑制了乳腺癌各种细胞系的Shh表达[9];NCTD剂量依赖性地抑制人乳腺癌MDA-MB-231细胞中Akt和NF-κB表达的磷酸化[10]。此外,NCTD在低浓度(0.2~0.8 μg/ml)下使人肺癌A549细胞迁移减少超过65%而不影响细胞活力[11]。细胞外信号调节激酶(ERK),c-Jun NH2-末端激酶(JNK)的激活和下游转录因子NF-κB的调节参与NCTD诱导的人肝癌HepG2细胞凋亡[12];这表明NCTD具有用活化的Wnt/β-连环蛋白途径治疗癌症的显著潜力。在对单一药物或一类药物产生耐药性后,癌细胞对其他功能和结构不相关的药物表现出交叉耐药性,导致癌细胞治疗失败,这种现象称为多药耐药性(multidrug resistance,MDR)。尽管目前已研究了MDR的许多机制,但最重要的机制可能是通过细胞膜上药物转运蛋白将药物主动移出从而减少细胞内药物积累。这些药物转运蛋白为ATP结合蛋白,包括p-糖蛋白,多药耐药蛋白1、多药耐药蛋白2,肺耐药蛋白、和乳腺癌耐药蛋白等[7]。NCTD可抑制异质性人上皮结肠直肠腺癌细胞单层模型中p-糖蛋白[13]和多药耐药相关蛋白2的表达[14],诱导对多种化疗药物具有耐药性的口腔癌细胞的凋亡[15]。在对多柔比星耐药的人乳腺癌MCF-7R细胞的研究中,NCTD增加了MCF-7R细胞中多柔比星的细胞内积累,并抑制了多药耐药蛋白1 mRNA,p-糖蛋白和乳腺癌耐药蛋白表达的上调[16]。总的来说,NCTD可能是P-糖蛋白的底物,可能会克服癌细胞的多药耐药性。本课题组在前期的实验研究中,经流式细胞术检测到去甲斑蝥素对人A375细胞有促进凋亡的作用,本实验通过CCK8法分析去甲斑蝥素体外作用于人黑色素瘤M14细胞,结果显示去甲斑蝥素对黑色素瘤细胞具有明显的生长抑制作用,并且呈时间-剂量依赖性。在前期实验中,我们还通过DAPI染色法通过荧光显微镜下观察去甲斑蝥素对黑素瘤M14细胞核结构,出现细胞核固缩、核边集及凋亡小体等细胞凋亡形态学改变,证实去甲斑蝥素对人黑色素瘤M14细胞有抑制作用,但其作用机制尚不明确[17]。在本试验中,我们研究了去甲斑蝥素是否可以在M14细胞中激活线粒体途径而诱导细胞凋亡。
细胞凋亡是发生在多细胞生物中的程序性细胞死亡的过程,这个过程包括起泡,细胞收缩,核碎裂,染色质浓缩,染色体DNA片段化和mRNA全面衰变[18]。基于刺激因素的不同,细胞凋亡通常通过激活外源性(死亡受体)途径或内在(线粒体)途径。内源性途径通常被来自于细胞内部的压力激活,由一连串的刺激因素诱导,包括DNA损伤和生长因子减少,这些刺激信号最终触发线粒体外膜通透性增加(mitochondrial outer membrane permeabilization,MOMP)。其中线粒体外膜(outer mitochondrial membrane,OMM)通透性增加一般是由于某些促凋亡BCL-2家族成员激活的结果[19]。Bcl-2家族包括凋亡抑制因子和凋亡促进因子两大类,凋亡抑制因子包括Bcl-2、Bcl-xL、Mcl-1等,Bax、Bak、Bcl-xS等为凋亡促进因子。Bax与Bcl-2是一对同源或者异源二聚体,当细胞DNA受损时,Bax表达增强,可与Bcl-2形成同源二聚体,拮抗Bcl-2的抑制凋亡作用,从而激活线粒体凋亡通路,引起细胞凋亡。有文献报道,ROS可作为细胞的第二信使调控细胞增长、促进细胞增殖,但是过高的ROS水平会使细胞因氧化过度而受损,导致细胞凋亡[20]。ROS介导的细胞损伤在早期会引起细胞膜脂质过氧化,同时伴有MDA的产生,因此MDA可间接评价细胞遭受氧化应激损伤的严重程度[21]。在前期的研究中,我们通过流式细胞术检测发现10~40 μmo/L去甲斑蝥素作用在人A375黑色素瘤细胞48 h后,ROS水平明显有所提高,且呈剂量依赖性。本实验我们进一步通过荧光探针法检测去甲斑蝥素对M14黑素瘤细胞ROS的影响,结果显示去甲斑蝥素同样可增加M14细胞内的ROS水平。同时,细胞内的MDA水平也升高,间接反映了细胞受到了过度的氧化应激损伤。同时,通过RT-PCR我们还发现,随着去甲斑蝥素浓度的升高,凋亡相关基因Caspase-3、Capase-9、Bax、细胞色素c基因的mRNA表达量逐渐升高,而凋亡抑制基因Bcl-2的mRNA表达量逐渐降低。综合以上结果,我们推测去甲斑蝥素可诱导M14细胞凋亡,其作用可能与去甲斑蝥素引发细胞内氧化应激进而启动线粒体途径的凋亡通路有关,去甲斑蝥素有望成为治疗黑素瘤的有效辅助性药物。
