乙型肝炎患者不同突变谱的乙肝表面抗原水平变化
2020-03-13申红玉张宏宇陈敏郑国军朱珉之杭双熊
申红玉 张宏宇 陈敏 郑国军 朱珉之 杭双熊
江苏省常州市第三人民医院检验科(江苏常州213001)
乙型肝炎病毒(Hepatitis B virus,HBV)感染是一个严重的世界性健康问题,全球约有2.48亿人感染[1]。尽管近年来核苷类似物[nucleos(t)ide analogs,NAs]已在临床上被广泛用于抑制HBV复制,但HBV相关的肝硬化或肝细胞癌(hepatocellular carcinoma,HCC)引起的死亡仍然逐年增加[2-3]。
HBV DNA与乙肝表面抗原(HBsAg)是临床中反映病毒复制的两个重要病毒学标记,与病毒粒子的聚集和分泌密切相关,因此,这两个标记被用来评估慢性乙型肝炎(chronic hepatitis B,CHB)患者的抗病毒治疗反应性[4]。一项研究报道,HBeAg阳性患者HBsAg与HBV DNA呈显著正相关[5],而另一项研究显示,治疗组和未治疗组患者HBsAg与HBV DNA相关性较差[6]。因此,HBsAg与HBV DNA的关系仍存在争议[7-9]。
具有低耐药基因屏障的NAs,包括拉米夫定(LAM)和阿德福韦酯(ADV),在过去10年中被广泛使用,并导致耐药突变体的流行。理论上,HBV基因组的开放阅读框重叠,逆转录酶(RT)区域的突变可能影响HBsAg水平、传染性以及病毒粒子的产生。据报道,rtA181T突变导致S区sW172*取代,这是一个终止密码子,对HBsAg的产生有负面影响[10-11]。耐药突变rtM204I/sW196*也被报道为S基因[12]的一个终止密码子。HBV野生型毒株与耐药毒株共存,在NAs治疗期间仍可产生HBV病毒粒子。野生型菌株和耐药菌株可以相互补充,产生协同或互补作用[11,13]。然而,RT 区突变对HBsAg水平的影响尚不清楚。
在本研究中,笔者分析了大量RT区不同突变的CHB患者的HBsAg水平及其与HBV DNA的相关性。这些发现可以扩展我们对HBsAg和HBV DNA之间关系的理解,且有必要对HBV突变患者的HBsAg水平进行重新评估。
1 对象与方法
1.1 研究对象 收集2011年7月至2018年12月在江苏省常州第三人民医院门诊及住院患者2 843例。所有患者均为HBV感染者,诊断符合《慢性乙型肝炎防治指南(2015)》[14],并有拉米夫定(Lamivudine,LAM)或阿德福韦酯(adefovir dipivoxil,ADV)治疗史1年以上,应答不佳的CHB患者。同时定期收集患者HBsAg滴度、HBV DNA载量、耐药基因和肝脏功能等指标。所有患者排除合并HAV、HCV、HDV、HEV、HIV等其他病毒性疾病、酒精性肝病、自身免疫性肝炎等疾病。
将所有患者分为突变组和非突变组,其中突变组按照突变位点又被分为rtM204I/V、rtL180M+M204V、rtL180M+M204I、rtA181T、rtN236T 和rtA181T+N236T六个亚组。
本项研究通过了常州市第三人民医院伦理委员会的批准,伦理批准文号:常州市第三人民医院医伦[2018]第005号。
1.2 RT区基因测序 采用QIAamp试剂盒(德国)提取血清HBV DNA,用巢式PCR扩增HBV RT区域。第一轮PCR的正反向引物分别为:5′-ACTGTATTCCCATCCCATCAT-3′和 5′-TTCGTTGACATA CTTTCCAATCA-3′,第二轮PCR的正反向引物分别为:5′-CTTGACATACTTTCCAATCAA-3′和 5′-AAG GTATGTTGCCCGTTTGT-3′。PCR产物直接送测序,检测HBV RT区的耐药相关突变。
1.3 实验室检查 血清HBsAg和HBeAg水平是采用化学发光酶免法(雅培)检测,对检测结果超过250 IU/mL的标本进行稀释后复测;肝功能检测采用日立7600全自动生化分析仪检测;ALT的正常参考值为7~40 U/L;血清HBV DNA采用罗氏LightCycler 480II系统(瑞士)检测,其检测限为100 IU/mL。
1.4 统计学方法 采用t检验对正态分布数据进行组间比较,χ2检验用于分类数据的比较,pearson相关分析描述两个变量之间的相关性。采用SPSS 15.0软件进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 基线特征 所有患者分为两组:耐药位点突变组和非突变组。患者基线特征见表1。在所有患者中,758例(26.7%)有耐药位点突变,2 085例(73.3%)无耐药位点突变。突变组的血清HBsAg滴度(1 771.87±868.57)IU/mL明显高于非突变组(1 636.85 ± 857.27)IU/mL(t=3.677,P< 0.001),两组HBeAg阳性率亦差异有统计学意义(χ2=12.001,P=0.001)。突变组和非突变组的平均HBV DNA水平分别为5.22 log10IU/mL和5.75 log10IU/mL,差异有统计学意义(t=7.657,P<0.001)。在血清ALT水平上,突变组(148.75±183.32)U/L明显高于非突变组(103.47±132.69)U/L,差异有统计学意义(t=-6.233,P<0.001)。突变组患者的平均年龄(48.56±12.52)岁显著高于非突变组(43.68±13.00)岁,差异有统计学意义(t=-8.928,P<0.001),但在性别上两组差异无统计学意义(χ2=0.246,P=0.620)。
2.2 不同耐药突变组和非突变组HBsAg定量与血清HBV DNA水平的相关性不同 所有患者HBsAg定量与血清HBV DNA水平的相关分析见图1。非突变组血清HBsAg滴度与HBV DNA水平呈正相关(r=0.413,P<0.01,图1A),单位点突变组亦是如此(rtM204I/V:r=0.380,P<0.001,图 1B;rtA181V:r=0.258,P=0.008,图 1E;rtN236T:r=0.369,P=0.004,图1F),rtL180M+rtM204V联合突变组的HBsAg滴度与HBV DNA水平也呈正相关(r=0.300,P<0.001,图1D)。但rtL180M+rtM204I突变组和rtA181V+rtN236T突变组血清HBsAg滴度与HBV DNA水平相关性较差,分别为(r=0.203,P=0.055,图1C)和(r=0.159,P=0.217,图1G)。
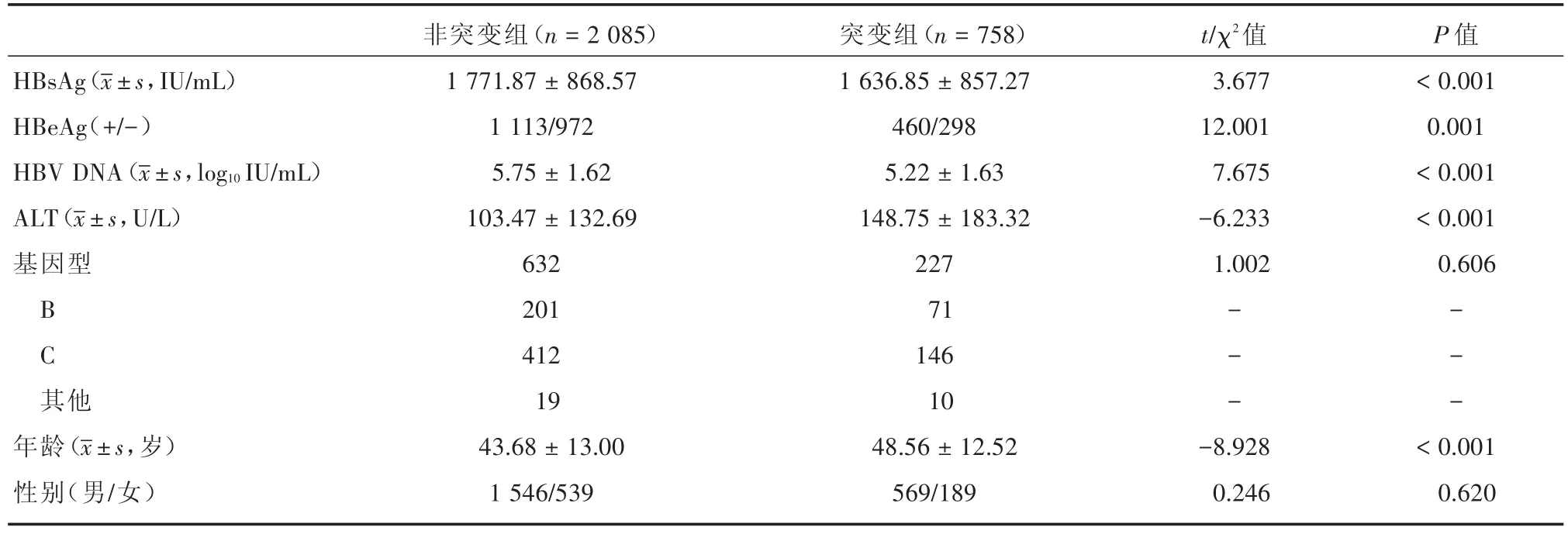
表1 基线特征(n=2 843)Tab.1 Baseline characteristics 例
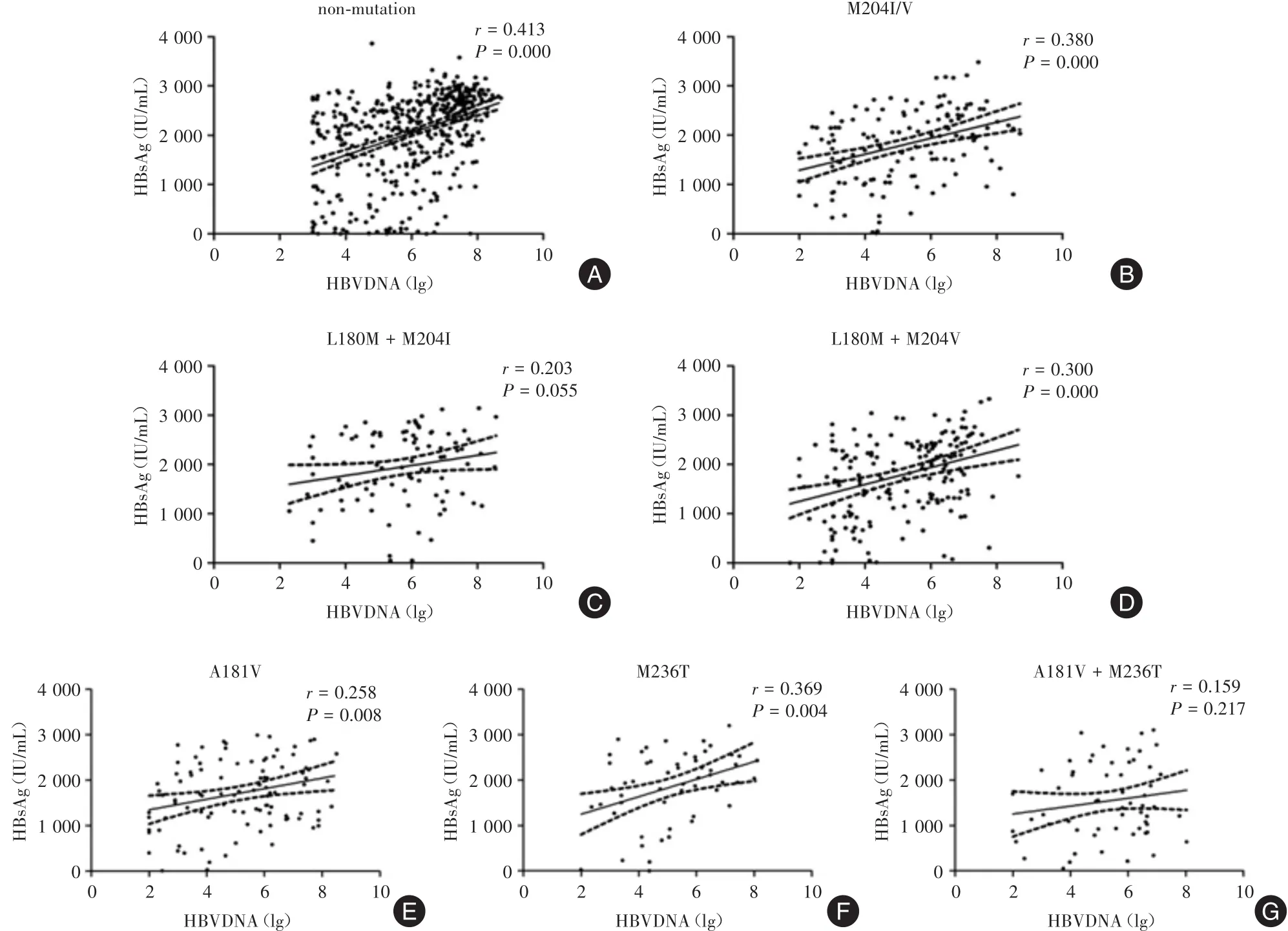
图1 非突变组与各突变组的HBsAg水平与HBV DNA载量间的相关性Fig.1 Correlation between HBsAg and HBV DNA levels in the non-mutation and drug-resistant mutation groups.
2.3 rtL180M+rtM204I突变组的血清HBsAg滴度和HBV DNA水平变化趋势不同于rtM204I/V和rtL180M+rtM204V突变组 rtM204I/V和rtL180M+rtM204V突变组血清HBsAg滴度明显低于非突变组(t=-3.374,P=0.001;t=-3.733,P< 0.001),但rtL180M+rtM204I突变组与非突变组差异无统计学意义(t=-1.233,P=0.219,图2A)。rtM204I/V、rtL180M+M204V、rtL180M+M204I三个突变组的血清HBV DNA水平均明显低于非突变组(t=-6.541,P< 0.001;t=-5.735,P< 0.001;t=-2.906,P=0.009),然而L180M+M204I突变组的血清HBV DNA水平却明显高于M204I/V和L180M+M204V突变组(t=-4.362,P< 0.001;t=-3.763,P< 0.001,图2B)。
2.4 与N236T突变组相比,A181T+N236T联合突变对HBV DNA复制的影响较小,对血清HBsAg水平影响较大 rtA181T、rtN236T和rtA181T+rtN236T突变组的血清HBsAg滴度显著低于非突变组(t=-3.636,P< 0.001;t=-2.037,P=0.032;t=-2.967,P=0.003),且rtA181T+rtN236T突变组明显低于rtN236T单位点突变组(t=2.005,P=0.038,图2D)。与非突变组相比,rtA181T、rtN236T和rtA181T+rtN236T突变组血清HBV DNA水平明显降低(t=-4.127,P< 0.001;t=-3.711,P< 0.001;t=-2.295,P=0.022)。rtN236T和rtA181T+rtN236T突变组在HBsAg/HBV DNA比值上差异有统计学意义(t=-2.117,P=0.021,图2F)。
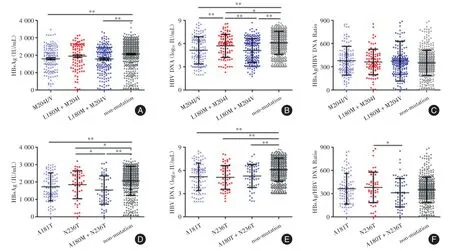
图2 非突变组与各突变组间的HBsAg水平、HBV DNA载量和HBsAg/HBV DNA比值的比较Fig.2 Comparison of HBsAg,HBV DNA and HBsAg/HBV DNA levels in patients with non-mutation and drug-resistant mutations
3 讨论
近年来,随着抗病毒药物在临床上的广泛应用,耐药突变的出现已成为一种普遍现象。在临床实践中,HBsAg滴度和血清HBV DNA水平是HBV复制的重要病毒学标记,它们常被用于评估CHB患者的抗病毒治疗过程的疗效[4]。
HBV DNA复制和HBsAg水平在HBV感染不同阶段的表达机制尚不清楚。既往研究报道HB-sAg水平在免疫耐受期最高,以高HBeAg滴度和DNA负载为特征,HBeAg血清转化后降低。另有研究报告显示,HBeAg阳性患者的血清HBsAg滴度高于HBeAg阴性患者,且与HBV DNA水平呈正相关[15]。笔者的研究结果也显示,无论是在非突变组还是在不同的单位点突变组,血清HBsAg滴度与HBV DNA水平呈正相关。值得注意的是,在rtL180M+rtM204I和rtA181V+rtN236T这两个组合突变组中,血清HBsAg滴度与HBV DNA水平无相关性。提示rtL180M+rtM204I和rtA181V+rtN236T组合突变可能会影响病毒复制的状态,从而打破HBsAg表达与病毒复制的平衡。血清HBsAg滴度可以预测抗病毒治疗中的病毒学反应,早在许多年前就有报道[16-18]。其在HBV感染的自然过程中会发生变化,监测血清HBsAg滴度可以帮助临床医生为患者选择合适的治疗机会和最佳的治疗方案[19]。HBsAg的滴度可能受到HBV基因组突变的影响,包括preS、precore和基底核启动子区域[20-21]。RT区突变可影响HBV逆转录,影响松弛环状 DNA(rcDNA)的形成及其向 cccDNA[13]的转化。此外,HBV以准种的形式存在。在野生型菌株与耐药菌株共存的条件下,NAs治疗仍可产生突变体病毒粒子[11]。因此,在长期治疗期间,耐药突变对HBsAg的影响仍然令人关注。笔者的结果表明,不同的突变对血清HBsAg滴度和HBV DNA水平均有不同程度的影响,其中rtL180M+rtM204I突变组的血清HBsAg滴度较非突变组没有明显差别,但其HBV DNA水平却明显低于非突变组,提示rtL180M+rtM204I的联合突变可以促进空载体病毒颗粒的增加。
与rtN236T单位点突变相比,rtA181T+rtN236T组合突变对HBV DNA复制的影响较小,对血清HBsAg分泌的影响较大,即rtA181T+rtN236T组合突变组的HBsAg/HBV DNA比值较rtN236T单位点突变组低,因此笔者推测可能是A181T+N236T组合突变抑制了S基因的表达,或导致HBsAg分泌紊乱并聚集在肝细胞中。但其机制尚不清楚,还需进一步深入研究。
综上所述,HBV基因组RT区突变可能影响血清HBsAg滴度及其与HBV DNA的相关性。因此,HBsAg与HBV DNA的相关性在NAs治疗中需要重新评估,特别是对于耐NAs的患者,有助于临床调整治疗方案。
