盐胁迫下宁夏枸杞Na+吸收及Na+/H+转运蛋白与H+-ATPase基因表达的研究
2020-03-13丁向真李志英杨淑娟毛桂莲
梁 敏 许 兴 丁向真 李志英 郑 蕊 杨淑娟 毛桂莲
(1宁夏大学生命科学学院,宁夏 银川 750021;2宁夏优势特色作物现代分子育种重点实验室,宁夏 银川 750021;3宁夏大学西北退化生态系统恢复与重建教育部重点实验室,宁夏 银川 750021)
盐胁迫对植物的伤害主要是大量Na+进入细胞后会破坏K+和其他金属元素的吸收,引起渗透胁迫、离子毒害和氧化胁迫[1]。植物在长期进化过程中逐渐形成相应的机制适应多样化的环境变化,盐生植物主要通过限制根系Na+的内流、控制根系木质部Na+的加载、Na+通过木质部的回收及韧皮部的再循环和促进植物体内Na+的外排等适应盐渍环境[2-4]。也有研究表明,盐生植物自身抵御植物盐害的有效策略之一是通过质膜和液泡膜上的Na+/H+转运蛋白与H+-ATPase 互作调节植物在盐胁迫下Na+的吸收及转运[5-7]。
枸杞(Lycium barbarumL.)作为茄科枸杞属落叶灌木中唯一属盐生植物,在宁夏盐碱地有大面积的种植,是改良盐碱地的先锋植物[8]。目前,对枸杞抗盐机理的研究,如NaCl 胁迫下的渗透调节、光合作用、抗氧化保护等方面都取得了一定的成果[9-11],但有关枸杞在分子水平的耐盐机理鲜有报道,尤其是宁夏枸杞离子平衡调控方面。为此,本研究以宁夏枸杞为材料,开展盐胁迫宁夏枸杞Na+、K+含量,质膜和液泡膜Na+/H+转运蛋白和H+-ATPase基因表达变化以及与Na+浓度的相关性分析,探索盐胁迫下宁夏枸杞根Na+/H+转运蛋白和H+-ATPase 与离子变化的关系,旨在为宁夏枸杞耐盐机理研究提供理论依据。
1 材料与方法
1.1 材料与处理试验
选取枸杞宁杞1号种子(由宁夏农林科学院提供),用0.1%高锰酸钾溶液消毒10 min后种到基质中,于人工气候室内培养。待两片子叶展开后移苗进行水培,水培的营养液配方为霍兰格式配方。每3 d更换一次营养液。待枸杞苗生长2个月,长出10片左右叶片后,选取长势一致的枸杞苗进行不同浓度NaCl处理。试验共设置4 组处理:0(CK)、50、100和200 mmol·L-1NaCl,分别于处理24 h、7 d和15 d时取根,一部分于液氮速冻后放-80℃冰箱保存备用,用于基因表达的研究;另一部分材料烘干后用于Na+、K+含量的测定。
1.2 离子相关基因的RT-qPCR检测
取宁夏枸杞根于液氮中研磨,根据多糖多酚植物总RNA提取试剂盒(Tiangen,北京)提取总RNA。用Hiscript® Qselect RT SuperMix for qPCR TIQU 试剂盒(Vazyme,南京)进行反转录。根据枸杞基因组序列(未发表)设计引物(表1)。根据ChamQTMSYBR®qPCR Master Mix 试剂盒(Tiangen,北京)进行qPCR 反应。RT-qPCR 反应体系(20 μL):2×ChamQTMSYBR qPCR Master Mix 10 μL,上、下游引物各0.5 μL,cDNA 2 μL,ddH2O 7.0 μL。PCR 反应程序:95℃预变性孵育3 min;95℃变性10 s,58℃退火30 s(退火温度根据引物不同而异),共循环40次。每个样品重复3次。使用Q5 荧光定量PCR 仪(America,ABI)进行RTqPCR 反应,采用2-ΔΔCt法计算基因的相对表达量。

表1 宁夏枸杞4个基因RT-qPCR 引物Table1 Primers for RT-qPCR of four genes in Lycium barbarum L.
1.3 根中Na+、K+含量的测定
将样品烘干粉碎后取0.1 g,采用TAS-990 分光光度计(北京普析通用仪器有限责任公司)测定Na+、K+含量[12]。
1.4 数据统计与分析
采用Origin 8.0和SPSS 17.0 统计软件对试验数据进行统计分析并作图,用Ducan 新复极差法进行方差分析(P=0.05)。
2 结果与分析
2.1 宁夏枸杞根RNA的样品质量检测
提取枸杞根样品的总RNA,1%琼脂糖电泳后,得到比较清晰的两条带28S和18S,无明显的降解和拖尾现象,完整性好(图1)。此外,测得的A260/A280值均约为2.0,表明提取的枸杞根RNA 纯度高,且无明显降解现象,可满足后续试验。
图1 盐胁迫下枸杞根总RNA的凝胶电泳图Fig.1 Gel electrophoresis total of RNA in Lycium barbarum L.roots under salt stress
2.2 盐胁迫下宁夏枸杞LbSOS1和LbNHX1基因的表达分析
同一胁迫时间(24 h、7 d)下,随着NaCl处理浓度(50~200 mmol·L-1)的增加,质膜Na+/H+转运蛋白基因LbSOS1和液泡膜Na+/H+转运蛋白基因LbNHX1表达量总体呈升高趋势(图2-A、-C);当NaCl处理浓度为200 mmol·L-1时(24 h),LbSOS1和LbNHX1基因的相对表达量均达到最高,LbSOS1 相对表达量与CK相比分别增加了2.49倍和2.99倍,LbNHX1 相对表达量分别较CK 增加了11.68倍和3.62倍。盐胁迫处理15 d时,100 mmol·L-1NaCl处理时LbSOS1和LbNHX1基因相对表达量均最高。同一NaCl处理浓度下,随着胁迫时间的延长,LbSOS1表达量总体呈先升高后降低的趋势(200 mmol·L-1除外)。除胁迫24 h 外,各NaCl处理下的LbNHX1表达量也呈先升高后降低的趋势,且各处理间差异显著(P<0.05)。
2.3 盐胁迫下宁夏枸杞LbHA1和LbVHA-C1基因的表达分析
由图2-B可知,同一胁迫时间下,质膜H+-ATPase基因LbHA1除100 mmol·L-1NaCl 胁迫24 h时相对表达量较低外,随着NaCl处理浓度(50~200 mmol·L-1)的增加,LbHA1基因的相对表达量呈先升高后降低的趋势,即NaCl处理浓度为100 mmol·L-1时其相对表达量最高,分别是CK的1.54倍、3.94倍和1.39倍。由图2-D可知,液泡膜H+-ATPase基因LbVHA-C1 相对表达量变化趋势与LbNHX1 一致(7 d除外)。同一胁迫时间下(24 h、7 d),随NaCl处理盐浓度的增加,LbVHA-C1 相对表达量呈升高趋势。同一NaCl处理浓度下,随着胁迫时间的延长,LbHA1基因的相对表达量总体呈降低趋势(100 mmol·L-1除外),LbVHA-C1基因的相对表达量也呈下降趋势,各个处理之间差异显著(P<0.05)。
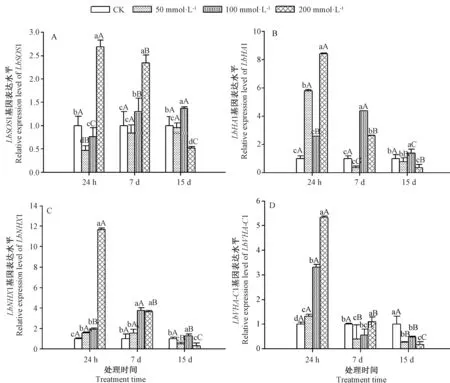
图2 盐胁迫下宁夏枸杞根中离子相关基因的表达情况Fig.2 Expression of ion relative genes in Lycium barbarum L.under salt stress
2.4 盐胁迫下宁夏枸杞根Na+、K+含量及Na+/K+比值的变化
由图3-A可知,当胁迫处理24 h,NaCl处理浓度低于200 mmol·L-1时,宁夏枸杞根中Na+含量变化平缓,各NaCl处理间Na+含量差异不显著(P>0.05);NaCl处理浓度为200 mmol·L-1时,宁夏枸杞根的Na+含量达到最大,胁迫处理24 h、7 d和15 d时Na+含量较CK分别显著增加了1.22倍、1.46倍和3.21倍。同一NaCl处理浓度下,随着胁迫时间的延长,枸杞根系中Na+含量总体呈升高趋势,200 mmol·L-1NaCl 胁迫15 d时枸杞根中Na+含量较胁迫24 h时显著增加了0.98倍(P<0.05)。由图3-B可知,同一胁迫时间下(24 h和7 d),随着NaCl处理浓度的增加,K+含量总体呈先升高后降低的趋势,其中,50 mmol·L-1NaCl处理与CK相比分别增加了69.2%、14.7%。在低NaCl处理浓度下,随着胁迫时间的延长,枸杞根中K+含量总体呈先升高后降低的趋势,即胁迫7 d时各NaCl处理处理下枸杞的K+含量最高。由图3-C可知,同一胁迫时间(24 h和7 d)下,随着NaCl处理浓度的增加,枸杞根中Na+/K+比值呈先降低后升高的趋势。同一NaCl处理浓度下,随着胁迫时间的延长,宁夏枸杞根系中Na+/K+比值总体呈升高趋势,200 mmol·L-1NaCl处理下Na+/K+比值达到最大,各个处理之间差异显著(P<0.05)。
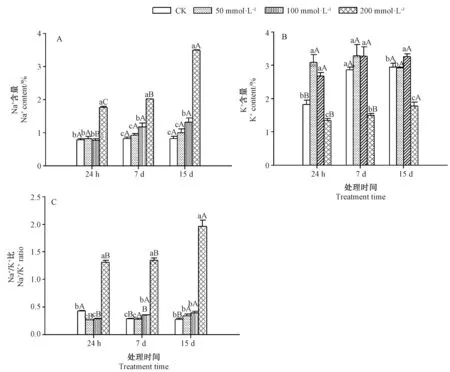
图3 盐胁迫下宁夏枸杞根中Na+、K+含量及Na+/K+比值的变化Fig.3 Changes of Na+ content,K+ content and Na+/K+ ratio in Lycium barbarum L.roots under salt stress
2.5 枸杞根中Na+含量与离子相关基因表达量的相关性分析
不同胁迫时间下,枸杞根中Na+含量与离子相关基因LbSOS1、LbHA1、LbVHA-C1、LbNHX1表达量均存在一定的相关性。其中,枸杞根中Na+含量与基因LbSOS1表达量呈正相关关系,在胁迫24 h和7 d时,二者呈极显著正相关关系(图4-A)。在胁迫7 d时,枸杞根中Na+含量与基因LbNHX1表达量呈正相关关系;胁迫24 h时,Na+含量与基因LbNHX1表达量达到极显著正相关;胁迫15 d时,Na+含量与基因LbNHX1表达量呈负相关(图4-C)。在胁迫24 h和7 d时,Na+含量与基因LbHA1表达量均呈正相关关系,其中,胁迫24 h时,两者呈显著正相关;胁迫15 d时,枸杞根中Na+含量与基因LbHA1表达量呈负相关关系(图4-B)。胁迫24 h时,枸杞根中Na+含量与基因LbVHA-C1表达量呈极显著正相关关系;胁迫7 d时,Na+含量与基因LbVHA-C1表达量呈弱的正相关关系;胁迫15 d时,Na+含量与基因LbVHA-C1表达量呈负相关关系(图4-D)。
3 讨论

图4 盐胁迫下枸杞根中Na+含量与离子相关基因表达量的相关性分析Fig.4 Correlation analysis between Na+ content and expression abundance of ion relative genes in Lycium barbarum L.roots under salt stress
研究表明,植物耐盐的主要途径有渗透调节、Na+的吸收和外排、Na+和K+的选择性吸收、离子的区隔化等[13-14]。植物遭遇盐胁迫后体内Na+含量增加,K+含量降低[15-17]。耐盐植物在盐胁迫下会吸收大量K+作为主要的渗透调节剂,从而减少对Na+的吸收,降低Na+/K+比值[18]。本试验结果表明,在低浓度(<200 mmol·L-1)NaCl 短期胁迫时,宁夏枸杞根中Na+含量变化平缓,K+含量总体呈升高后降低趋势,Na+/K+比值呈降低趋势,说明在低浓度盐胁迫环境下通过吸收更多的K+,可维持细胞内较低的Na+/K+比值,提高植物对Na+胁迫的耐受性;随着NaCl处理浓度的增加,Na+含量升高,而K+吸收减少,是由于Na+、K+竞争K+的结合位点造成了Na+的毒害作用[19-20]。
质膜型Na+/H+逆向转运蛋白由SOS1基因调控表达,能够依赖质膜上H+-ATPase所形成的H+电化学梯度将细胞质Na+排出体外内使植物适应外界环境[21-22]。H+-ATPase和Na+/H+转运蛋白的活性是反映植物盐胁迫环境的关键指标之一[23-24]。研究发现,盐胁迫能够增加拟南芥质膜Na+/H+逆向转运蛋白和H+-ATPase活性[25]。前期试验也证实,一定浓度范围内的盐可以提高质膜H+-ATPase活性[26]。本试验RT-qPCR 结果显示,在短期胁迫内,随着NaCl处理浓度的增加,LbSOS1和LbHA1 相对表达量呈升高趋势,说明适宜的盐浓度(100 mmol·L-1)下,宁夏枸杞在短期胁迫内,细胞质膜和液泡膜上的Na+/H+转运蛋白将Na+运出细胞,从而维持细胞质中Na+的稳态和Na+/K+比值的相对稳定。高盐处理浓度(200 mmol·L-1NaCl)下,短期内枸杞根中LbSOS1和LbHA1表达量较高,但不能将Na+及时排出,导致根系中Na+含量的积累,造成了对枸杞的伤害。液泡膜Na+/H+逆向转运蛋白(NHX)普遍具有调节细胞内pH值,能够将胞液中的Na+或K+区隔化到液泡中,以及维持细胞内离子稳态等功能,在植物抗逆胁迫中有重要作用[27]。H+-ATPase活性的提高为液泡膜对Na+的区隔化及植物对K+选择性吸收运输提供了原初动力[28]。本研究结果表明,胁迫处理24 h时,液泡膜Na+/H+转运蛋白基因LbNHX1、H+-ATPase基因LbVHA-C1的表达量与LbSOS1表达量的变化趋势一致,均随着NaCl处理浓度的增加而升高。相关性分析显示,短期(24 h、7 d)胁迫内,枸杞根中Na+含量与LbNHX1、LbVHAC1、LbSOS1、LbHA1表达量均存在一定的相关性,说明液泡膜的NHX 在依赖于液泡膜H+-ATPase 水解细胞质中的焦磷酸(pyrophosphoric acid,PPi)和腺嘌呤核苷三磷酸(adenosire triphosphate,ATP)的同时,将H+泵入液泡,建立了跨膜的质子梯度,为NHX 转运Na+提供了动力,可将细胞质中过多的Na+区隔到液泡中[29-30]。本研究中,随着胁迫时间的延长和NaCl处理浓度的增加,枸杞根中基因LbNHX1、LbVHA-C1、LbSOS1、LbHA1 相对表达量降低,而根系积累了大量的Na+,导致宁夏枸杞的对盐的耐受性降低。
4 结论
宁夏枸杞低浓度盐胁迫环境下通过吸收更多的K+,维持细胞内较低的Na+/K+比值,提高对Na+胁迫的耐受性。在短期胁迫内,适宜的盐浓度(100 mmol·L-1NaCl)下,枸杞细胞质膜和液泡膜上的Na+/H+转运蛋白依赖H+-ATPase 提供的驱动力,将Na+运出细胞或区隔化液泡,从而维持细胞质中Na+的稳态,这也是宁夏枸杞耐盐的主要原因之一。本研究结果为宁夏枸杞耐盐机理的揭示和利用提供了一定的理论参考。
