基于不同土壤质地棉花根际微生物和酶活性特征分析
2020-03-13刘松涛田春丽曹雯梅郑贝贝李鹏程董合林
刘松涛, 田春丽, 曹雯梅, 郑贝贝, 李鹏程, 董合林
(1.河南农业职业学院, 郑州 451450; 2.中国农业科学研究院棉花研究所, 河南 安阳 455000)
土壤微生物和酶是土壤中的重要有机物,也是土壤中较为活跃的部分。土壤环境的细小变化将会引起土壤微生物及酶活性的改变[1]。细菌、真菌、放线菌是土壤中的主要微生物,它们以土壤中的有机物为物质基础,参与土壤各种养分的转化及循环[1-2],是土壤养分有效释放的主要调节者[2]。土壤酶主要来自于土壤微生物、作物根系分泌物、动植物残体[3],是土壤生化过程的产物,参与土壤有机物的分解,对土壤理化性质产生一定影响,其活性对土壤条件较为敏感,常被用作评判土壤生态系统变化的指标[4-6]。土壤质地是土壤重要的物理性质之一,较多研究已表明,不同土壤质地因其理化性质不同对土壤微生物、酶活性[6-8]及速效养分含量[9-10]产生较大影响,但此类研究多集中在玉米[7,10]、小麦[9]、烟草[6]等作物。且研究发现,作物根际土壤微生物数量和酶活性不仅受土壤质地的影响,还与作物种类及其生长发育进程密切相关[11]。
关于棉花根际微生物数量及酶活性的变化亦有研究[12-14],但不同土壤质地与棉花根际微生物数量及酶活性的互作研究鲜见报导。为了解棉花、土壤质地、微生物三者之间的关系,本研究分析了不同土壤质地条件下棉花花铃期根际微生物数量和酶活性的变化特征,以期从棉花根际微生物数量及酶活性变化方面入手,了解棉花根际土壤微生物、土壤酶与土壤质地的内在联系,分析土壤质地对棉花生长发育的影响,为棉花田间管理提供依据。
1 材料与方法
1.1 试验地概况
试验于2015年4月—2016年11月在河南省农业高新科技园进行,该地属北暖温带气候区,日平均气温14.5 ℃,年均降雨量628 mm,无霜期219~226 d,≥10 ℃的有效积温4 750~5 100 ℃。根据河南省典型土壤质地特征,设砂土(S)、壤土(L)和粘土(C)3种质地处理,每种质地24池,每池体积1 m3(长、宽、高各1 m),由水泥板(长、宽、厚分别为1 m、1 m、0.06 m)围成,下不封底。池面与地面相平,以保证池面以上的小气候与大田相同。同一质地的24池排为无间隔的2排,不同质地的池区间隔1 m宽的观测道。试验池前茬为紫花苜蓿,移栽前3种质地土壤的基本理化性质见表1。
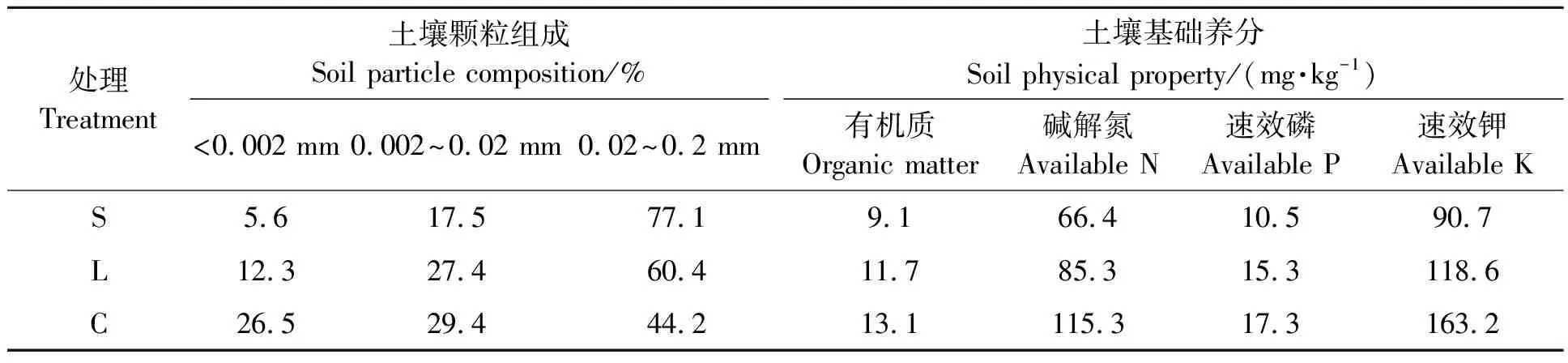
表1 不同质地0~20 cm土壤机械组分及基础肥力
1.2 试验材料
供试棉花品种为‘鲁研棉21’,4月12日育苗,5月10日移栽,每池4株,每株距池边25 cm,株间距50 cm。移栽前每池施高钾复合肥(17-17-17)50 g,折合500 kg·hm-2。初花期每池追施高钾复合肥31 g,折合为310 kg·hm-2,其他管理同丰产田常规管理。
1.3 样品采集与处理
于2015年7月2日(初花期)第一次取土样,以后每隔11 d取样一次,共取样 5次。取样时,去除表层杂物,取0~20 cm土层的根区土壤,每个样品分为3份,一份立即于-20 ℃保存,用于测定根际微生物数量;一份立即带回室内测定土壤水分含量(烘干法);第三份自然风干,用于测定土壤酶活性。
1.4 土壤微生物数量及酶活性测定
真菌采用马丁氏培养基培养,细菌采用牛肉膏蛋白胨培养基培养,放线菌采用高氏1号培养基培养。马丁氏培养基、牛肉膏蛋白胨培养基、高氏1号培养基3种培养基的配制参照文献[15-16],培养后采用稀释平板法进行计数[17]。土壤磷酸酶活性测定用磷酸苯二钠比色法[18],以37 ℃ 1 g干土培养1 h释放出的酚(μg)表示;土壤脲酶活性测定用苯酚钠一次氯酸钠比色法[18],以37 ℃ 1 g干土培养1 h分解尿素产生的NH3-N(μg)表示;土壤蔗糖酶活性测定用3,5-二硝基水杨酸比色法[18],以37℃ 1 g干土培养1 h分解蔗糖产生的葡萄糖(μg)表示。
1.5 数据处理及分析
采用Microsoft Excel 2010进行数据处理,采用DPS 7.0 进行统计分析。
2 结果与分析
2.1 棉花花铃期不同质地土壤根际微生物数量变化
2.1.1细菌数量变化动态 细菌是土壤微生物中数量最多的微生物种群,参与有机质的分解、氨化作用等。不同质地土壤根际细菌数量变化动态见图1,可见,棉花根际的细菌数量随棉花生长发育而变化。3种质地土壤的变化动态表现出相似的单峰曲线,即花后11 d至22 d不断上升,并达到最大值,此后逐渐下降。3种质地土壤间根际细菌数量有较大差异,花后11 d时,表现为粘土>壤土>砂土,壤土和粘土间差异不显著,二者均与砂土间差异显著;至花后22 d前,表现为壤土>粘土>砂土;花后22 d时细菌数量最多,砂土、壤土、粘土的细菌数量分别为11.0×106、14.55×106、13.33×106g-1,壤土含量最高。粘土与壤土的细菌数量除花后11、44 d差异不显著外,其他时段差异均达显著水平,且二者均显著高于砂土中细菌数量。砂土中细菌数量在花铃期变异程度最大,其变异系数达到50.1%。
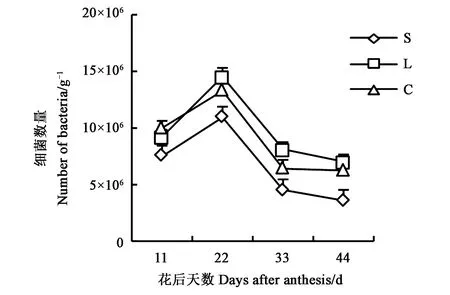
图1 不同质地土壤根际细菌数量
2.1.2真菌数量变化动态 真菌参与土壤中有机质的分解和腐殖质的形成,参与土壤中的氨化作用以及团聚体的形成。不同质地土壤根际真菌数量结果(图2)显示,棉花花铃期3种质地土壤根际真菌数量均呈低-高-低的单峰曲线动态变化,最大值出现在花后22 d。3种质地土壤相比,花后11、44 d时,根际真菌数量表现为粘土>壤土>砂土;花后11 d后,壤土中真菌数量迅速上升,而粘土中真菌数量增加较慢。因此,在棉花生长发育最旺盛的花后22~33 d,真菌数量表现为壤土>粘土>砂土。花后22 d,不仅真菌数量最多,且三种质地土壤间相差最大,砂土、壤土和粘土的真菌数量分别为1.20×104、2.13×104、1.85×104g-1,壤土数量最高,三者间差异均达显著水平。花铃期真菌数量变异程度以壤土最大,其变异系数为36.9%。

图2 不同质地土壤根际真菌数量
2.1.3放线菌数量动态变化 土壤放线菌参与土壤有机物的分解,并能分泌抗生素,拮抗土壤中的病原菌。不同质地土壤根际放线菌数量动态变化结果(图3)显示,放线菌数量低于细菌数量,高于真菌数量,3种土壤质地放线菌数量变化动态与真菌、细菌数量相似,均呈花后22 d为峰值的单峰曲线,到花后44 d数量仍然较多。3种质地土壤的放线菌数量均表现为壤土>粘土>砂土,除花后44 d差异不显著外,其他时段均差异显著。花后22 d时,砂土、壤土和粘土的放线菌数量分别为2.62×106、3.42×106、3.0×106g-1,壤土最高,说明壤土的理化性质最适宜放线菌的代谢活动。
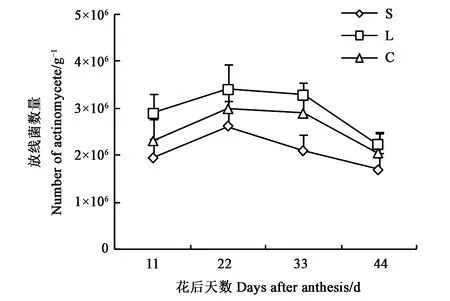
图3 不同质地土壤根际放线菌数量
2.2 不同质地土壤棉花花铃期根际土壤酶活性变化动态
2.2.1脲酶活性变化 脲酶是一种专性酶,仅能水解尿素,其水解产生的氨是植物氮素营养的直接来源,其活性可表征土壤氮素状况及土壤微生物的活性状况[19]。不同质地土壤的棉花花铃期土壤脲酶活性结果(图4)显示,3种质地土壤在整个花铃期的脲酶活性均表现为低-高-低的单峰曲线,以花后22 d活性最大,此时砂土、壤土、粘土的土壤脲酶活性分别为42.5、55.0、55.8 μg·g-1·h-1,粘土较壤土、砂土分别提高38.1%、7.8%。

图4 不同质地土壤根际脲酶活性
2.2.2磷酸酶活性变化 磷酸酶为水解酶类,可以表征土壤磷素状况。随棉花生长发育,不同质地土壤磷酸酶活性结果(图5)显示,从初花至花后33 d,磷酸酶活性增加,并在花后33 d达最大值。3种土壤质地整个花铃期磷酸酶活性均表现为粘土>壤土>砂土。花后33 d时,砂土、壤土、粘土的磷酸酶活性分别为51.3、62.1、65.4 μg·g-1·h-1,粘土较砂土、壤土分别提高21.7%、5.1%。
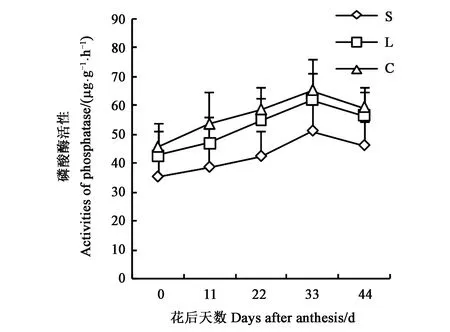
图5 不同质地土壤根际磷酸酶活性
2.2.3蔗糖酶活性变化 蔗糖酶活性能反映土壤中碳的转化和生物学活性强度。不同质地土壤蔗糖酶活性结果(图6)显示,土壤蔗糖酶活性与磷酸酶活性的变化动态相似,3种质地土壤中,蔗糖酶活性均表现为低-高-低的单峰曲线变化,且均在花后33 d达最大值,然后迅速下降。从初花至花后22 d,蔗糖酶活性大小表现为壤土>粘土>砂壤;花后33 d及以后时段表现为粘土>壤土>砂土。整个花铃期,粘土和壤土中的蔗糖酶活性差异较小,均显著高于砂土。在花后22 d,壤土中蔗糖酶活性较粘土和砂土分别高25.1%、6.1%;在花后33 d时,蔗糖酶活性最高,且粘土较壤土和砂土分别高29.1%、5.3%。综上,粘土因保水保肥性能好,在棉花生长后期蔗糖酶活性较高。
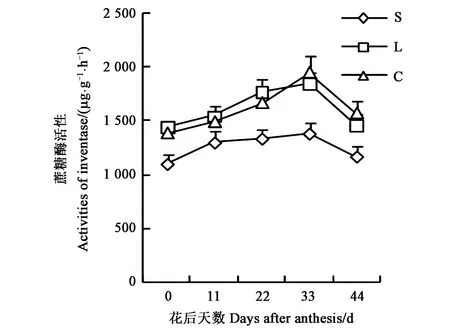
图6 不同质地土壤根际蔗糖酶活性
3 讨论
3.1 土壤质地对棉花根际土壤微生物数量及酶活性的影响
不同质地土壤有效养分及理化性质有较大差异,对土壤微生物种群数量及土壤酶活性有显著影响,这已被研究证实[7-9]。李潮海等[8]研究显示,在土壤微生物数量及酶活性最高的玉米吐丝期,3种微生物数量均以壤土最多,粘土最少;酶活性均以壤土中最高,砂土中最低。严永旺[7]研究表明,烟草根际细菌、放线菌数量以壤土较多,砂土最少;真菌数量以粘土较多,砂土最少;脲酶活性均以粘土最高,砂土最低。邵云等[10]研究表明,小麦灌浆期土壤酶活性以壤土含量最高,其次是粘土、砂土。本研究表明,棉花根际微生物数量均以壤土中最多,其次为粘土;酶活性则以粘土中最高,其次是壤土。微生物数量规律与上述研究一致,土壤酶活性与徐强等[6]相似,与李潮海等[8]、邵云等[10]有一定差异。微生物数量以壤土中最多,可能因为壤土的有机质含量高于砂土,从而为微生物生存提供了良好的物质基础;或是壤土通气状况优于粘土,有利于微生物生长代谢[7]。
土壤质地对土壤酶活性的影响主要通过两个途径实现,一是Busto等[20]提出,土壤中的粘粒能较好地与土壤酶结合形成土壤酶复合体,有利于土壤酶活性的稳定和提高;二是不同质地土壤养分状况及微生物数量会从土壤酶的底物来源以及酶的来源两个方面对土壤酶活性及数量产生影响[21-23]。本研究不同质地土壤棉花根际微生物数量及酶活性有较大差异,微生物数量均以壤土中最多,其次是粘土;土壤酶活性表现为粘土中最高,其次是壤土;壤土与粘土间微生物数量及酶活性差异均不显著,均显著或极显著高于砂土。同时,粘土中的粘粒及土壤有效养分状况均高于或优于壤土,因此粘土中酶活最高。不同研究的作物根际微生物数量及酶活性存在差异,表明作物根际环境是复杂的生态系统,土壤微生物种群数量及土壤酶活性除受土壤质地影响外,还受作物种类、管理措施、取样时期、气候等因素影响,需系统设计试验进行协同研究。
3.2 棉花根际微生物数量和酶活性变化特征
植物在生长发育过程中不断以根际分泌物的形式向根际土壤输入碳、氮等有机化合物,这些有机化合物,除了用来调节植物对矿质养分的吸收以及对其他环境胁迫的抗性外,主要用于维持根际环境的微生物活性[7-8]。根系分泌物还与植物代谢旺盛程度有密切关系,代谢旺盛,根分泌物增多[3]。研究表明,同一作物不同质地土壤的微生物数量及酶活性动态变化的峰值均出现在作物生长发育最盛时期,玉米是吐丝期[8],水稻是孕穗期[1]。本研究不同质地土壤棉花根际微生物数量的峰值出现在花后22 d,正是棉花的盛花期,此时棉花发育最快,其细菌、真菌和放线菌数量最多,表明棉花根际细菌、真菌和放线菌数量与棉花生长发育密切相关。
土壤酶主要来源于作物根系分泌物,其活性是土壤具有生物活性的一种表征。本研究发现,脲酶活性的峰值出现在花后22 d,磷酸酶和蔗糖酶的活性的峰值出现在花后33 d。棉花在花后22~33 d发育最旺盛,对养分需求最强烈,根系分泌物多,酶代谢活性强,因此此时土壤酶活性最高。随棉花生长发育的推移,根系代谢活动减弱,根分泌物减少,酶活性逐渐降低。3种质地土壤整个花铃期脲酶活性均表现为粘土>壤土>砂土,粘土、壤土脲酶活性较高的原因,一是这两种土壤微生物数量多,二是这两种土壤氮素及有机质含量高,使脲酶活性增强。
综上,在作物、土壤、微生物等相互作用的生态系统中,土壤微生物数量及酶活性受作物生长发育及土壤质地的双重影响,且作物生长发育造成的影响程度大于土壤质地。因此,在棉花生产布局时,建议优先种植在壤土中,其次是粘土。在棉花高产管理上,为增强土壤微生物活性,提高养分利用率,应增施有机肥,同时壤土植棉应增施磷肥,粘土植棉氮肥、磷肥要适量,并加强水分管理,砂质土植棉应增施钾肥。
