聚多巴胺修饰金纳米花的可控制备及在光热治疗中的应用
2020-03-12邬丰任刘永佳陆学民朱邦尚
邬丰任,刘永佳,陆学民,朱邦尚
(1. 上海交通大学分析测试中心,2. 化学化工学院,上海 200240)
金纳米花(AuNFs)是一类具有类似花状分支结构的金纳米颗粒,与金纳米球和金纳米棒相比,金纳米花具有更大的比表面积及更高的反应活性[1~4],可作为基底放大拉曼散射信号(SERS)或者用于催化某些反应[5~7]. 此外,金纳米花具有稳定性高、生物相容性好且在近红外区有良好吸收的特点[8],因此,可作为纳米生物材料应用于载药、成像及光热治疗等生物医学领域.
目前,关于金纳米花的合成方法以模板法为主,通过在合成过程中加入表面活性剂实现对颗粒形态的调控. 如Barbosa等[9]将聚乙烯吡咯烷酮(PVP)作为保护性聚合物模板制备了分支结构丰富的金纳米花; Han等[10]以多氨基表面活性剂(C18N3)制得的囊泡为模板,合成了一种大颗粒的空心金纳米花,其在可见光下表现出较好的生物安全性并在近红外光的辐射下对HeLa细胞具有强大的光热治疗能力. 而无模板法制备金纳米花则是直接对氯金酸进行还原. Kumari等[11]使用硼氢化钠对氯金酸直接还原制得金纳米花,经进一步修饰得到了可用于药物输送的金纳米花支架; Zhao等[12]先用柠檬酸钠还原氯金酸得到金种子,进一步生长得到分支长度可控的金纳米花; Mao等[13]使用盐酸羟胺对氯金酸进行还原,得到的金纳米花能有效催化降解除草剂二甲戊乐灵. 与模板法相比,无模板法制备金纳米花更加便捷,且不使用表面活性剂,得到的金纳米花无需后处理即具有较低的体外细胞毒性和较好的生物相容性.
在碱性条件下,多巴胺可在各种材料表面迅速聚合形成聚多巴胺(PDA)膜,其中包含大量亲水的羟基和氨基官能团,可以提高材料表面的亲水性并促进细胞的黏附,具有良好的生物相容性,被广泛应用于生物材料的表面改性; 同时,聚多巴胺的最大吸收波长可延伸至近红外区,可作为光热试剂[14~17]. 利用聚多巴胺修饰金纳米花不仅可以降低金纳米花本身的细胞毒性,还能提高整个纳米粒子的光热效应.
本文通过改变无模板法合成金纳米花过程中的反应温度及还原剂用量,实现了对金纳米花表面分支结构以及金纳米花大小的调控; 进而通过对金纳米花进行聚多巴胺修饰,利用聚多巴胺包裹层低毒、稳定、生物相容性好,且对金纳米粒子进行包裹后最大吸收波长红移的特点,制备了聚多巴胺修饰金纳米花(PDA-AuNFs),并通过调节多巴胺浓度控制聚多巴胺层厚度,实现了金纳米花最大吸收波长的大幅度红移,提高了其在近红外区域的吸收范围. 通过光热实验进一步证明聚多巴胺修饰的金纳米花有较强的光热效应; 通过细胞实验进一步证明该纳米材料的低毒性及对肿瘤细胞的光热治疗能力,展现了其作为光热试剂在生物医学领域的应用前景.
1 实验部分
1.1 试剂与仪器
氯金酸(HAuCl4·4H2O)、抗坏血酸(AA)、盐酸羟胺(NH2OH·HCl)、碳酸钾(K2CO3)、盐酸多巴胺(DA·HCl)、浓盐酸(HCl,质量分数为37%)、浓硝酸(HNO3,质量分数为65%~68%)、二甲基亚砜(DMSO)和三羟甲基氨基甲烷(Tris)均购于国药集团化学试剂公司; 噻唑蓝(MTT)购于Sigma-Aldrich公司; 细胞培养基(DMEM)、胎牛血清(FBS)和磷酸盐缓冲液(PBS,6.7 mmol/L,pH=7.2~7.4)购于Life Technologies公司; HeLa细胞购于中国科学院上海细胞研究所; 实验用水为超纯水(电阻率>18 MΩ).
Evolution 300型紫外-可见分光光度计(UV-Vis),美国Thermo Scientific公司; Omni型纳米粒度/Zeta电位仪,美国Brookhaven公司; Tecnai G2 spirit Biotwin型生物型透射电子显微镜(TEM),美国FEI公司; Nicolet 6700型傅里叶变换红外光谱仪(FTIR),KBr压片,扫描范围4000~400 cm-1,美国Thermo Fisher公司; 3kW/*D8 ADVANCE Da Vinci型多功能X射线衍射仪,CuKα辐射源,λ=0.1541 nm,扫描速率0.02°/s,扫描范围2θ=10°~90°,德国Bruker公司; Elx800型酶标仪,美国Bio Tek公司; Ti125型红外热像仪,美国Fluke公司; FC-808-5000-MM型808 nm激光器,上海滨崎科技有限公司.
1.2 实验过程
1.2.1 金纳米花的制备 将实验用烧瓶及磁子用王水(浓盐酸/浓硝酸体积比3∶1)浸泡后,用超纯水冲洗干净并烘干. 在0 ℃下将1 mL 1%氯金酸加入100 mL超纯水中,搅拌下加入4 mL 200 mmol/L K2CO3与40 μL 5 mmol/L AA溶液,5 min后快速加入4 mL 10 mmol/L NH2OH·HCl,搅拌10 min后反应结束. 在6000 r/min转速下离心6 min,除去上层清液,沉淀用超纯水重复离心洗涤3次后得到金纳米花,将其均匀分散在超纯水中,置于4 ℃冰箱中备用.
将反应温度分别调整为10,20,30或40 ℃,反应试剂用量及过程不变,考察温度对所合成样品的影响.
在0 ℃条件下,将还原剂AA的用量分别调整为20,60和80 μL,其余试剂用量及后处理条件不变,考察还原剂AA用量对所合成样品的影响.
1.2.2 聚多巴胺修饰金纳米花的制备 将20 μL AA制得的金纳米花分散于10 mL Tris-HCl缓冲液(50 mmol/L,pH=8.5)中,加入1 mL多巴胺水溶液(1 mg/mL),反应3 h后,在6000 r/min转速下离心6 min,除去上层清液,沉淀用超纯水重复洗涤、离心3次后,将获得的产物分散在超纯水中进行后续表征.
将多巴胺溶液浓度调整为2及5 mg/mL,其余试剂用量及反应过程不变,考察多巴胺用量对所合成样品的影响.
1.2.3 聚多巴胺修饰金纳米花的光热性能实验 配制浓度为200 μg/mL由20 μL AA制得的金纳米花与5 mg/mL多巴胺溶液反应制得的聚多巴胺修饰的金纳米花水溶液,取2 mL该溶液和2 mL超纯水作为参照,分别置于1 cm石英比色皿中,使用808 nm激光器(1 W/cm2)分别照射10 min,通过红外热像仪每1 min记录1次溶液温度,重复实验3次.
1.2.4 体外细胞毒性评价 将HeLa细胞以每孔1.0×104个细胞+200 μL DMEM培养液(含10%胎牛血清)接种于96孔板中,置于37 ℃,5% CO2培养箱中培养24 h,待细胞完全贴壁后吸出培养基,新加入200 μL DMEM培养液. 将由20 μL AA制备的金纳米花或由5 mg/mL多巴胺溶液制得的聚多巴胺修饰金纳米花分别配制成10,50,100,250,500和1000 μg/mL(金纳米花浓度)溶液,再以每个样品每个浓度设置6个孔,每孔50 μL的量加入孔板中,使样品的最终浓度分别为2,10,20,50,100和200 μg/mL. 在培养箱中继续培养48 h后,吸出每个孔板中的培养液,用PBS缓冲液清洗2次,在每个孔中分别加入200 μL培养液与20 μL 5 mg/mL MTT后继续培养3~4 h; 然后,吸出培养液及MTT溶液,每孔加入200 μL DMSO,振荡10 min后使用酶标仪在490 nm波长下检测光密度(OD)值.
光热实验组体外毒性评价实验与上述过程基本一致,但在加入含金纳米花或聚多巴胺修饰金纳米花溶液培养12 h后,用808 nm激光器(1 W/cm2)对每个孔持续照射10 min,然后在培养箱中培养36 h; 同样使用MTT法测定细胞光密度(OD)值.
2 结果与讨论
2.1 温度对金纳米花形貌的影响
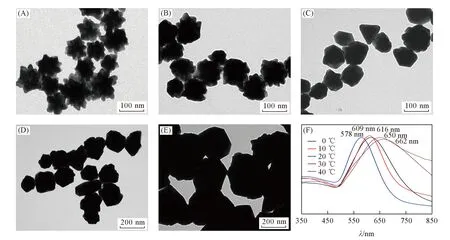
Fig.1 TEM images(A)—(E) and UV-Vis spectra(F) of AuNFs synthesized at different temperatures Temperature/℃: (A) 0; (B) 10; (C) 20; (D) 30; (E) 40.
反应温度是影响金纳米花形貌和粒径大小的重要因素之一. 在图1(A)~(E)所示TEM照片中,反应温度由0 ℃逐渐上升至40 ℃,金纳米花的形貌从表面粗糙、分支结构丰富逐渐转变为表面光滑、分支短小甚至消失,当反应温度为30和40 ℃时,金纳米花表面的分支结构基本消失,粒径却显著增大. 这可能是由于温度不同导致Au3+和还原剂的扩散速度存在差异,使得Au0在金种子表面生长速度不同所致[18]. 金纳米花的合成通过2步反应实现: 第一步是金种子形成,由AA对Au3+还原制备金种子; 第二步则是金纳米花颗粒形成,由NH2OH·HCl还原Au3+成金原子在金种子上进一步生长形成特定形貌纳米颗粒. 温度较低时,Au3+还原生成的金原子活性种在溶液中的扩散速度较慢,易形成具有丰富分支结构的金纳米花; 而当温度升高时,金离子在溶液中的扩散速度加快,与还原剂反应机率增加,从而加速了金种子表面金的还原生长,形成粒径较大、表面更加光滑的金纳米颗粒. 通过比较反应温度可知,低温即在0 ℃条件下,金纳米花的分支结构最丰富,其对应的纳米金花粒径约为80 nm,对应的最大可见吸收波长为616 nm[图1(F)]. 进一步比较图1(A)~(C)发现,0,10和20 ℃时合成的金纳米花虽然粒径基本相同,但是由于形态变化较大,最大吸收波长也存在差异,其中0 ℃合成的金纳米花表面分支最多. 分支结构的生长导致其最大吸收波长向近红外区红移[19],从而导致相应的最大吸收波长最大.
另外,温度也会影响金纳米颗粒的大小和对应的最大吸收波长. 对于30和40 ℃下合成的金纳米粒子[图1(D)和(E)],除了随着温度升高表面分支结构消失外,粒径也显著增大,最大吸收波长与0 ℃下合成的金纳米花相比发生了红移,这是因为较高温度下生成了粒径更大的金纳米粒子,对应的最大吸收波长也更大[20].
2.2 还原剂AA用量对金纳米花粒径的影响
基于0 ℃制备金纳米花具有最丰富的分支结构这一特点,进一步地考察了AA用量对金纳米花粒径的影响. 在金纳米花的合成过程中,AA浓度影响金种子生成的单位浓度,最终影响合成的金纳米花的粒径大小. 4种AA浓度条件下制备的金纳米花粒径在60~100 nm范围内,其形态及分散在溶液中用动态光散射仪测得的水合粒径大小如图2及图3(A)所示. 通过比较发现, AA的浓度越大,金纳米花的粒径越小. 这是由于在反应过程中AA的浓度越高,生成的金种子越多,在氯金酸用量即反应浓度不变的条件下,参与金种子生长反应的氯金酸量越小,得到的金纳米花粒径也越小. 由图3(B)可知,4种金纳米花表面的zeta电位在(-23.94±1.69)~(-25.01±2.11) mV范围内. 反应过程中,金纳米花表面吸附了NH2OH·HCl中的Cl-从而带负电[21]. 另外,图3(C)是4种金纳米花的紫外-可见吸收光谱,以 40 μL AA 制得金纳米花为参比,当反应体系中AA用量高于40 μL时,金纳米花的最大吸收波长小于616 nm,发生蓝移; 反之,AA用量低于40 μL时,最大吸收波长大于616 nm,发生红移.

Fig.2 TEM images of AuNFs synthesized with different amounts of AAV(AA)/μL: (A) 20; (B) 40; (C) 60; (D) 80.

Fig.3 Hydrodynamic diameter(A),zeta potential(B) and UV-Vis spectra(C) of AuNFs synthesized with 20,40,60 and 80 μL AA
2.3 聚多巴胺修饰金纳米花的表征
多巴胺能在碱性溶液中发生聚合反应形成聚多巴胺,且易吸附修饰在金纳米花表面. 为进一步探究聚多巴胺修饰层厚度对金纳米花性能的影响,根据最大吸收波长和分支结构的丰富程度,选定0 ℃下用20 μL AA制得的金纳米花为代表,以不同浓度多巴胺进行聚多巴胺修饰. 将20 μL AA制得的金纳米花以AuNFs20表示,与1,2和5 mg/mL多巴胺溶液反应制得的聚多巴胺修饰金纳米花分别以PDA-Au1,PDA-Au2及PDA-Au5表示.
在对金纳米花进行聚多巴胺修饰后,采用红外光谱进行了表征. 图4(A)为AuNFs20,PDA-Au5及多巴胺的红外光谱图. 通过比较发现,聚多巴胺修饰的金纳米花的红外谱线上1285与1500 cm-1处出现了吸收峰,前者可归属为聚多巴胺上芳环的吸收,后者可归属为聚多巴胺上N—H键的弯曲振动[22]. 由XRD谱图[图4(B)]可看出聚多巴胺修饰前后对金纳米花结构的影响: AuNFs20和PDA-Au5均有5个衍射峰,分别位于38.28°,44.56°,64.77°,77.84°和81.93°处,可归属于金的(111),(200),(220),(311)和(222)晶面,表明其为面心立方晶体结构[19],显示经聚多巴胺修饰后该晶体结构未发生显著变化. AuNFs20的粒径可根据Scherrer公式:D=Kλ/βcosθ计算[式中,D(nm)为样品粒径;K为Scherrer常数,取0.89;λ为X射线波长,取0.1541 nm;β为样品XRD谱图衍射峰的半峰宽(弧度);θ为布拉格衍射角(角度)]. 经Scherrer公式计算得出AuNFs20的粒径为78.76 nm,这与图5(A)所示TEM照片中AuNFs20约100 nm的粒径尺寸相比存在一定误差,这主要是由于金纳米花并不是均匀的球形所致.

Fig.4 FTIR spectra of AuNFs prepared with 20 μL AA(AuNFs20),AuNFs modified with 5 mg/mL DA·HCl(PDA-Au5) and DA·HCl(A) and XRD patterns of standard Au(JCPDS No. 89-3697),AuNFs20 and PDA-Au5(B)
进一步利用TEM表征了金纳米花表面修饰聚多巴胺层的厚度. 图5(A)~(D)分别为AuNFs20,PDA-Au1,PDA-Au2与PDA-Au5的TEM照片,可见,聚多巴胺修饰后,金纳米花本身的形貌基本无变化,制备PDA-Au1,PDA-Au2和PDA-Au5时聚多巴胺溶液的浓度比为1∶2∶5,对应的聚多巴胺层厚度依次为8.7,9.3及14.2 nm. 可见,随着多巴胺溶液浓度的增大,形成的聚多巴胺层厚度也逐渐增大,结合图6(A)结果可知,AuNFs20被聚多巴胺修饰后,聚多巴胺层的存在使整个材料的亲水性增强,可在水溶液中形成水合层,水合粒径也相应增大[23]. 聚多巴胺层的存在导致制得的纳米粒子粒径变大. 由图6(B)可见,PDA-Au1,PDA-Au2与PDA-Au5的zeta电位依然是负值,这是由于聚多巴胺包裹层上的酚羟基发生去质子化所致[24].

Fig.5 TEM images of AuNFs20(A),PDA-Au1(B),PDA-Au2(C) and PDA-Au5(D)
经聚多巴胺修饰后金纳米花的一个最显著特征是其最大吸收波长发生了显著红移,且聚多巴胺层越厚,红移程度越大. 图6(C)为AuNFs20,PDA-Au1,PDA-Au2及PDA-Au5的紫外-可见光谱图,对应的最大吸收波长分别为652,692,704和737 nm. 显然,聚多巴胺层越厚,最大吸收波长的红移程度越明显,以AuNFs20 作为基准,PDA-Au1,PDA-Au2和PDA-Au5的最大吸收波长分别红移了约40,50及80 nm. 这种红移现象是由于聚多巴胺层的存在增大了金纳米花的消光与散射截面,进一步提高了折光率,从而使金纳米花的最大吸收波长发生红移[17]. 因此,聚多巴胺的修饰能促进金纳米花的吸收波长从可见吸收区向近红外区移动,在一定程度上提高了其光热效应[23].

Fig.6 Hydrodynamic diameters(A),zeta potentials(B) and UV-Vis spectra(C) of AuNFs 20(a),PDA-Au1(b),PDA-Au2(c) and PDA-Au5(d)
2.4 修饰前后的光热性能变化
金纳米花经聚多巴胺修饰后其光热性能显著增强. 图7(A)示出了使用808 nm激光器在1 W/cm2条件下照射10 min后3个样品的升温变化. 由图7(B)所示温度-时间曲线发现,对照组超纯水的温度几乎无变化,而AuNFs组的温度则上升了13.3 ℃,PDA-Au5组温度上升了29.4 ℃,达到近57 ℃,该结果表明,聚多巴胺层的修饰能有效增强金纳米花的光热转换效应.

Fig.7 Thermal images(A) and temperature-time profiles(B) of H2O(a),AuNFs20(b) and PDA-Au5(c) under irradiation of 808 nm laser(1 W/cm2) for 10 min
2.5 修饰前后的体外细胞毒性评价
为进一步考察金纳米花经聚多巴胺修饰前后的生物相容性,采用MTT法评价了用AuNFs20及PDA-Au5 体系体外培养48 h后的细胞毒性. 结果如图8(A)所示,对于AuNFs20组,随着其浓度由5 μg/mL逐渐上升至200 μg/mL,细胞存活率逐渐下降,当浓度达到200 μg/mL时细胞存活率约为75%. 而对于PDA-Au5组,其浓度升高至200 μg/mL时细胞存活率却达到近90%. 显然,聚多巴胺的修饰显著降低了金纳米花的细胞毒性,提高了其生物相容性. 在图8(B)所示光热治疗组中,二者的细胞毒性显著提高,当AuNFs20浓度为200 μg/mL时,细胞存活率下降至约30%,相比之下,同样浓度的PDA-Au5组的细胞存活率稍高于10%,此结果表明聚多巴胺修饰的金纳米花光热转换效应得到提高,增强了对肿瘤细胞的杀伤能力. 因此,聚多巴胺修饰的金纳米花是一种可用于肿瘤光热治疗的潜在光热转换剂.

Fig.8 Cytotoxicity of HeLa cells cultivated with AuNFs and PDA-Au5 without(A) or with(B) a 10 min laser(1 W/cm2)
3 结 论
采用无模板法制备了具有丰富分支结构的金纳米花. 通过改变反应温度与还原剂AA(抗坏血酸)用量可有效调控金纳米花的形貌与粒径: 反应温度越低,金纳米花分支结构越丰富,其中0 ℃为最佳反应温度; AA用量越高,金纳米花粒径越小,金纳米花粒径可控制在60~100 nm; 相应地,最大吸收波长在575~650 nm范围内. 聚多巴胺层对金纳米花的修饰提高了金纳米花的最大吸收波长,使其位于近红外区的吸收范围(650~740 nm); 同时,聚多巴胺层的厚度随溶液中多巴胺浓度的增加而增大,最大厚度可达约14 nm,对应的最大吸收波长则红移约80 nm; 经激光器照射后,聚多巴胺修饰的金纳米花溶液在10 min内温度即可升高至57 ℃. 体外细胞毒性实验证明,金纳米花经修饰后细胞毒性较低,生物相容性良好,且在激光器照射下对肿瘤细胞有较强杀伤能力,这表明经聚多巴胺修饰的金纳米花在光热治疗生物医学领域具有潜在的应用前景.
