玻璃纤维固定化光合细菌连续产氢实验研究
2020-03-12张桂芝王星敏彭荣贺有周张杰
张桂芝,王星敏,彭荣,贺有周,张杰
(重庆工商大学 环境与资源学院,重庆 400067)
氢能是解决环境问题的最理想的能源[1]。生物制氢是发展新能源的一个重要研究方向[2]。具有其他制氢方法无法替代的优越性[3]。固定化光合细菌通常比悬浮态产氢能力要高[4]。但固定化载体如果不透光,将影响产氢效率[5]。而较小比表面积载体会使得固定化细菌生物量不够,底物利用率低。且存在细胞与底物的接触面积较小、传质距离较远、传质阻力大等问题[6]。
本文制作了一种透光玻璃纤维固定化光合细菌连续产氢反应器,研究了光合细菌的固定化过程及其产气特性,考察了底物中葡萄糖浓度,进料流速以及不同光源对产氢的影响,获得了该反应器最佳产气条件。
1 实验部分
1.1 试剂与仪器
玻璃纤维(φ9~20 μm),产自中国医药集团上海化学试剂公司;葡萄糖、氯化铵、磷酸二氢钾、碳酸氢钠、盐酸、氯化镁、氯化钠、甲醛均为分析纯;酵母膏为生化试剂;光合细菌菌种为产氢红螺菌属沼泽红假单胞菌[7]。
TOC-VCPN总有机碳总氮分析仪;ZDS-10自动量程照度计;SY-9303B质量流量计;Spx-250-GB光照培养箱;SP6890气相色谱仪:UV-3100PC紫外可见分光光度计;H20502-1高速冷冻离心机;FE20型酸度计。
1.2 实验装置
制氢反应器(图1)采用透光性能良好的PMMA有机玻璃制成。反应室填充25 g玻璃纤维,作为光合细菌的固定化载体,周边用紧固螺栓固定密封。光生化反应室容积为120 cm3,顶部气室容积为12 cm3,床层采光面面积为200 cm2。反应器内介质流向设置为下进上出方式,反应产生的气体由顶部设置排气孔排出,进入排水集气管。

图1 反应器示意图Fig.1 Reactor design
整个实验装置见图2。用硅胶管连接各个部分,底物用恒流泵计量,气体用带刻度玻璃集气管收集并计量。实验所用玻璃设备均用高压灭菌锅灭菌,实验开始前,整个管路先用36%甲醛溶液灭菌,再用灭菌的蒸馏水将整个流路彻底清洗。

图2 实验装置示意图Fig.2 The experiment system1.反应器;2.光源灯;3.恒温箱;4.培养基储瓶;5.蠕动泵;6.废液瓶;7.集气装置
1.3 实验方法
细菌固定化阶段,使用生长培养基,接种光合细菌,采用循环挂膜法[8],使光合细菌在反应器中的玻璃纤维上吸附生长。生长培养基[9]:NH4Cl 1.0 g/L,CH3COONa 2.0 g/L,NaHCO30.5 g/L,NaCl 1.0 g/L,KH2PO40.2 g/L,MgCl20.2 g/L,T.M液1 mL/L,酵母膏0.8 g/L。当玻璃纤维变成鲜红色,培养液OD值>0.8时,即可认为固定化成功。
细菌固定化成功后,排出培养液,输入产氢培养基,进行连续产气实验。产氢培养基配方:葡萄糖2~10 g/L,蛋白胨2.0 g/L,NaHCO30.4 g/L,KH2PO40.2 g/L,MgCl20.2 g/L,NaCl 1.0 g/L,T.M储液1 mL/L,pH调节为7。采用总有机碳及总氮分析仪分析底物浓度变化,采用气相色谱仪分析计算产氢速率[10],分别考察不同光源、不同进料流速、不同底物浓度对产氢过程的影响。
2 结果与讨论
2.1 固定化阶段光合细菌的生长
将液体生长培养基接种后通过恒流泵注入到反应器中,循环流动培养,流速控制在1 mL/min,培养基总量为300 mL,接种6%左右对数生长期菌悬液。接种后发现,经过短暂的适应期,部分细菌就开始吸附生长在玻璃纤维上,使纤维呈现微红色。

图3 固定化阶段培养基OD值变化曲线图Fig.3 Change of OD600,TOC,TN versustime during immobilization stage
由图3可知,接种24 h后,TOC开始急剧下降,液体培养基OD值快速升高。此阶段细菌快速增值,处于对数生长期。细菌在纤维载体上大量生长,纤维的颜色变化明显,红色逐渐加深,培养液中游离的光合细菌也增多,因此OD值快速升高。整个固定化过程中,反应器出口端的氮源浓度变化不是很大,与碳源的消耗量及消耗速率相比,细菌对氮源的需求量及消耗速率并不大。

A.固定化光合细菌前 B.固定化光合细菌后图4 玻璃纤维固定化光合细菌照片Fig.4 The photographs of photosyntheticbacteria immobilized on glass fiber
由图4可知,固定化光合细菌前,反应器中的玻璃纤维为白色,接种120 h后,由于细菌在纤维上吸附生长,玻璃纤维颜色变为鲜红色,证明光合细菌固定成功。根据图3可知,接种120 h后,循环液OD值>0.8,且变化趋缓,氮源和碳源的浓度变得较低。当总有机碳<65 mg/L时,即可终止固定化过程。光合细菌固定化成功的反应器将用于连续产气实验。
2.2 光源对代谢产氢过程的影响
通过调节不同的光源与反应器之间的距离,保持同等光照强度2 000 lux,进行连续产气实验。
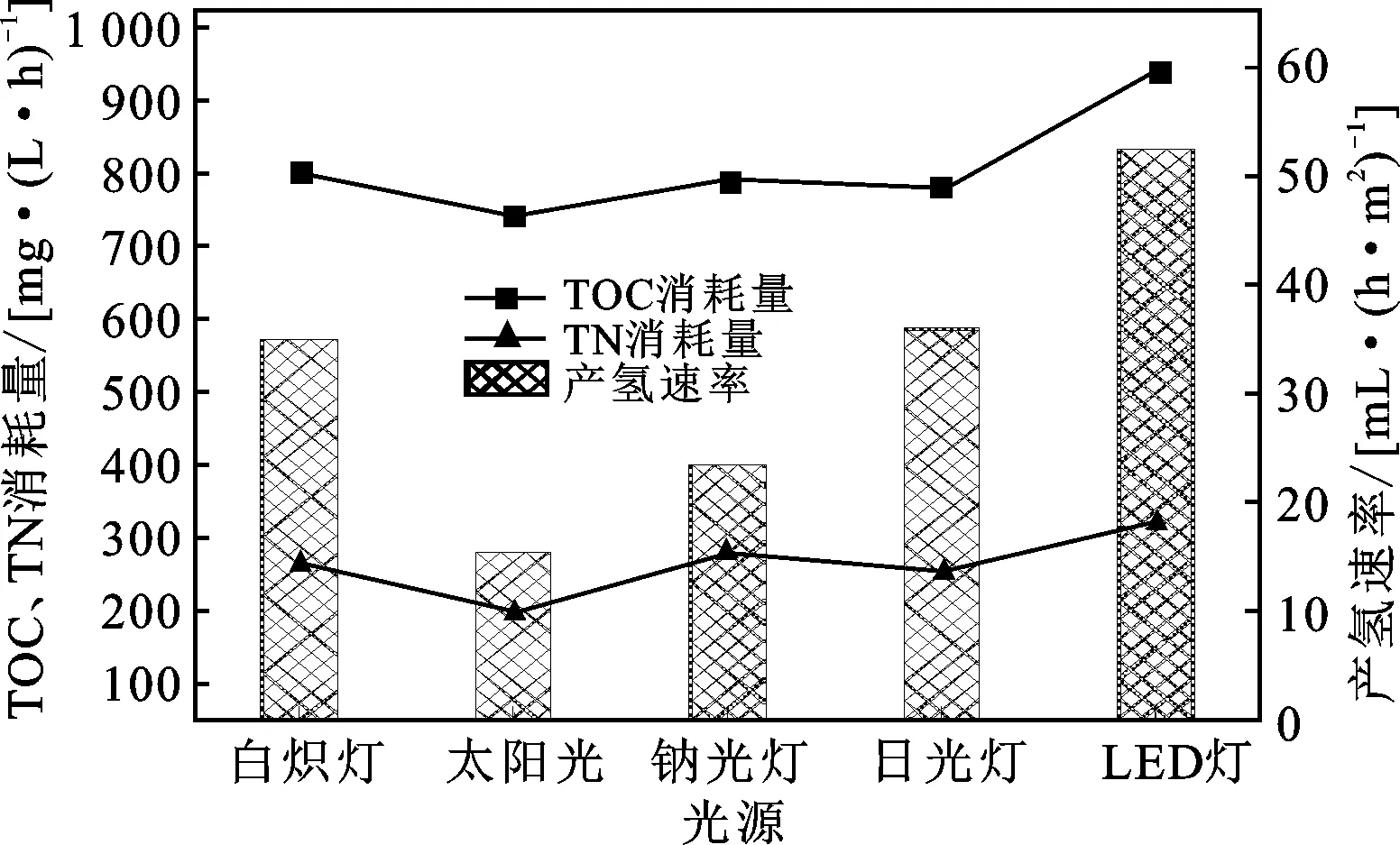
图5 不同光源下TOC、TN消耗量与产气速率Fig.5 TOC,TN consumption and hydrogen productionrate under different light sources
由图5可知,对于白炽灯和日光灯,细菌产气速率相当。由于吸收波长的原因,在钠光灯作用下产气速率较低,LED灯作用下产气速率最大[11]。由于白炽灯光照过程中发热量较大,使得光反应器局部温度升高,而不利于光合细菌的代谢活动,因而产气量较低。日光灯管由于呈柱状,致使平面式采光面各处光照度不太一致,中间部分光照度较大,离灯管较远的边缘处则光照度较低,也导致产气速率偏低。而LED光源呈平板式,各处光强相同,且能与采光面平行放置,使得反应器受光面各处光照度相当;同时,由于LED为冷光源,发热量低,不会导致反应器温度升高,从而有利于反应器温度维持细菌生长的恒定温度,保证其处于最佳代谢温度,因而产气率较其他光源高。不同光照情况下的TOC、TN含量则变化不太大,其中白炽灯、钠光灯、日光灯作用下细菌对氮源和碳源的消耗量均偏低,LED灯照射下消耗的底物最多。这也与其产气量最大相符。表明在这种光照条件下,有利于光合细菌的代谢和光照产氢,后续实验均以LED灯作为光源。
2.3 进料流速对代谢产氢过程的影响
在相同的底物浓度及光照度情况下,底物进料速度对产气速率会有显著影响[12]。

图6 流速对TOC、TN消耗量以及产氢速率影响Fig.6 Effect of flow rate on TOC,TN consumptionand hydrogen production rate
由图6可知,在不同流速下,光合细菌对碳源和氮源的消耗量不同。当进料流速<4 mL/min时,随着流速的增大,底物消耗量有小幅上升,在4 mL/min时达到最大值。提高反应器流速可以增加反应器中主流区与生物膜之间的对流传质系数,起到强化底物从主流向生物膜传质过程的作用[12]。但当流速>4 mL/min后,由于流速过快,扰动加剧,并可能将部分光合细菌生物膜冲刷掉,降低了生物膜对培养液中的营养物质的利用率,且由于底物在反应器内的停留时间过短,不利于TOC、TN在反应器内的传递和反应。因此,虽然过低的流速可能会增大传质阻力,使得营养物质不能快速扩散至固定化细菌的细胞膜表面,但是增大了底物在反应器内的停留时间,因而底物消耗量比在高流速下的要高。对本反应器而言,对流传递不起控制作用,底物在生物膜内的扩散速率和菌体对底物的消耗速率决定了底物的利用效率[13]。产气速率与底物消耗速率随流速的变化呈现相同的趋势。低流速更有利于固定化具体的产气。因此,进料流速控制在4 mL/min为宜。
2.4 底物浓度对代谢产氢过程的影响
由图7可知,细菌在葡萄糖浓度为6 g/L的情况下,产生气体体积最大,此时,细菌底物中消耗的碳源、氮源均为最多。表明该细菌在葡萄糖浓度为6 g/L的情况下生长繁殖最活跃。随着底物浓度的增加,反应器内主流区与生物膜区之间的传质驱动势也是逐渐增加,使得更多的底物被传递到生物膜区域用于产氢代谢[14]。因此,在低底物浓度情况下,反应器的产氢速率随着底物浓度增大会逐渐增加。当反应器进口底物浓度继续增加至6 g/L以上时,虽然传递到生物膜的葡萄糖量增大。但是超过了光合细菌生物膜的代谢能力,所以,产氢活性呈逐渐下降趋势。结果表明,当传质速率大于生化反应速率时,就会对生物膜代谢产生抑制作用,降低光合细菌生物活性,导致反应器的产氢速率降低。因而底物浓度必须维持在一个最佳的浓度范围。

图7 葡萄糖浓度下底物的消耗速率与产氢速率Fig.7 The rate of substrate consumption and hydrogenproduction of glucose concentrations
3 结论
(1)光合细菌能成功在玻璃纤维上固定化生长。通过不同光源下的对比产气实验,发现光照强度为2 000 lux下LED光源效果最佳。不同的进料流速下固定化光合细菌产气量不同,高流速不利于产气,最佳进料流速为4 mL/min。
(2)光合细菌在葡萄糖浓度为6 g/L时,细菌消耗的碳源、氮源均为最大,光合细菌生长繁殖最为活跃,固定化产生气体量最大为61 mL/(h·m2)。
(3)采用透光玻璃纤维作为光合细菌固定化载体,既能增大光能的吸收量,又提高了生化反应床层的比表面积,增加了光合细菌的生物量,同时可以扩大菌落与底物的接触面积,缩短传质距离,从而能增大底物和光能利用率,提高产氢效率。
