早期胃癌患者内镜黏膜下剥离术前后血清胃泌素-17、 糖类抗原-125 及胃蛋白酶原水平的变化和意义
2020-03-12董曲文陈晓丁纪元
董曲文,陈晓,丁纪元
[1.杭州市五云山疗养院(杭州市第一人民医院集团五云山院区) 医务科,浙江 杭州 310008;2.杭州市五云山疗养院(杭州市第一人民医院集团五云山院区) 检验科,浙江 杭州 310008;3.杭州市肿瘤医院 中医综合肿瘤科,浙江 杭州 310000]
由于现在人们生活习惯的改变,饮食不规律、生活压力过大等情况普遍存在,胃癌发病人数呈逐年增加趋势。2015年国家癌症中心相关数据显示[1],胃癌发病人数仅次于肺癌,居所有恶性肿瘤第二位。而随着诊断胃癌相关技术的不断提升,早期胃癌检出率较往年有所上升,而治疗方法主要采用内镜下黏膜切除术(endoscopic mucosal resection,EMR)及内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)[2],能取得与传统开腹手术相当的近远期疗效,避免传统手术带来的大范围创伤。在评估ESD 对早期胃癌患者近远期疗效方面,关于胃泌素-17(Gastrin-17,G-17)、 糖 类 抗 原-125(carbohydrate antigen 125,CA125)及胃蛋白酶原(pepsinogen,PG)水平的相关报道较少。笔者就此展开研究,选取该院68例早期胃癌患者,测定ESD 前后血清G-17、CA125 及PG水平,并与健康体检者比较,分析手术组与健康组G-17、CA125 及PG 水平的变化及其临床意义。现报道如下:
1 资料与方法
1.1 一般资料
选取2015年1月-2018年1月杭州市肿瘤医院接受ESD 治疗的68例早期胃癌患者作为研究对象,其中男35例,女33例;年龄25 ~70岁,平均(35.4±6.2)岁;肿瘤直径(1.64±0.24)cm。同期选取40例体检健康者为健康组,其中男22例,女18例;年龄26 ~72岁,平均(36.2±6.5)岁。两组受试者年龄和性别比较,差异无统计学意义(P >0.05),具有可比性。
纳入标准[3]:①均经胃镜检查和病理学活检证实为早期胃癌,无溃疡糜烂及淋巴结转移,肿瘤直径≤30 mm,病灶浸润深度范围不超过黏膜下层;②所有患者及家属知情同意。排除标准:合并严重的凝血功能障碍、心肝肾功能不全,其他恶性肿瘤者。
1.2 方法
ESD 具体操作如下:①仪器为日本Olympus 公司提供的CIF Q260J 型胃镜,具备带附送水功能;日本Olympus 公司提供的前端软式透明帽;德国ERBE 的高频电设备;甘油果糖加适量美兰为黏膜下注射液,按1 ∶100 000 的比例配肾上腺素;②内镜引导下确定病变位置,采用靛胭脂染色或内镜窄带成像(narrow Band Imaging,NBI)放大观察并确定病变与正常黏膜的交界;于病变周边0.5cm 处采用电凝方法标记病变,间隔2.0 ~3.0 mm 为一个标记点;③在标记点附近对病变黏膜注射甘油果糖肾上腺素盐水混合液,观察黏膜注射后病变抬举征,当病变部位基底部明显隆起,同时高度超过周围正常黏膜平面0.5 ~0.8cm 时才可继续进行手术;④采用HOOK 刀或IT 刀沿术中标记点外侧缘约0.2 ~0.3cm 切开病变黏膜;⑤更换切开刀后自切开边缘剥离病变黏膜,剥离过程中注意间断性注射以维持隆起状态,同时使尚未切除的病灶隆起,在切除过程中采用氩离子刀进行止血,同时应该要预防迟发性出血和穿孔,可喷洒硫糖铝胶剂及凝血酶进行创面保护;⑥将剥离后的标本进行送检。
1.3 病理学检查
对采集后的标本进行平铺固定,同时测量大小,采用浓度为10%的福尔马林(甲醛溶液)进行浸泡固定后送检。检查时自患者口侧端向肛侧段进行宽度为2 mm 的连续切割后采用石蜡油包埋,每条组织切片3 张进行HE 染色。读片时从口侧端开始进行连续读片,明确病变分化程度、性质、脉管是否浸润、基底是否暴露病变组织。镜下检查所见标本边缘基底未暴露病变组织,癌变深度未超过黏膜肌层500μm以下,无脉管浸润,则判定为(R0)。边缘基底可见癌变组织,浸润深度超过黏膜肌层500μm 以下,伴有淋巴管或脉管浸润,则判定为(R1)。若标本边缘基底面无法判断是否残留或发生凝固损伤,则判定 为(Rx)。
1.4 标本采集
术前所有受试者,术后30 及90 d 手术组患者空腹抽取5 ml 外周静脉血,3 000 r/min,离心15 min 以分离血清,进行血常规检测。采用电化学发光法检测受试者血清G-17、CA125 水平,试剂盒购自厦门市波生生物技术有限公司。采用乳胶增强免疫比浊法检测患者血清PG 水平,仪器为全自动生化分析仪(日立7180),试剂由北京利德曼生化股份有限公司提供。
1.5 随访及补充治疗
对边缘暴露的病例进行手术录像回顾,仔细观察病灶部位切除范围,必要时采用ESD 进行补充治疗,对脉管浸润、基底暴露病变组织的患者采取外科手术治疗并联合放疗及化疗。对患者进行随访,时间为术后1、3、6 和12 个月,12 个月后每年进行 随访。
1.6 统计学方法
采用SPSS 21.0 统计学软件进行分析,计量资料以均数±标准差(±s)表示,行t 检验,P <0.05 为差异有统计学意义。
2 结果
2.1 手术组病理检查结果及临床特点
68例早期胃癌患者平均肿瘤直径为(1.64± 0.24)cm,病灶位置:上段胃29例,占42.65%;中段胃19例,占27.94%;下段胃20例,占29.41%。镜下分型:Ⅰ型11例,占16.18%;Ⅱa型16例,占23.53%;Ⅱb型12例,占17.65%;Ⅱc型8例,占11.76%;Ⅱa+Ⅱc型9例,占13.23%;Ⅱc+Ⅱa型12例,占17.65%。
2.2 两组手术前血清G-17、CA125 及PG 水平的比较
手术组手术前血清PG Ⅰ水平及胃蛋白酶原比值(PG Ⅰ/PG Ⅱ,PGR)明显低于健康组,血清PG Ⅱ、G-17 及CA125 水平明显高于健康组,差异均有统计学意义(P <0.05)。见表1。
2.3 早期胃癌患者不同时点血清G-17、CA125 及PG 水平的变化
术后30 和90 d 早期胃癌患者血清PG Ⅰ水平及PGR 水平高于术前,术后90 d 患者PGR 水平高于术后30 d,差异均有统计学意义(P <0.05);术后90 d PG Ⅱ水平低于术前;术后30 和90 d 患者血清G-17、CA125 水平低于术前;术后90 d 患者血清G-17、CA125 水平低于术后30 d,差异均有统计学意义(P <0.05)。见表2。
2.4 复发组与未复发组血清G-17、CA125 及PG水平的比较
术后随访1年,定期复查CT、胃镜等,评价早期胃癌患者肿瘤是否转移复发,经胃镜及病理结果确认,8例患者复发转移(复发组),60例患者未复发转移(未复发组),复发组患者血清PG Ⅰ水平及PGR 值明显低于未复发组,血清PG Ⅱ、G-17、CA125 水平明显高于未复发组,差异均有统计学意义(P <0.05)。见表3。
表1 两组患者术前血清G-17、CA125 和PG 水平比较 (±s)Table 1 Comparison of serum G-17, CA125 and PG levels between the two groups (±s)
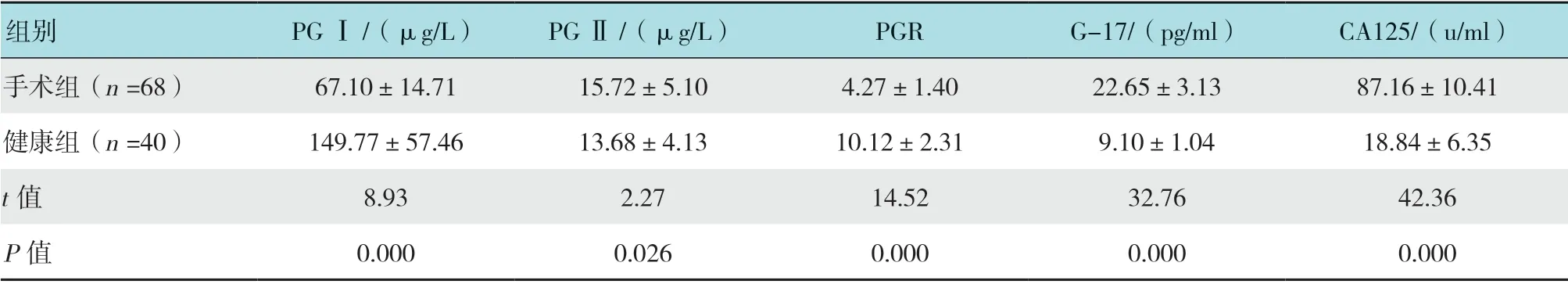
表1 两组患者术前血清G-17、CA125 和PG 水平比较 (±s)Table 1 Comparison of serum G-17, CA125 and PG levels between the two groups (±s)
?
表2 早期胃癌患者血清G-17、CA125 及PG 水平变化 (±s)Table 2 Changes of serum G-17, CA125 and PG levels in patients with early gastric cancer (±s)

表2 早期胃癌患者血清G-17、CA125 及PG 水平变化 (±s)Table 2 Changes of serum G-17, CA125 and PG levels in patients with early gastric cancer (±s)
注:t1/P1 值为术前和术后30 d 比较的统计值;t2/P2 值为术前和术后90 d 比较的统计值;t3/P3 值术后30 和90 d 比较的统计值
?
表3 复发组与未复发组血清G-17、CA 125 及PG 水平比较 (±s)Table 3 Comparison of serum G-17, CA 125 and PG levels between recurrent group and non-recurrent group (±s)
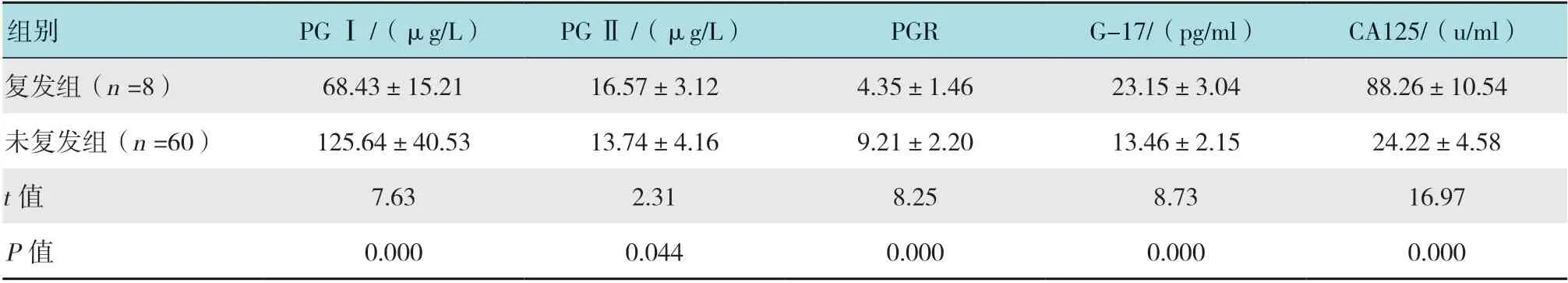
表3 复发组与未复发组血清G-17、CA 125 及PG 水平比较 (±s)Table 3 Comparison of serum G-17, CA 125 and PG levels between recurrent group and non-recurrent group (±s)
?
3 讨论
早期胃癌是病灶范围仅局限于黏膜下层或黏膜层且伴或不伴有淋巴结转移的一种恶性胃部肿瘤[4],现在早期胃癌诊断率虽有所提高,但我国的早期胃癌检出率仍在10%左右[5],多数早期胃癌患者均能得到有效治疗,获得良好预后。PG 是诊断早期胃癌常用指标之一,具有无创、简便和价格低廉等优点。PG是胃蛋白酶前体,其主要类型包括PG Ⅰ及PG Ⅱ。有研究[6]显示,PG Ⅰ主要由胃底腺的黏液颈细胞及主细胞分泌,PG Ⅱ由全胃黏膜层腺体分泌,其中包括贲门、幽门、胃底腺及Brunner 腺,在健康人群中PG 仅有少部分(约1%)可通过胃黏膜毛细血管进入机体血液循环[7],在胃黏膜发生癌变时,导致产生PG 的细胞相关功能受累,引起血清PG 水平发生变化。国外相关研究[8]显示,PG 及Ⅰ型胃蛋白酶原/胃型胃蛋白酶原比值(PG 蛋白酶原比,PGR)是诊断早期胃癌患者的敏感指标之一。本研究中,手术组手术前PG Ⅰ及PGR 水平均明显低于健康组,而PG Ⅱ水平明显高于健康组。KIKUCHI 等[9]研究指出,在早期胃癌患者中,PG Ⅱ水平低于健康人群,此外杨建华等[10]比较了早期胃癌患者与萎缩性胃炎及非萎缩性胃炎患者的PG Ⅰ与PG Ⅱ水平后发现,早期胃癌患者PG Ⅰ及PG Ⅱ水平低于萎缩性胃炎及非萎缩性胃炎患患者。以上结果提示,在早期胃癌患者机体中,由于致癌因子作用下导致胃底腺黏液颈细胞及主细胞的PG 相关基因受损,影响分泌PG Ⅰ及PG Ⅱ的功能,此外PG Ⅱ能够被胃内多种腺体所分泌。本研究由于受样本量所限,可能导致PG Ⅱ水平结果有所误差,此外由于肿瘤细胞引起的胃壁功能破坏也可引起PG Ⅱ进入外周血,故本研究中胃癌患者的PG Ⅱ水平高于健康组。
G-17 和CA125 是近年来筛查早期肿瘤的敏感标志物。有研究[11-12]显示,G-17 及CA125 可判断肿瘤恶性程度及患者预后效果。何伟等[13]研究指出,早期胃癌患者血清CA125 及G-17 可出现明显高水平表达,同时也能够体现患者肿瘤负荷状态。G-17 是消化道G 细胞分泌的激素之一。国外研究[14]显示,G-17 水平升高能够促进癌细胞增殖及转移侵袭,在消化道肿瘤的良恶性及预后判断方面具有重要意义。而CA125是对多种类型肿瘤具有诊断价值的指标之一。本研究显示,手术组术前血清G-17 及CA125 水平均明显高于健康组,与文献[15]报道结果一致。本研究采用ESD治疗早期胃癌患者,较于传统手术方法不仅减小了创伤及出血量,还放大了手术视野,实现对病灶的精准切除。本研究显示,在ESD 后30 和90 d,早期胃癌患者血清PG Ⅰ水平及PGR 值明显上升,血清G-17、CA125 明显下降,差异均有统计学意义(P <0.05)。说明在病灶切除后,不仅恢复了患者胃底腺主细胞及黏液颈细胞的功能,使PG Ⅰ分泌水平得到提高,此外降低了G-17 及CA125 水平。术后90 d,早期胃癌患者PG Ⅱ水平明显低于术前,笔者考虑,术前早期胃癌患者PG Ⅱ水平过高,是癌细胞引起胃壁功能发生一定程度破坏使PG Ⅱ进入外周血引起的,而术后患者胃壁功能恢复,故PG Ⅱ水平明显低于术前,但术后30 d 内胃壁功能可能尚未完全恢复或存在个体差异,导致本研究中术后30 d 水平与术前比较差异无统计学意义。本研究通过1年的随访,根据随访结果按照是否复发将手术后早期胃癌患者分为复发组及未复发组,进一步分析发现,复发组患者血清PG Ⅰ水平及PGR明显低于未复发组,血清PG Ⅱ、G-17 和CA125 水平均明显高于未复发组,说明随着患者疾病复发,肿瘤细胞入侵胃底腺黏液颈细胞及主细胞,同时引起胃壁功能产生损害,导致复发患者PG Ⅰ、PGR 及PG Ⅱ水平与未复发患者有差异,同时引起G-17 及CA125肿瘤标志物水平的改变。目前,关于早期胃癌ESD 术后是否复发与血清PG、G-17、CA125 水平有关的报道较少,缺乏足够文献加以证实,本文中关于随访的结果还有待大样本、多中心研究进行。综上所述,血清PG Ⅰ、PGR、G-17 及CA125水平可作为早期胃癌人群的筛查指标,早期胃癌ESD术后血清PG、PGR、G-17 及CA125 水平的数值随访可发挥预防和监测胃癌是否复发的作用,且术后血清PG、PGR、G-17 及CA125 水平可间接评价ESD治疗早期胃癌的有效性。但由于样本量所限,关于复发患者上述指标的改变还有待开展更大样本的多中心研究。
