气相色谱-串联质谱法高通量检测食用油中3 类污染物
2020-03-11孟维一赵文涛马燕红赵奕昕李莹莹郭文萍
孟维一,古 瑾,姜 锐,张 晴,赵文涛,马燕红,*,赵奕昕,李莹莹,郭文萍
(1.中国肉类食品综合研究中心,北京 100068;2.北京工业大学生命科学与生物工程学院,北京 100020)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)、多氯联苯(polychlorinated biphenyls,PCBs)和塑化剂(phthalic acid esters,PAEs)都是具有亲脂性且易远距离迁移的持久性有机污染物,均具有一定的致癌、致畸和致突变作用,是环境和食品较为关注的污染物[1-3],世界各国也对这些化合物制定了严格的限量要求[4-7]。PAHs、PCBs在环境中广泛存在,能通过生物转化等多种途径进入食物链,油脂在加工过程中的高温反应也是PAHs的主要来源;PAEs广泛应用于塑料生产加工中,塑料桶装的食用植物油易通过接触迁移受到PAEs污染。这3 类化合物含量水平已成为评价食用油质量安全的重要指标[8],因此,建立一种高通量快速分析测定市售食用油中3 类污染物含量的方法尤为重要。

图1 目标化合物的结构式Fig. 1 Structure of the target compounds
目前,国内外对食用油中污染物的研究虽已较多,但都是单独分析其中一类,鲜见有同时检测这3 类污染物的报道。这3 类污染物的检测方法有气相色谱-质谱法[9-16]、高效液相色谱法[17-20]、液相色谱-串联质谱法[21-24]等,其中,最常用的是气相色谱-质谱法。但由于食用油成分复杂,很多文献报道的检测方法存在基质干扰大,导致检出限高、灵敏度低和选择性相对差等缺点。因此,建立选择性更强、更灵敏、检出限更低的痕量污染物检测方法尤为重要。在质谱检测领域里,串联质谱是最灵敏和定量重现性最高的仪器,它的优势在于能够提供足够的化合物结构信息用于定性分析,准确可靠,由于在母离子碰撞前,样本中共流出物产生的干扰离子已被排除,特征母离子和子离子的一一对应性使排除干扰能力强。同时,定量时本底值低,检测灵敏度高,特别适用于分析背景干扰严重、定性困难、被测化合物含量很低的样品,是对复杂基质样品中痕量化合物进行定性、定量分析最有效的手段[25]。
在结构上,PAHs、PCBs和PAEs这3 类物质母体均为苯环,有类似结构(图1),本实验旨在建立一种同时检测这3 类污染物的高通量方法。采用超声辅助和固相萃取(solid phase extraction,SPE)柱对样品提取和净化,建立气相色谱-三重四极杆串联质谱法高通量同时测定食用油中的18 种邻苯二甲酸酯类PAEs、16 种PAHs和7 种PCBs的检测方法,为3 类污染物的检测和食用油加工过程质量控制提供参考。
1 材料与方法
1.1 材料与试剂
市购食用油包括玉米油、大豆油和芝麻油,其中大豆油包括两个品牌,所有的样品均在阴凉、避光处储存。
乙腈、正己烷、甲醇、二氯甲烷、丙酮(均为色谱纯) 美国J.T.Beaker公司;萘(naphthalene,N a P)、苊烯(a c e n a p h t h y l e n e,A c y)、苊(acenaphthene,Ace)、芴(fluorene,Flu)、菲(phenanthrene,Phe)、蒽(anthracene,Ant)、荧蒽(fluoranthene,Fla)、芘(pyrene,Pyr)、苯并[a]蒽(benzo[a]anthracene,BaA)、屈(chrysene,CHR)、苯并[b]荧蒽(benzo[b]fluoranthene,BbF)、苯并[k]荧蒽(benzo[k]fluoranthene,BkF)、苯并[a]芘(benzo[a]pyrene,BaP)、茚并[1,2,3-cd]芘(indeno[1,2,3-c,d]pyrene,IcdP)、二苯并[a,h]蒽(dibenz[a,h]anthrancene,DBahA)、苯并[ghi]苝(benzo[g,h,i]perylene,BghiP)、2,4,4’-三氯联苯(2,4,4’-trichlorobiphenyl,PCB28)、2,2’,5,5’-四氯联苯(2,2’,5,5’-tetrachlorobiphenyl,PCB52)、2,2’,4,5,5’-五氯联苯(2,2’,4,5,5’-pentachlorobiphenyl,PCB101)、2,3’,4,4’,5-五氯联苯(2,3,4,4’,5-pentachlorobiphenyl,PCB118)、2,2’,3,4,4’,5-六氯联苯(2,2’,3,4,4’,5-he xachlorobiphenyl,PCB138)、2,2’,4,4’,5,5’-六氯联苯(2,2’,4,4’,5,5’-hexachlorobiphenyl,PCB153)、2,2’,3,4,4’,5,5’-七氯联苯(2,2’,3,4,4’,5,5’-heptachloro biphenyl,PCB180) 上海安谱公司;邻苯二甲酸二甲酯(dimethyl phthalate,DMP)、邻苯二甲酸二乙酯(diethyl phthalate,DEP)、邻苯二甲酸二烯丙酯(diallyl phthalate,DAP)、邻苯二甲酸二异丁酯(diisobutyl phthalate,DIBP)、邻苯二甲酸二正丁酯(di-n-butyl phthalate,DBP)、邻苯二甲酸二(2-甲氧基)乙酯(bis(2-methoxyethyl) phthalate,DMEP)、邻苯二甲酸二(4-甲基-2-戊基)酯(bis(4-methyl-2-pentyl)phthalate,BMPP)、邻苯二甲酸二(2-乙氧基)乙酯(bis(2-ethoxyethyl) phthalate,DEEP)、邻苯二甲酸二戊酯(di-n-pentyl phthalate,DPP)、邻苯二甲酸二己酯(di-n-hexyl phthalate,DHXP)、邻苯二甲酸丁基苄基酯(butyl benzyl phthalate,BBP)、邻苯二甲酸二(2-丁氧基)乙酯(bis(2-butoxyethyl) phthalate,DBEP)、邻苯二甲酸二环己酯(dicyclohexyl phthalate,DCHP)、邻苯二甲酸二(2-乙基)己酯(bis(2-ethylhexyl) phthalate,DEHP)、邻苯二甲酸二苯酯(diphenyl phthalate,DPhP)、邻苯二甲酸二正辛酯(di-n-octyl phthalate,DNOP)、邻苯二甲酸二异壬酯(diisononyl phthalate,DINP)、邻苯二甲酸二壬酯(dinonyl phthalate,DNP)德国Dr. Ehrenstorfer公司。
1.2 仪器与设备
TRACE1300/TSQ8000EVO气相色谱-三重四极杆串联质谱 美国Thermo公司;KQ-700DV数控超声波清洗器 昆山市超声仪器有限公司;HGC-36A氮吹仪天津市恒奥科技发展有限公司。
1.3 方法
1.3.1 标准溶液配制
标准储备液:准确称取18 种邻苯二甲酸酯类化合物的标准品各10 mg(精确到0.000 1 g)于10 mL容量瓶中,用正己烷溶解并稀释至刻度,配制成质量浓度为1.00 mg/mL的标准贮备液;准确称取16 种PAHs类化合物的标准品各10 mg(精确到0.000 1 g)于10 mL容量瓶中,用乙腈溶解并稀释至刻度,配制成质量浓度为1.00 mg/mL的标准贮备液;准确称取7 种PCBs类化合物的标准品各10 mg(精确到0.000 1 g)于10 mL容量瓶中,用甲醇溶解并稀释至刻度,配制成质量浓度为1.00 mg/mL的标准贮备液;以上41 种标准储备液均于-18 ℃保存。
分别吸取各标准储备液适量,用丙酮配制成混合标准溶液。
标准工作液:将上述混合标准溶液用丙酮逐级稀释为标准工作溶液,临用现配。
1.3.2 仪器分析条件
1.3.2.1 色谱条件
色谱柱:DB-5石英毛细柱(30 mh0.25 mm,0.25 µm);升温程序:50 ℃保持1 min,以25 ℃/min升至200 ℃,以8 ℃/min升温到290 ℃,保持2 min;载气(He)流速1.0 mL/min,进样量1.0 µL;不分流。
1.3.2.2 质谱条件
电子电离源;电子能量70 eV;传输线温度280 ℃;离子源温度280 ℃;质谱扫描方式:选择反应监测(selective reaction monitor,SRM)模式。
1.3.3 样品前处理
1.3.3.1 提取
称取0.5 g油样于玻璃离心管中,准确加入2 mL正己烷饱和乙腈萃取剂,涡旋1 min,超声提取15 min,以5 000 r/min离心3 min,收集上清液;再加入2 mL正己烷饱和乙腈萃取剂,涡旋1 min,以5 000 r/min离心3 min,重复提取2 次,合并3 次上清液,待净化。
1.3.3.2 净化
分别用5 mL二氯甲烷、5 mL乙腈活化SPE柱,将收集好的待净化液上样,接收管进行收集,等待净化液全部流入接收管后加入5 mL乙腈进行洗脱,该部分液体也收集。收集完全后在接收管中加入1 mL丙酮,在氮吹浓缩仪上以40 ℃的温度氮吹至干,用正己烷准确定容至1.0 mL,待气相色谱-串联质谱分析。
1.4 数据分析
采用SPSS 16.0统计软件进行数据统计分析,采用单因素方差分析,实验数据以fs表示,P<0.05,差异显著。
2 结果与分析
2.1 前处理条件的优化
2.1.1 提取溶剂的选择
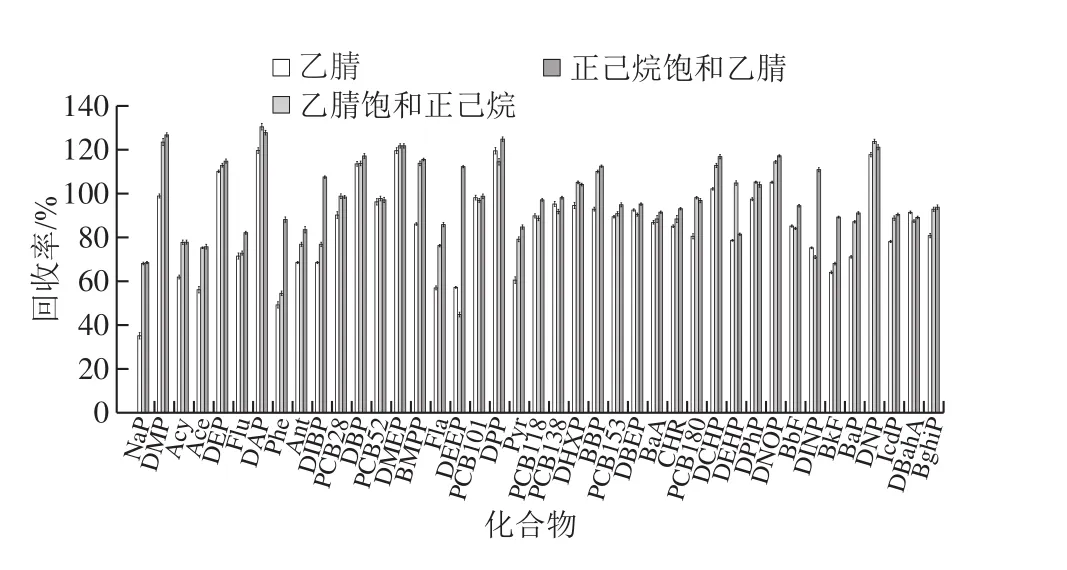
图2 萃取溶剂对回收率的影响Fig. 2 Effect of solvents on recovery of analytes
PAHs、PCBs和PAEs均为脂溶性化合物,由于食用油的基质比较复杂,干扰物质(如:甾醇、脂肪酸等大分子物质)较多,为尽可能的降低基质的干扰、同时尽可能地减少共萃物的出现,实验对比了2 mL乙腈、2 mL乙腈饱和正己烷、2 mL正己烷饱和乙腈对萃取效果的影响,平行3 次实验。由图2可知,在只用乙腈作萃取溶剂时,一些PAHs和少部分PAEs的回收率都低于60%,萘的回收率最低,只有35%,这是因为在油脂的基质中,干扰物质有很多,只用乙腈提取时油脂与乙腈不相溶,油脂并没有完全溶解,不能很好地将邻苯二甲酸酯和PAHs完全提取出来。当用乙腈饱和正己烷作萃取溶剂进行提取时,绝大部分组分的回收率均提高。当用正己烷饱和乙腈作萃取溶剂时,各组分的回收率基本均达到最高。有文献报道,使用正己烷饱和乙腈作萃取剂,可有效去除脂肪[26]。这是因为乙腈是极性溶剂而正己烷是非极性溶剂,正己烷可以溶解油脂,使得乙腈可以更充分地与油脂接触,食用油中的待测组分得到充分提取,同时能较好的降低基质的干扰。因此,最终选取2 mL正己烷饱和乙腈作为萃取溶剂。
2.1.2 超声辅助萃取时间的优化
在称样量0.5 g、加入2 mL正己烷饱和乙腈萃取剂、涡旋1 min的条件下,考察10、15、20 min 3 个超声萃取时间的影响,平行3 次实验。由图3可知,超声时间为10 min时一些物质的回收率较低。超声时间为15 min和20 min时,各组分的回收率差别不大。因此,为减少耗时,最终选择超声辅助萃取时间为15 min。
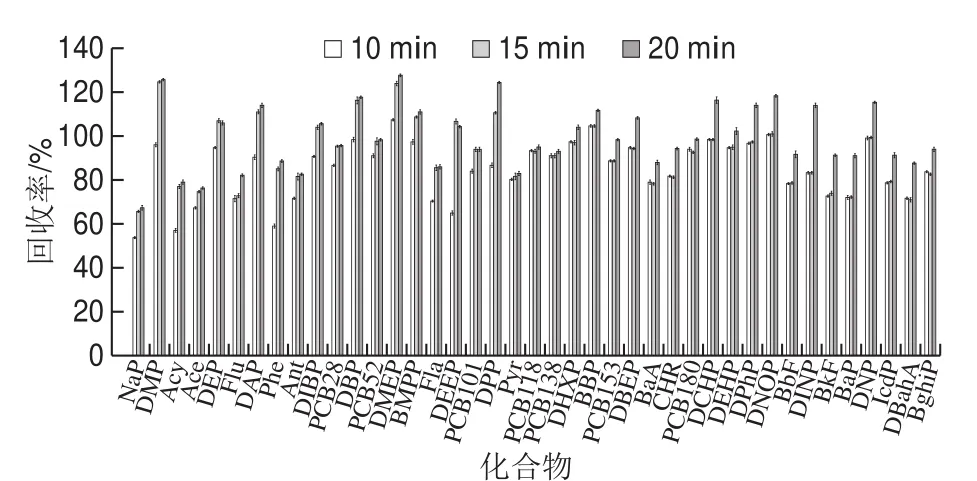
图3 萃取时间对回收率的影响Fig. 3 Effect of extraction time on recovery of analytes
2.1.3 净化方法的优化

图4 净化方法对回收率的影响Fig. 4 Effect of purification methods on recovery of analytes
在相同的提取条件下,实验对比了超低温冷冻除脂法[8,27]、QuEChERS(quick, easy, cheap, effective, rugged,safe)法[28-32]和SPE法[33-34]净化,平行3 次实验。超低温冷冻除脂法是样品溶液经提取后,将得到的待净化液放于超低温冰箱中,转移至玻璃离心管中以4 000 r/min离心5 min,取上清液待测。QuEChERS法是样品溶液经提取后,取1 mL待净化液于玻璃离心管中,再加入50 mg的C18和50 mg的丙基乙二胺(primary secondary amine,PSA)粉末[35],涡旋1 min,以4 000 r/min离心5 min,取上清液待测。由图4可知,超低温冷冻除脂虽然操作简单,试剂用量小,也可有效地除脂,但并不能除去基质中的杂质和大分子物质,被测物质的回收率普遍偏低。QuEChERS法的净化效果和SPE柱净化效果相当,但其空白对照组检测出更多的PAHs和邻苯二甲酸酯,影响测定的准确性。SPE柱净化法净化效果好、回收率高。因此,最终选择SPE柱净化为前处理的净化方法。
2.2 气相色谱-串联质谱条件优化
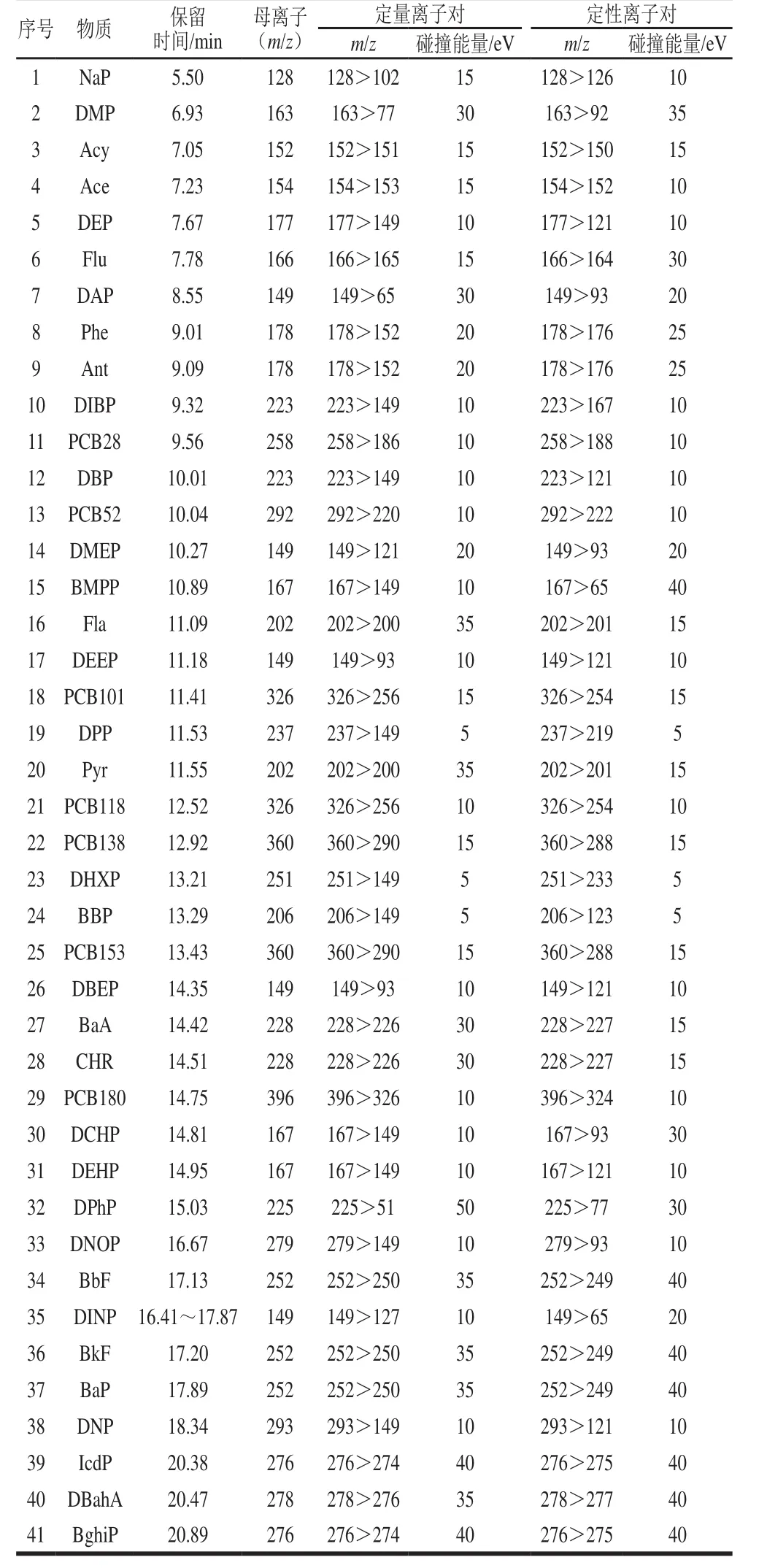
表1 41 种化合物的SRM参数Table 1 SRM parameters for 41 compounds
本研究将国标中给出的选择离子作为所要检测的41 种化合物的母离子,碰撞能量在5~50 eV的范围内,以每5 eV的大小进行递增的方式进行自动优化。最终确定了SRM模式扫描条件如表1所示,并且得到SRM模式下的色谱图,如图5所示。
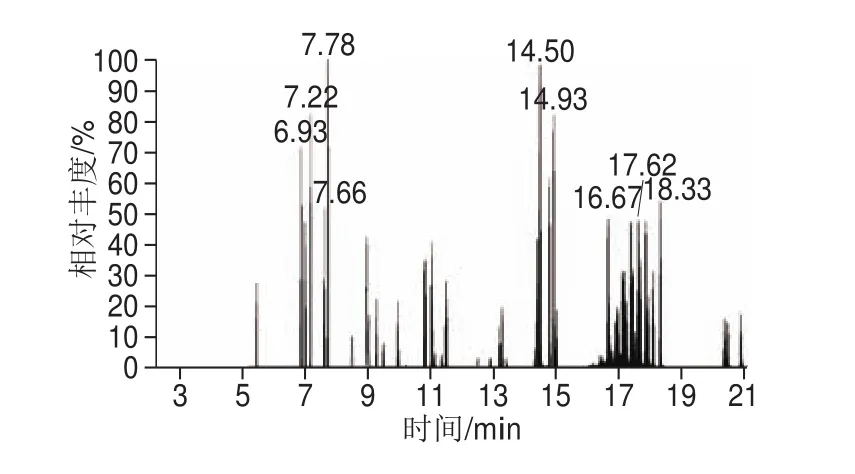
图5 SRM扫描色谱图Fig. 5 SRM chromatograms
2.3 线性范围和检出限
以峰面积对相应物质的质量浓度进行线性回归,以3 倍信噪比确定各目标化合物的方法检出限,其线性范围、线性方程、相关系数及方法检出限见表2。检出限均不大于2 μg/kg(除DINP外)。
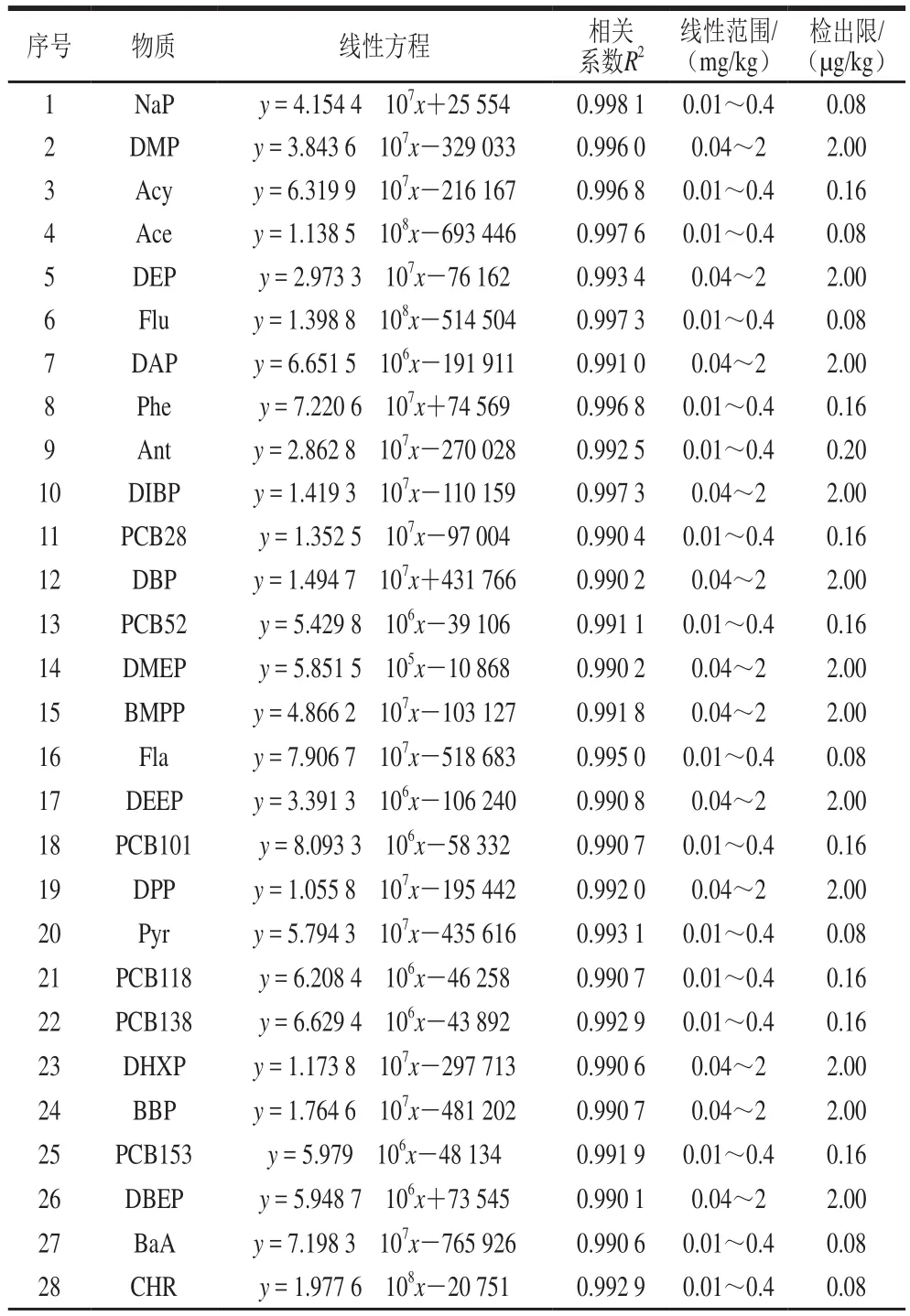
表2 41 种化合物的线性范围和检出限Table 2 Linear ranges and detection limits of 41 compounds
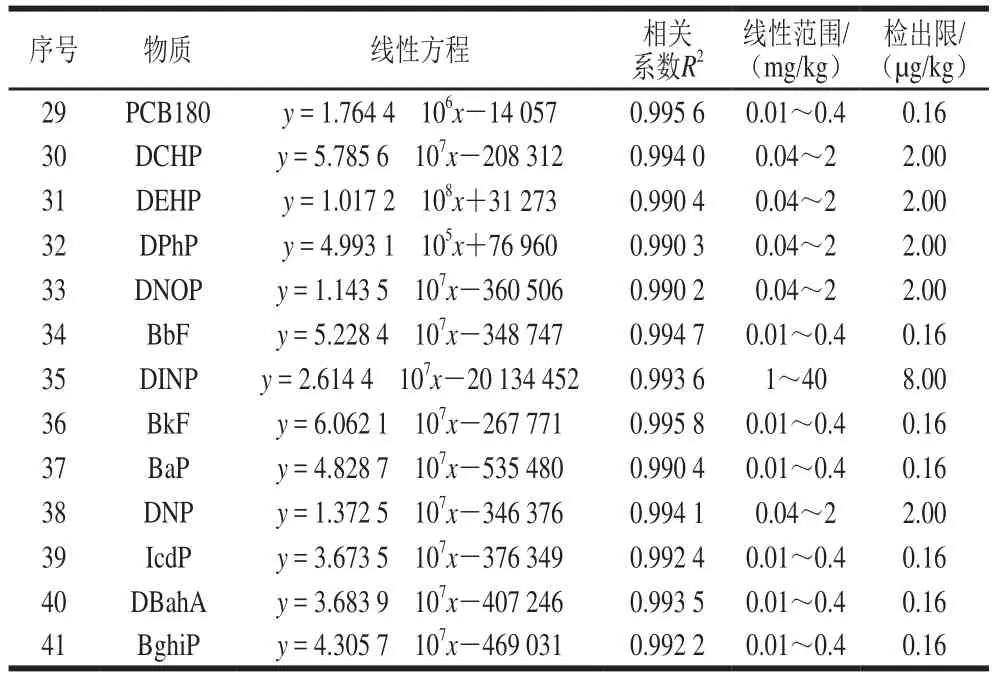
续表2
2.4 方法精密度和回收率
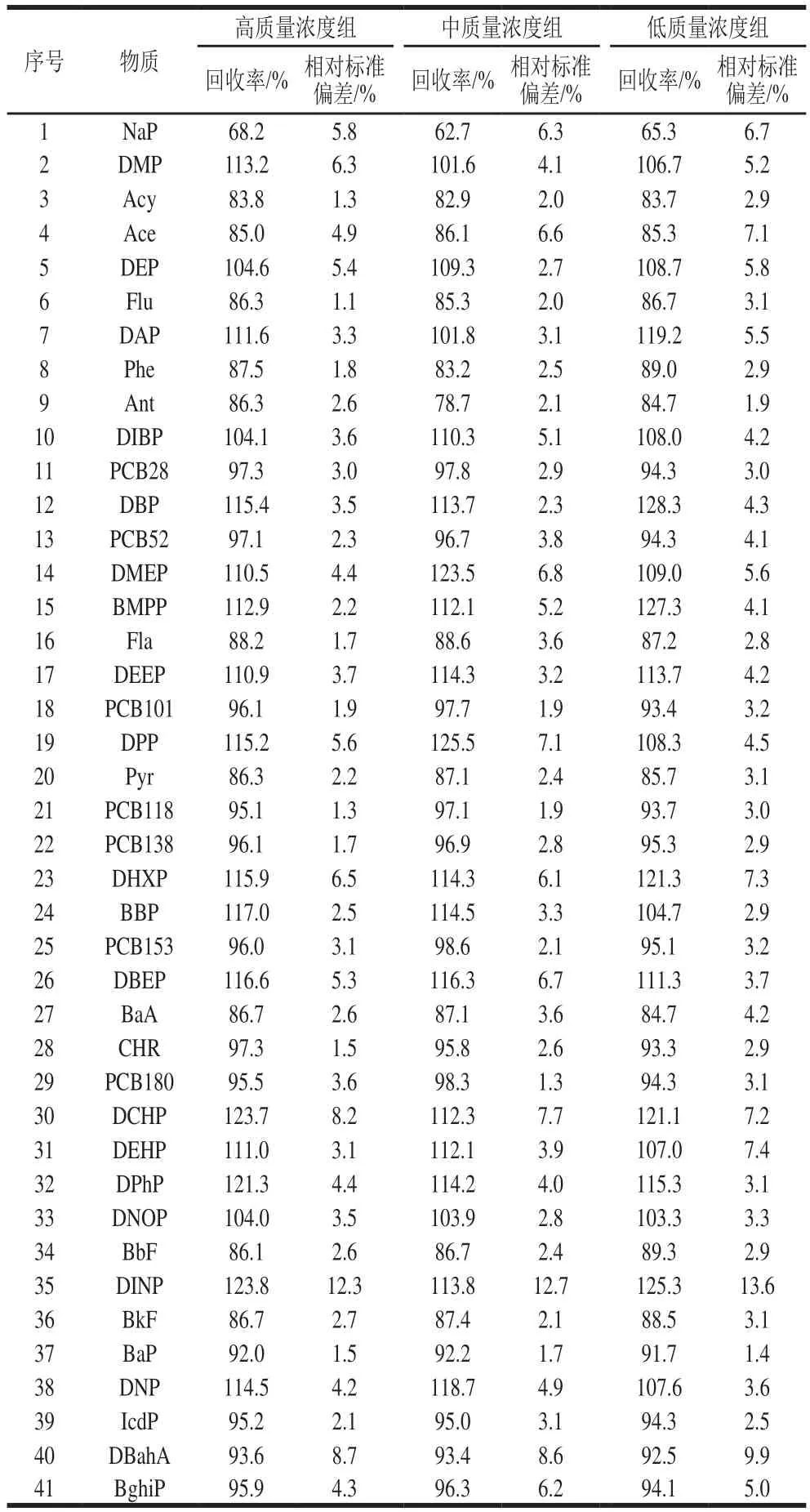
表3 方法回收率和精密度(n=6)Table 3 Recoveries and precision of the method (n= 6)
以大豆油作为空白样品基质,得到低、中、高3 个加标水平的样品,由于邻苯二甲酸酯与PAHs、PCBs的响应值相差较大,因此邻苯二甲酸酯类物质的加标量高、中、低质量浓度为0.1、0.5、1 mg/kg;PAHs与PCBs的加标量高、中、低质量浓度为2、10、20 μg/kg。经提取净化后进行添加回收实验,平行测定6 次,测定结果如表3所示。
由表3可知,41 种化合物的高质量浓度水平回收率在68.2%~123.8%之间,相对标准偏差为1.1%~12.3%;中质量浓度水平回收率在62.7%~125.5%之间,相对标准偏差为1.3%~12.7%;低质量浓度水平回收率在65.3%~128.3%之间,相对标准偏差为1.4%~13.6%。
2.5 实际样品分析结果
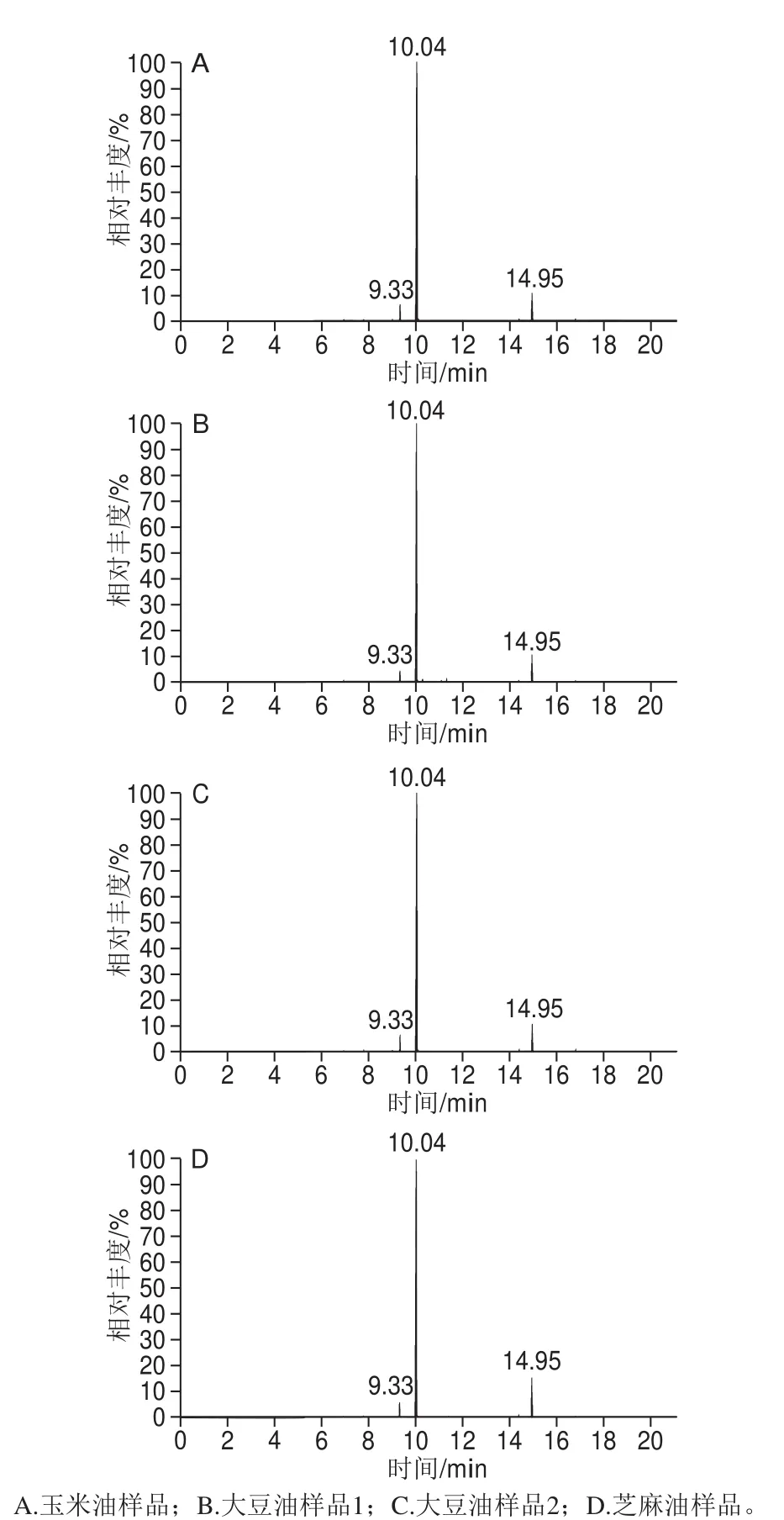
图6 样品色谱图Fig. 6 Chromatograms of real samples
应用所建立的方法对超市里随机抽取的玉米油、大豆油和芝麻油进行检测分析,如图6所示。结果表明,被测油样中邻苯二甲酸酯、PAHs和PCBs这3 类物质均未检出或未超标。
3 结 论
以气相色谱-三重四极杆串联质谱同时测定食用油中的18 种邻苯二甲酸酯、16 种PAHs和7 种PCBs,通过对萃取溶剂、超声时间和净化方法的优化,使得食用油样品仅需一次提取和净化,即可采用气相色谱-串联质谱对41 种化合物进行同时测定。在优化实验条件下,方法灵敏度较高,目标化合物的回收率高,方法的精密度和准确性良好,能够满足实际应用的需要。所建立的方法可以满足食用油中3 类污染物同时测定的分析要求。该方法有效、快速,大大节省了检测成本和检测时间,可为食用油的质量安全监管提供便利。
