沉积固化离子液体均相液液微萃取-高效液相色谱法测定蔬菜中的苯脲类农药残留
2020-03-11徐尉力王晨兆马佳骏王志兵
徐尉力,付 壮,王 旭,赵 悦,王晨兆,马佳骏,王志兵*
(长春工业大学化学与生命科学学院,吉林 长春 130012)
苯脲类除草剂是一类核心结构为脲的化学性除草剂,广泛应用于宽叶杂草和一年生杂草的控制,其作用机理为抑制光合作用中的希尔反应从而抑制叶绿体的活性[1-4],但其在自然环境中降解周期较长,易残存于环境水、土壤和蔬菜、水果中,从而被动植物吸收,继而影响人体健康[3,5-10]。已有文献报道灭草隆和利谷隆对人体有潜在的致癌可能,而其他苯脲除草剂也大多具有生态毒性或遗传毒性[11]。因而,建立一种食品中苯脲类除草剂残留的检测方法显得尤为重要。
食品中农药残留常见的样品前处理方法有基质固相分散法[2,12-13]、固相微萃取法[3,9,13]、固相萃取法[5,10,14-15]和液液萃取法[16-17]。离子液体均相液液微萃取在液液萃取的基础上发展而来,是样品制备和预浓缩的重要方法之一,其通过原位反应改变离子液体的水溶性实现溶剂与样品溶液的分离,具有操作简便、试剂用量少、萃取时间短等优点,但在相分离时由于离子液体具有较大的黏度,常造成一定的损失。
目前,苯脲类农残的检测方法主要有气相色谱法[10,18-19]、毛细管电泳法[2,15]、酶联免疫法[20]、高效液相色谱法和液相色谱-串联质谱法[21]。其中高效液相色谱法已被广泛用于苯脲类化合物的分析。但由于蔬菜中水溶性成分较多,基质干扰复杂,且农药残留水平较低。因此,选择一种合适的样品前处理方法至关重要。
沉积固化离子液体作为一种“绿色”溶剂,具有良好的热稳定性、溶解性以及相对较高的密度和较低的熔点[22-27]。通过控制温度,可以改变离子液体的存在状态,有效解决离子液体在室温下与水相分离困难的问题。
因此,本研究以沉积固化型离子液体为萃取剂,以温控超声为辅助手段,建立基于原位反应的均相液液微萃取-高效液相色谱法,用于蔬菜中苯脲类除草剂的分析检测。
1 材料与方法
1.1 材料与试剂
5 种蔬菜样品西红柿、马铃薯、甘蓝、胡萝卜、黄瓜(样品1~5),全部购买于当地农贸市场。
灭草隆、绿麦隆、异丙隆、敌草隆、绿谷隆标准品(纯度均大于99%,结构见图1) 中国阿拉丁试剂公司;三丁基辛基溴化膦([P4448]Br)由实验室自制;六氟磷酸铵(NH4PF6) 上海成捷化学有限公司;乙腈、甲醇(均为色谱纯) 成都市科隆化学品有限公司;其他试剂均为分析纯 北京化工厂。
图1 目标分析物的化学结构Fig. 1 Chemical structures of phenylurea pesticides
1.2 仪器与设备
1100型高效液相色谱仪(配有自动进样器、四元泵、柱温箱、脱气机和二极管阵列检测器) 美国Agilent公司;AcclaimTM120-C18色谱柱(4.6 mmh250 mm,5 μm) 美国Thermo Fisher Scientific公司;KQ-100DE超声波清洗器 江苏昆山市超声仪器有限公司;AG 5428型台式高速冷冻离心机 德国Eppendorf公司。
1.3 方法
1.3.1 标准溶液配制
分别准确称取5 mg苯脲标准品于10 mL容量瓶中,用乙腈定容,配制成质量浓度为500 μg/mL的标准储备液,于4 ℃冰箱中避光保存,备用。实验所用其他工作溶液均由各标准储备液经乙腈稀释得到。
1.3.2 [P4448]Br的制备
向500 mL三口烧瓶中准确加入50 g三丁基膦、200 mL甲苯和53 g溴辛烷,110 ℃保温24 h。反应完毕后,取下层,用50 mL无水乙醚洗涤,重复洗涤6 次,将得到的纯净溶液于真空干燥烘箱中真空干燥12 h,即得到[P4448]Br。
1.3.3 样品溶液制备
将一定量的新鲜蔬菜样品用水冲洗后沥干,切块后组织捣碎,准确称取2 g于离心管中,加入8 mL超纯水,涡旋2 min后7 000 r/min离心15 min,所得上清液即为样品溶液,除实际样品分析外,其余实验结果均由样品1(西红柿)获得。
1.3.4 沉积固化离子液体均相液液微萃取
将1.3.3节样品溶液和0.048 g [P4448]Br加入到10 mL离心管中,于40 ℃水浴中保温15 min,随后向离心管中加入0.24 g NaCl,待NaCl溶解后再加入135 μL 1.08 mol/L NH4PF6溶液(离子对试剂),此时离子液体与离子对试剂发生原位复分解反应产生白色的乳浊液。将离心管在120 W条件下超声提取5 min,于5 000 r/min离心5 min,则富集有目标分析物的离子液体沉积于离心管底部。经冰浴后,离子液体则完全沉积凝固,倒出上层清液,离子液体部分用300 μL乙腈溶解稀释,过0.22 μm滤膜,进行色谱分析。萃取流程见图2。

图2 沉积固化离子液体均相液液微萃取流程图Fig. 2 Schematic procedure of homogeneous liquid-liquid microextraction based on solidification of sedimentary ionic liquids
1.3.5 色谱条件
流动相由水(A)和乙腈(B)组成,洗脱梯度为0 min,45% B;0~3 min,45%~53% B;3~15 min,53% B;15~25 min,53%~45% B;25 min,45% B;27 min,45% B。流动相流速0.5 mL/min;进样体积20 μL;色谱柱温度30 ℃;检测波长245 nm。
1.3.6 萃取条件优化

表1 Box-Behnken试验因素与水平Table 1 Factors and levels used in Box-Behnken design
对影响萃取效率的各个因素进行优化,并在单因素试验基础上,采用Box-Behnken试验设计,对影响目标物萃取效率较为显著的离子液体用量、离子液体与NH4PF6物质的量比和超声功率进行优化,以苯脲类化合物色谱峰面积为响应值,通过Design-Expert 8.0.6软件设计3因素3水平Box-Behnken响应面试验,如表1所示。
2 结果与分析
2.1 单因素试验优化萃取条件
2.1.1 离子液体用量
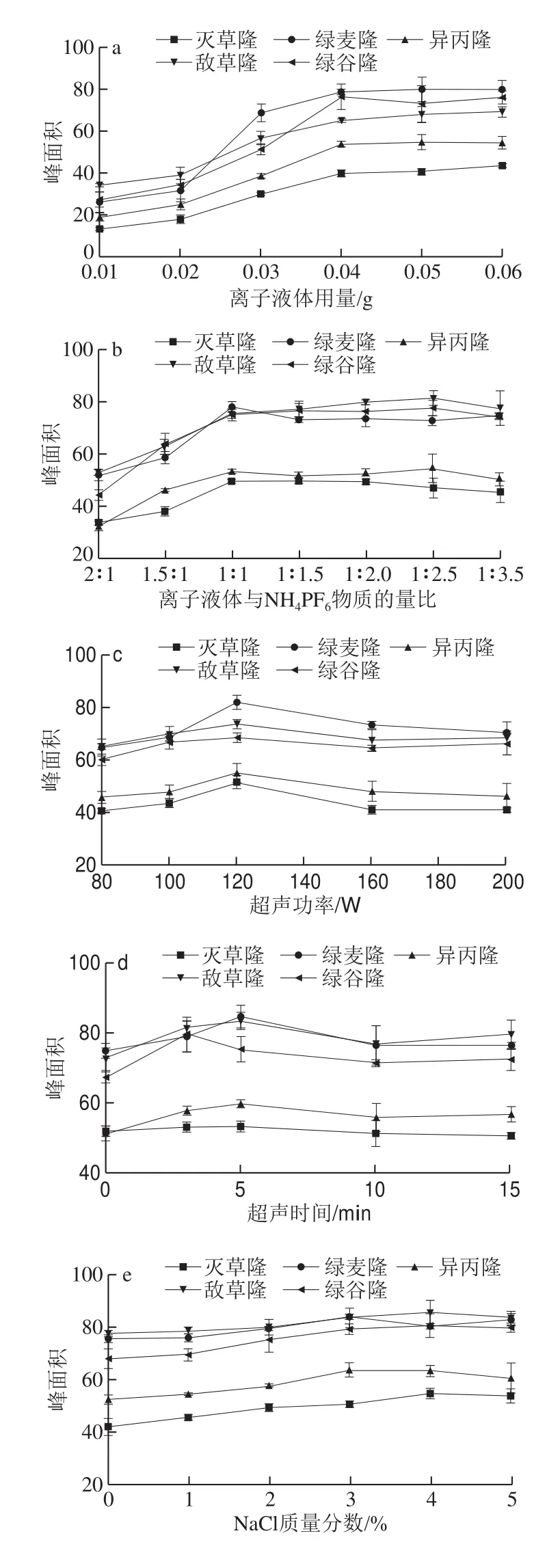
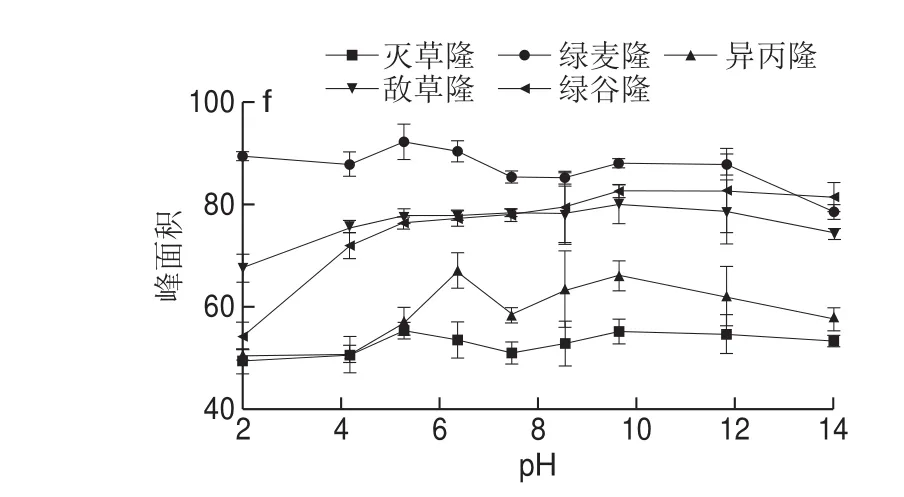
图3 离子液体用量(a)、离子液体与NH4PF6物质的量比(b)、超声功率(c)、超声时间(d)、离子强度(e)和萃取介质pH值(f)对苯脲峰面积的影响Fig. 3 Effects of amount of ionic liquid (a), molar ratio of IL to NH4PF6 (b), ultrasonic power (c), ultrasonic time (d), NaCl (e) and pH (f)on peak areas of phenylureas
[P4448]Br是一种在室温下呈固态的水溶性高密度离子液体,当温度升高时,[P4448]Br逐渐溶于水中与离子对试剂NH4PF6发生原位反应,生成疏水性离子液体[P4448]PF6,并与目标分析物通过疏水、π-π堆积、静电等相互作用结合在一起;当降低温度时,新形成的[P4448]PF6发生凝固现象,与水相发生分离。因此,作为一种绿色萃取溶剂,[P4448]Br的用量对目标化合物的萃取效率具有重要影响。如图3a所示,随着离子液体用量增加,峰面积逐渐升高,当离子液体用量达到0.04 g时,峰面积达到最大值并趋于稳定。当离子液体用量过高时,影响后期的溶解、提取过程,降低实验的重复性和稳定性。因此,本实验中选用0.04 g [P4448]Br作为萃取溶剂。
2.1.2 离子液体与NH4PF6物质的量比
[P4448]Br属于亲水性离子液体,在一定温度下可以与水混溶。当加入NH4PF6后,PF6-结合离子液体中的有机阳离子,发生原位复分解反应[P4448]Br+KPF6=[P4448]PF6+KBr,形成疏水性离子液体[P4448]PF6,富集目标分析物,并在低温下沉积凝固,与水相分离。因此,本研究考察离子液体与NH4PF6物质的量比对提取效率的影响。由图3b可以看出,随着NH4PF6物质的量的增加,峰面积逐渐增加,当物质的量比达到1∶1时,离子液体与NH4PF6反应完全,提取效果相对较好。所以,本实验选择离子液体与NH4PF6物质的量比为1∶1。
2.1.3 超声功率和超声时间
如图3c、d所示,在超声功率120 W、超声时间5 min时,峰面积达到最高值,但随着超声功率的增加和超声时间的延长,提取效率逐渐降低。结果表明,适当的超声处理有利于萃取效率的提高,因为超声有助于加速离子液体和目标分析物的分散,增加两者的接触频率。然而,过高的功率和时间却不利于提取过程,这可能是因为过度的超声处理使体系热能增加,一方面,使少量[P4448]PF6溶解于水中;另一方面,使离子液体与目标分析物的相互作用力减弱,从而使提取回收率降低。因此,本实验选择超声功率120 W、超声时间5 min。
2.1.4 离子强度
NaCl用于调节样品溶液的离子强度,考察样液中NaCl质量分数(0%~5%)对提取效率的影响,如图3e所示。结果表明,在NaCl质量分数为3%~4%时,目标化合物的提取效果最佳,但随着NaCl质量分数的增加,离子强度增强,黏度增大,盐析现象加重,离子液体存在粘壁现象,不利于乙腈溶解稀释。综合考虑,本实验选择样液中NaCl的质量分数为3%。
2.1.5 溶液介质pH值
溶液介质超纯水的pH值影响目标物的解离状态和稳定性,进而影响萃取效率。如图3f所示,随溶液pH值不断升高,目标物回收率逐渐增加,当pH 6时,峰面积达到最大值。当pH值继续升高时,除敌草隆和绿麦隆的峰面积基本不变外,其余目标物的峰面积略有下降。因此,本研究选择溶液介质pH 6进行实验。
2.2 响应面试验优化萃取条件
2.2.1 回归模型建立及方差分析
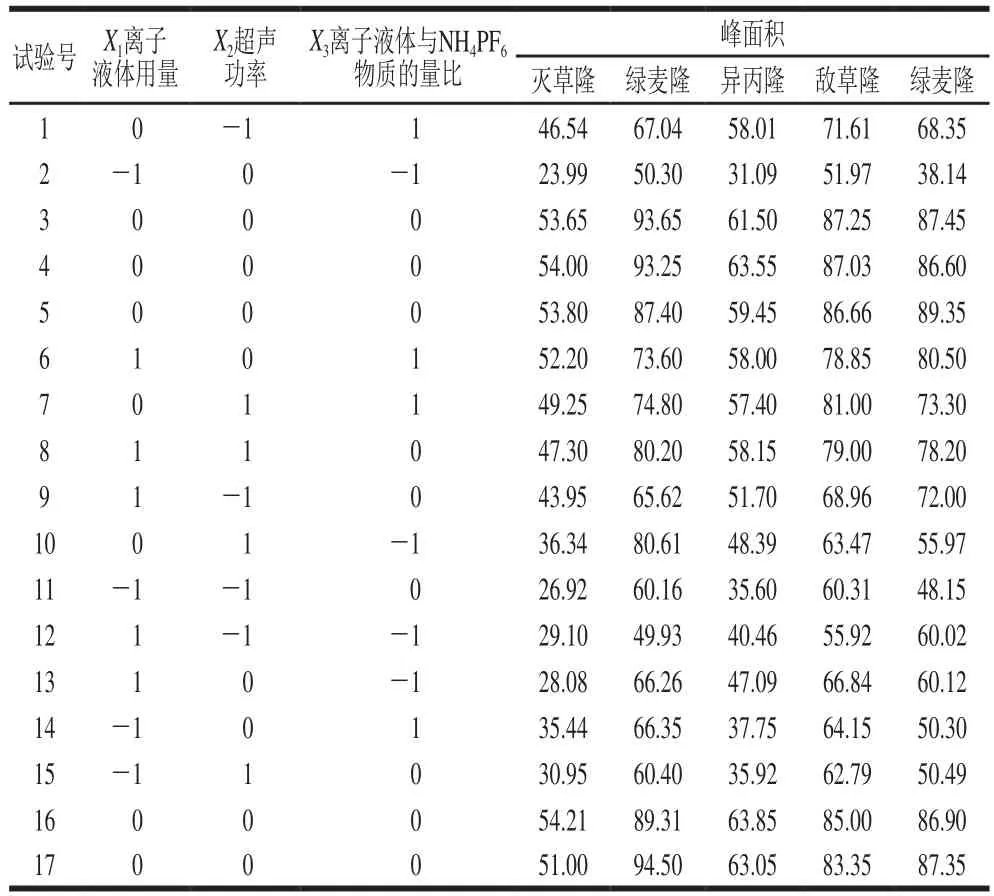
表2 Box-Behnken试验设计及结果Table 2 Experimental results of Box-Behnken design
根据响应面试验结果(表2),对各目标物进行多元二次回归拟合分析,确定自变量离子液体用量(X1)、超声功率(X2)、离子液体与NH4PF6物质的量比(X3)与因变量峰面积的回归方程为:
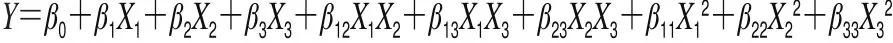
方程式各项系数如表3所示,可以看出各目标物的回归模型具有显著性(P≤0.000 3),且失拟项均不显著(P值为0.088 4~0.455 2),校正相关系数R2大于0.91,说明该模型可以很好地拟合现实实验规律,对结果具有准确的预判性。因此,该模型可以用于苯脲类化合物提取方法的优化和预测。
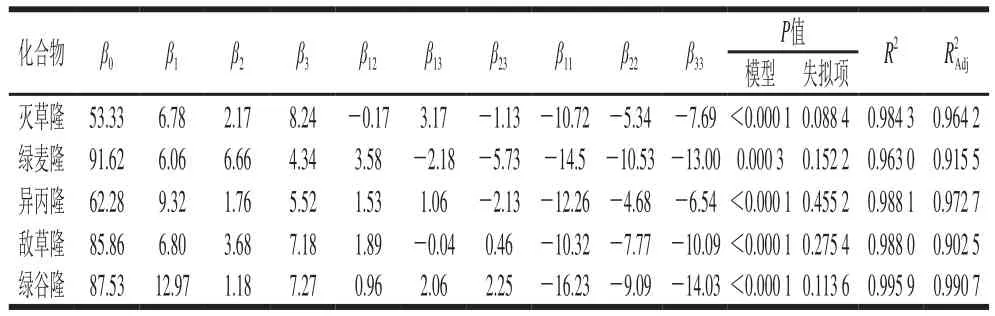
表3 回归方程参数Table 3 Parameters of regression equations
2.2.2 响应面试验结果
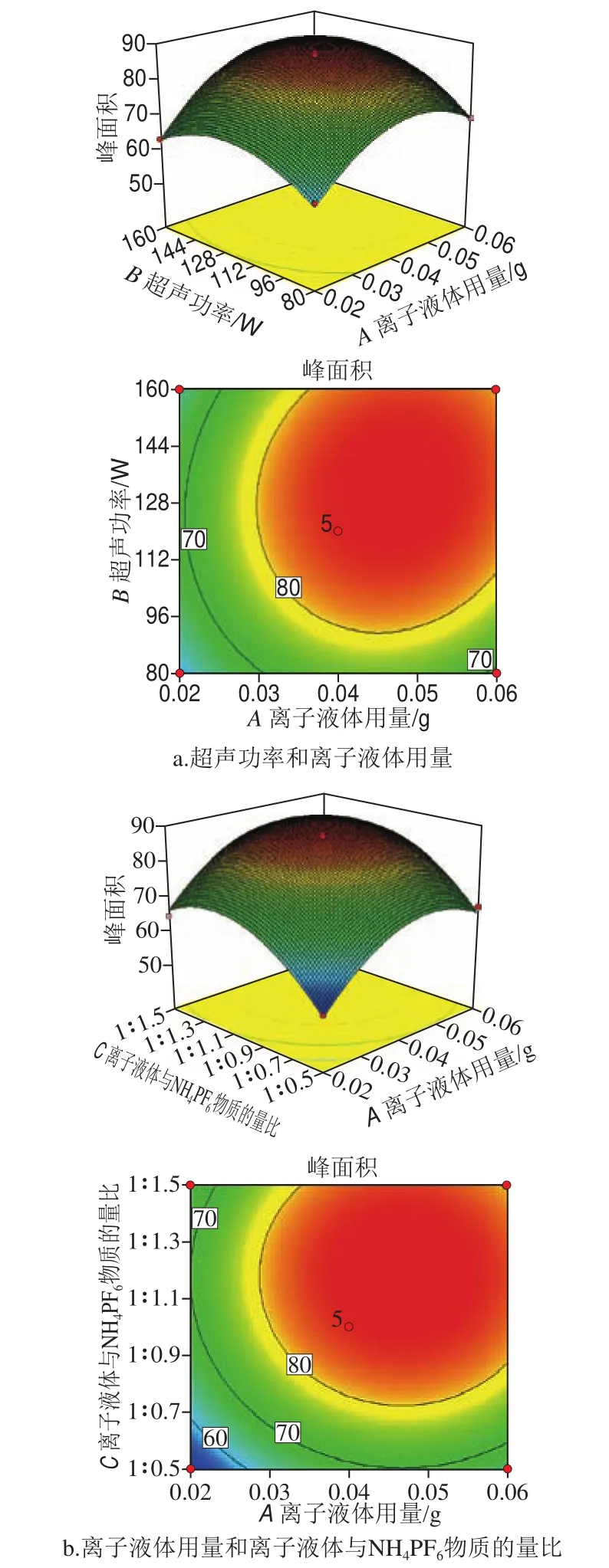
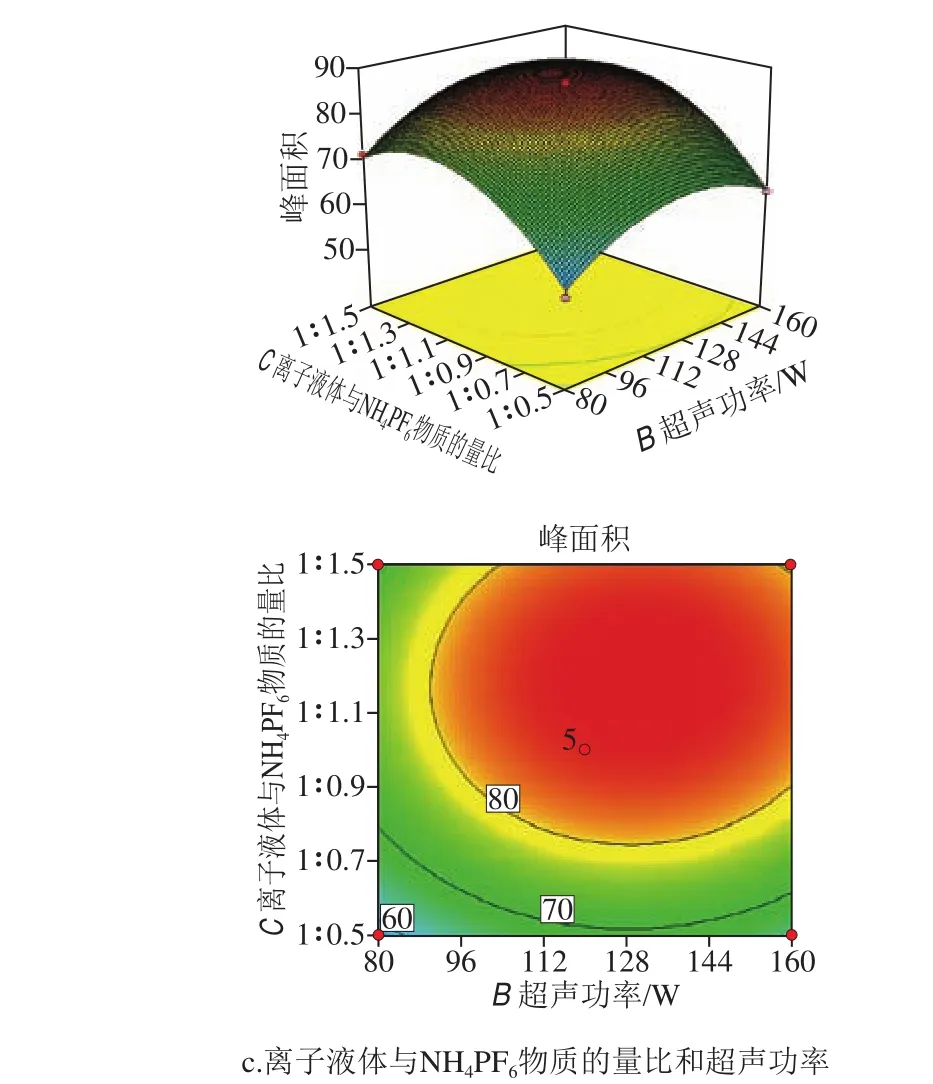
图4 响应面及等高线分析各因素相互作用对苯脲峰面积的影响Fig. 4 Response surface and contour plots showing the interactive effects of extraction conditions on peak areas of phenylureas
以敌草隆的多元二次回归模型为例,进行响应面分析,可以很好地观察出各因素之间相互作用对目标物峰面积的影响,如图4所示。
图4b中两因素等高线的疏密程度大致相等,说明离子液体用量和离子液体与NH4PF6物质的量比相互影响较弱,但两者坡度变化较陡,因而对峰面积影响较大,是影响目标物峰面积的主要因素。通过比较图4a和图4c可以看出相对于上述两个条件,超声时间对目标化合物提取效率的影响最弱。同时由方差分析可得离子液体用量、超声时间、离子液体与NH4PF6物质的量比的F值分别为98.24、28.78、109.29,即各因素对敌草隆峰面积影响的强弱顺序为离子液体与NH4PF6物质的量比>离子液体用量>超声时间,这与单因素试验及响应面分析结果一致。
2.2.3 最优条件确定及回归模型验证
基于Box-Behnken试验设计结果,综合考虑实验科学性和可操作性,苯脲类化合物最佳萃取条件为离子液体用量0.048 g、超声功率120 W、离子液体与NH4PF6物质的量比1∶1.18,在此条件下进行6 次验证实验,敌草隆峰面积平均值为87.42。该实验结果表明,5 种化合物的二次多元回归方程可以很好地拟合实验结果,对实验结果具有一定的预测性。
2.3 方法学评价
2.3.1 线性关系、定量限和方法检出限
以加标质量浓度(c)为横坐标,以峰面积(A)为纵坐标绘制标准工作曲线,得到线性回归方程以及相关系数。在最优实验条件下,按照1.3.3、1.3.4节实验步骤,对11 组低质量浓度的空白加标样品进行分析,用所得的结果计算方法检出限和定量限。如表4所示,该实验方法具有良好的线性关系(r≥0.998 1),其检出限和定量限分别为2.1 9~5.3 5 µg/k g和7.30~17.82 µg/kg。
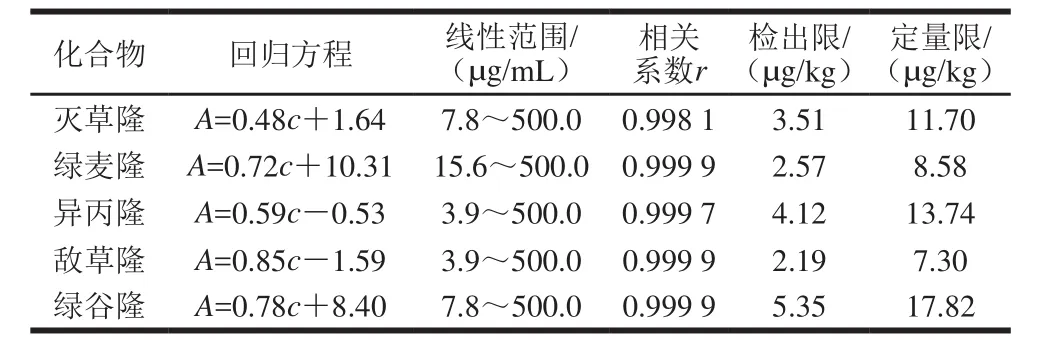
表4 线性关系、检出限和定量限(n=3)Table 4 Linear regressions, limits of detection and limits of quantitation for the analytes (n= 3)
2.3.2 精密度
通过分析加标量为25、100 µg/kg的两组样品的回收率和相对标准偏差(relative standard deviation,RSD),可以确定该方法的精密度。日内精密度是1 d内对同一样品连续分析6 次测得回收率的RSD,日间精密度是每天分析2 次、连续分析3 d所测得回收率的RSD。如表5所示,该方法的日内和日间精密度分别为2.13%~7.66%和2.46%~8.88%,说明该实验方法具有良好的精密度。
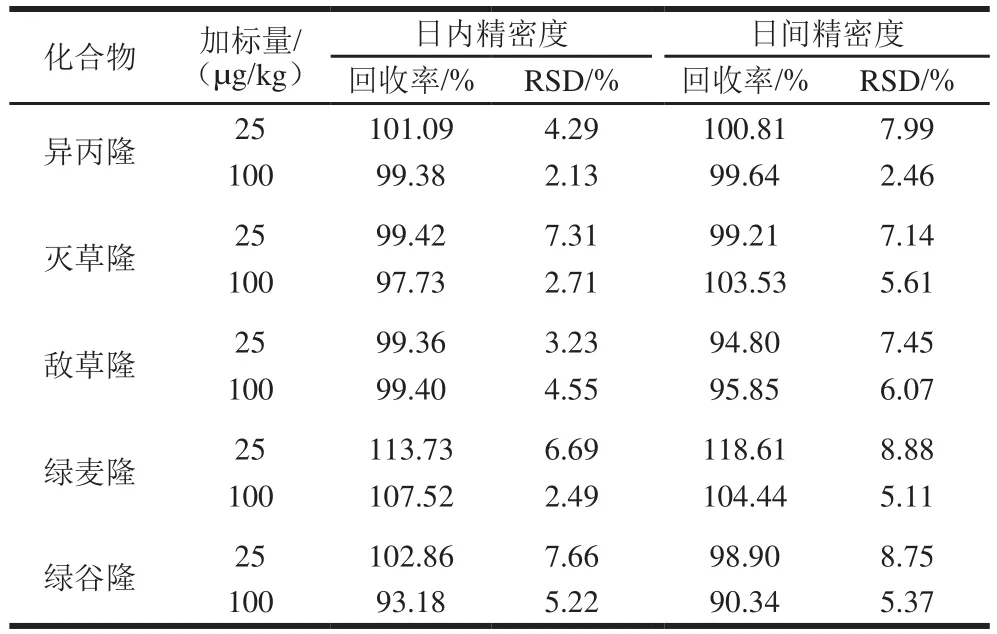
表5 日内和日间精密度(n=6)Table 5 Intra-day and inter-day precisions for the analytes (n= 6)
2.3.3 回收率
为考察仅用纯水涡旋提取时,苯脲类农药是否能完全转移到样品溶液中,本研究按照1.3.2节步骤处理样品,对所得样品溶液进行色谱分析。结果表明,灭草隆、绿麦隆、异丙隆、敌草隆和绿麦隆的转移率分别为72.25%、85.30%、93.31%、84.82%和89.94%,说明当用纯水涡旋提取时,除灭草隆外,其余4 种苯脲类农药超过84%均能转移到样品溶液中,这与文献[28]报道一致。
为考察本法的准确度,本研究分析5 种蔬菜样品。如表6所示,蔬菜中各种目标分析物的加标回收率在82.84%~117.49%之间,其RSD为0.18%~9.93%。实验证明该法准确度较高,结果令人满意。
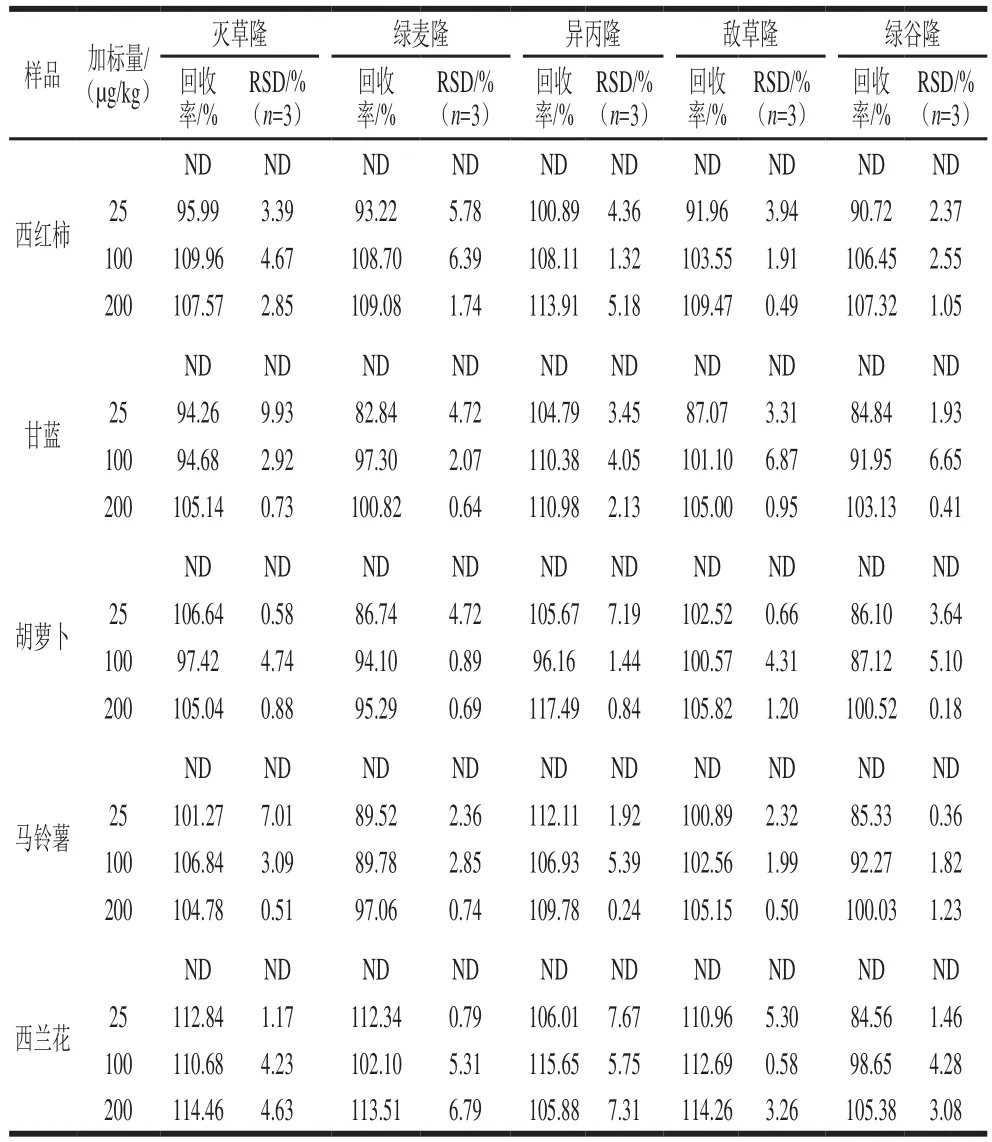
表6 西红柿、甘蓝、胡萝卜、马铃薯、西兰花样品中苯脲类农药残留测定Table 6 Analysis of phenylurea residues in tomato, cabbage, carrot,potato, and broccoli samples
2.4 实际样品分析结果
为考察本法的适用性,本研究对西红柿、甘蓝、胡萝卜、马铃薯、西兰花5 种样品进行分析检测,结果表明,各种样品中均未检测到苯脲类农药残留,色谱图如图5所示。
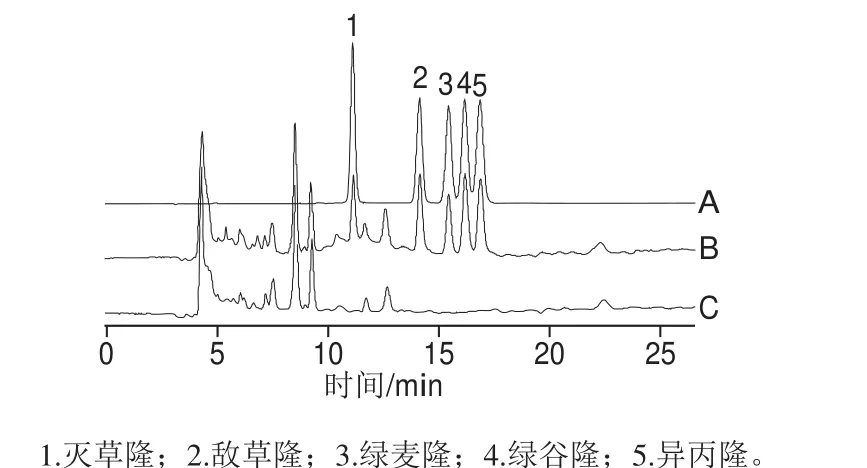
图5 标准溶液(A)、加标样品(B)和空白样品(C)色谱图Fig. 5 Chromatograms of standard solution (A), spiked sample (B) and blank sample (C)
2.5 方法比较
本法使用离子液体代替传统有溶剂作萃取剂,既减少了萃取溶剂的用量,也减轻对实验人员身体的影响。将沉积固化离子液体均相液液微萃取与高效液相色谱相结合,通过控制温度实现萃取溶剂和样品溶液的快速分离,使提取过程变得更加快捷、高效,同时使目标化合物的检出限更低,方法具有更高的灵敏度(表7)。因此,相对于其他方法,本法在萃取溶剂的安全性、操作的简便性以及高效性方面具有一定的优势。
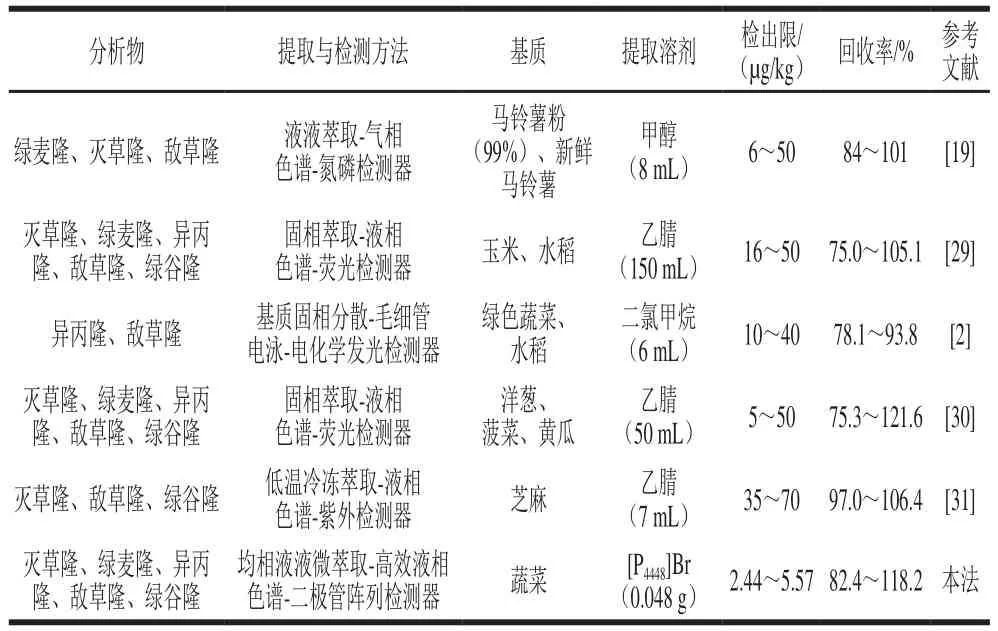
表7 方法比较Table 7 Comparison between the proposed method and other methods
3 结 论
本方法在超声辅助条件下将沉积固化离子液体与均相液液微萃取相结合用于食品中苯脲类化合物的提取,并通过高效液相色谱-二极管阵列检测器对目标物进行分析。该方法在液液微萃取的基础上,用水溶性、高密度、低温固化型离子液体代替传统有机溶剂作为萃取剂,既减少了萃取溶剂的使用量,也避免了旋蒸、回溶等实验步骤。具有萃取溶剂用量少,萃取时间短,实验操作简单、方便等优点,可用于食品中苯脲类农药残留的分析检测。
